毕赤酵母液滴微流控高通量筛选方法的建立与应用
吕彤,涂然,袁会领,刘浩,王钦宏
毕赤酵母液滴微流控高通量筛选方法的建立与应用
吕彤1,2,涂然2,袁会领2,刘浩1,王钦宏2
1 天津科技大学 生物工程学院,天津 300457 2中国科学院天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308
巴斯德毕赤酵母是当前应用最为方便和广泛的外源蛋白表达系统之一,为了进一步提高其表达外源蛋白的能力,文中建立了基于液滴微流控的毕赤酵母高通量筛选方法,并以木聚糖酶融合荧光蛋白为例,筛选获得木聚糖酶表达和分泌能力提高的突变株。通过PCR扩增得到木聚糖酶基因和绿色荧光蛋白基因融合片段,并克隆到毕赤酵母表达载体pPIC9K中构建出木聚糖酶融合绿色荧光蛋白的质粒pPIC9K,电转化至毕赤酵母GS115中得到表达木聚糖酶和绿色荧光蛋白的毕赤酵母SG菌株。该菌株经过常压室温等离子体诱变后进行单细胞液滴包埋,液滴培养24 h后进行微流控筛选,获得高表达木聚糖酶的突变菌株,进而用于下一轮的诱变突变库构建和筛选。以此类推,经过5轮液滴微流控筛选,获得一株高产菌株SG-m5,其木聚糖酶活为149.17 U/mg,较出发菌株提升300%,分泌外源蛋白的能力较出发菌株提高160%。文中建立的毕赤酵母单细胞液滴微流控高通量筛选方法能达到每小时10万菌株的筛选通量,筛选百万级别的菌株库仅需10 h,消耗荧光试剂体积100 μL,对比传统的微孔板筛选方法降低试剂成本近百万倍,为高效、低成本筛选获得表达和分泌外源蛋白能力提高的毕赤酵母提供了一条新途径。
毕赤酵母,液滴微流控,高通量筛选,单细胞,外源蛋白表达,蛋白分泌
巴斯德毕赤酵母表达系统是20世纪80年代开发的一种外源蛋白真核表达系统。该表达系统既具有原核表达系统操作简单、成本低等特点,也具有真核表达系统的优质性,如糖基化、蛋白磷酸化等蛋白翻译后的修饰功能,因此很快成为了应用最为广泛的外源基因表达系统之一,已经成功地表达了包括激素、疫苗、细菌毒素、酶及其衍生物等超过1 000种外源蛋白[1]。虽然毕赤酵母表达系统是当前最有效、最方便的外源蛋白表达系统之一,但是仍存在外源基因不稳定、分泌效率差异、蛋白表达量低等问题[2]。为此,人们从外源基因、宿主菌、表达载体、翻译后修饰和发酵条件等方面对毕赤酵母表达系统进行优化,并通过平板或孔板的筛选方法来获得性能提高的表达菌株[3]。然而,这种常规的筛选方法存在成本高、耗时长、通量低等问题,无法快速有效地筛选出高表达菌株,因此建立一种有效的高通量筛选方法具有重要意义。
液滴微流控技术是近些年发展起来的高通量筛选新技术,该技术通过在几个平方厘米的芯片上设计制备若干微通道,并在这些微通道内进行样品制备、反应、分离、检测及细胞培养、检测和分选等操作步骤的一种技术平台[4]。液滴微流控的筛选系统最大的优势在于可以将单细胞包埋在液滴中,每个液滴皆可作为独立的微反应器进行细胞的培养及其代谢物或酶生产,并通过对液滴内物质信号的检测进行分析与分选。其最高筛选通量达108/d,具有检测试剂消耗成本低、速度快、通量高的显著特点,实现了包括大肠杆菌、枯草芽孢杆菌、酿酒酵母等不同类型微生物宿主生产酶或代谢产物的高通量筛选[5-9]。在本研究中,我们以木聚糖酶为例,通过单细胞液滴包埋条件、液滴培养和筛选时间等参数优化,建立了基于液滴微流控的毕赤酵母表达系统的高通量筛选方法,为获得表达和分泌外源蛋白能力提高的毕赤酵母工程菌株提供了一条新途径。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
克隆宿主菌大肠杆菌DH5α,购自北京全式金公司;表达宿主菌毕赤酵母GS115为实验室保藏菌种,木聚糖基因来源于芽孢杆菌sp. QH14/XynQH14,重组质粒pPIC9K-和含外源的毕赤酵母重组子SG由本实验构建。
1.1.2 培养基
大肠杆菌生长液体培养基LB:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L。
酵母生长液体培养基YPD:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,葡萄糖10.0 g/L。
转化及筛选固体培养基MD:YNB 13.4 g/L,生物素4×10–4g/L,葡萄糖10.0 g/L,琼脂20.0 g/L。
诱导培养基BMGY:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,YNB 13.4 g/L,生物素4×10–4g/L,磷酸氢二钾1.95 g/L,磷酸二氢钾5.9 g/L,甘油10.0 g/L。
诱导培养基BMMY:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,YNB 13.4 g/L,生物素4×10–4g/L,磷酸氢二钾1.95 g/L,磷酸二氢钾5.9 g/L,甲醇2.5 mL。
1.1.3 主要试剂
DNA Marker购自北京博迈德生物技术有限公司。限制性内切酶(RⅠ、Ⅰ、Ⅱ)、T4 DNA连接酶均购自New England Biolabs (NEB) 公司。Fast、dNTPs购自北京全式金公司。DNA质粒提取试剂盒购自Axygen公司。琼脂糖凝胶电泳胶回收试剂盒和快速纯化试剂盒购自北京康为世纪生物科技有限公司。榉木木聚糖(Beechwood xylan) 购自Sigma公司。其他试剂均为国产试剂。液滴微流控所用荧光底物、试剂和芯片购自杰灵科学仪器有限公司。
1.2 方法
1.2.1 重组质粒的构建
用DNA质粒提取试剂盒提取pPIC9K质粒,经过RⅠ和Ⅰ过夜双酶切后,用琼脂糖凝胶电泳胶回收试剂盒回收载体片段。将800 bp的绿色荧光蛋白片段和600 bp的木聚糖酶通过PCR (PCR扩增条件:95 ℃ 5 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 1.5 min,共35个循环;72 ℃ 5 min)融合得到1 400 bp的木聚糖酶融合绿色荧光蛋白片段,RⅠ和Ⅰ双酶切后回收,用T4 DNA连接酶与酶切回收的载体pPIC9K连接,转化至DH5α感受态细胞,涂布于LB平板,37 ℃培养,挑取单菌落进行阳性克隆验证。采用通用引物5′-AOX1 (5′-GACTGGTTCCAATTGAC AAGC-3′) 和3′-AOX1 (5′-GCAAATGGCATTCTG ACATCC-3′) 进行测序验证(北京华大基因),测序正确的重组质粒命名为pPIC9K-。
1.2.2 毕赤酵母细胞的电击转化及诱导表达
重组表达质粒pPIC9K-经Ⅱ过夜酶切线性化后切胶回收,将10 μg线性化片段与80 μL毕赤酵母GS115感受态混合置于0.2 cm电转杯,冰浴10 min,采用电穿孔法1.1 kV电压电击后加入500 μL山梨醇,30 ℃静置2 h后涂布于MD平板至出现转化子。
将重组毕赤酵母菌株接种于含有2 mL YPD培养基的试管中,30 ℃、250 r/min培养14 h,测定细胞浊度,当600为0.1时转接至2 mL BMGY培养基中,30 ℃、250 r/min培养14 h,8 000 r/min离心2 min收集细胞,用无甲醇的BMMY培养基洗涤重悬后,当600为1时转接至5 mL BMMY培养基(含终浓度1%的甲醇),30 ℃、250 r/min诱导24 h后,荧光显微镜观察GFP荧光蛋白表达信号。
1.2.3 液滴包埋方法
菌株接种于2 mL YPD培养基中,30 ℃、250 r/min培养14 h,当600为0.1时转接至BMGY培养基,30 ℃、250 r/min培养14 h,菌体洗涤重悬当600为1时转接至5 mL BMMY无甲醇培养基中,超声处理(超声破碎仪总功率950 W,使用功率4%,超声9.9 s,停9.9 s,共 1 min) 获得单分散的毕赤酵母细胞[10]。随后采用液滴生成芯片制备单细胞液滴,其中水相为含有不同成分的细胞悬浮液,主要包含:20 μL不同菌体浓度(600为0.5或者0.3) 的单分散毕赤酵母细胞悬液,加入到培养基BMMY (含终浓度5% BSA和1%甲醇),总体积200 μL。根据实验需要,在上述水相中添加终浓度为10 μmol/L或者20 μmol/L的荧光检测底物S13 (激发波长Ex 532 nm,发射波长Em 610 nm)。将油相和水相分别加入到1 mL注射器内,注射器置于注射泵中与芯片连接,设定油相300 μL/h,水相100 μL/h,通过液滴制备芯片制备单细胞液滴,生成液滴直径约25 μm,单细胞液滴30 ℃静置培养至所需时间后进行信号检测。
1.2.4 常压室温等离子体诱变方法
将菌株接种于2 mL YPD试管中,30 ℃、250 r/min培养14 h,5 000 r/min离心5 min去除培养基,用生理盐水重悬菌体,测定600值。当600为1时转接至5 mL生理盐水中超声处理。将常压室温等离子体(Atmospheric and room temperature plasma) ARTP处理仪专用的载片在酒精灯上灼烧灭菌,冷却后取10 μL菌液均匀涂在载片上,用镊子夹取载片置于等离子诱变仪的载片凹槽之中。参数设置为:载气:高纯氦气(99.999%);入射功率200 W;载体流速:10 SLM;处理温度:25 ℃;反射功率:40 W;调节载台下方旋钮,使载片处于气流端口2 mm处,照射时间分别为0、30、40、50、60、90 s进行诱变,诱变处理结束后,将载片置于装有1 mL生理盐水离心管中,用涡旋振荡清洗2 min,将载片上的菌体全部洗脱,得到的菌悬液稀释100倍,取100 μL涂布于YPD平板上,以0 s作为对照,30 ℃静置培养至长出单菌落。观察不同照射时间对致死率的影响。
致死率(%)=(B−A)/B×100% (1)
式中,A为ARTP诱变处理组平板上的菌落数;B为未经ARTP诱变处理的出发菌株平板上的菌落数。
从上述计算致死率的YPD平板上,按照不同的诱变处理时间条件挑选适量菌株(记录为总菌株数),培养后进行荧光信号检测。以0 s平板上的单菌落作为对照菌株,荧光信号高于对照菌株的菌株统计为正突变株。
正突变率(%)=正突变菌株数/总菌株数×100% (2)
1.2.5 液滴微流控筛选
菌株经ARTP诱变后涂布于YPD平板上,14 h后洗脱菌体,当600为0.3时进行包埋,方法见1.2.3。液滴静置于恒温培养箱30 ℃培养24 h,筛选时设定液滴流速为10–15 μL/h,油相流速为200–250 μL/h,液滴筛选速度约250 Hz,分选阈值为液滴细胞信号最高的0.1%,收集约200–250个 液滴至1 mL YPD EP管中,分别涂布于多个YPD平板中,30 ℃培养待长出单菌落。
1.2.6 突变株摇瓶发酵
筛选后在YPD平板中随机挑选一些单菌落接种于2 mL YPD培养基中,30 ℃、250 r/min培养14 h,当600为0.1时转接至2 mL BMGY培养基,30 ℃、250 r/min培养14 h,洗脱重悬后当600为1时转接至5 mL BMMY甲醇培养基诱导24 h。分别用酶标仪测定各菌株的600,全细胞和上清荧光值(激发波长Ex 490 nm,发射波长Em 520 nm),DNS法测定酶活。
1.2.7 酶活检测
通过DNS法检测木聚糖酶活性[11]。取20 μL适当稀释倍数的表达酶液,加入180 μL 1%木聚糖底物溶液,50 ℃保温15 min后加入300 μL DNS显色试剂终止反应,沸水浴8 min,加入1.5 mL 蒸馏水,在540 nm波长测定还原糖含量(以木糖计),使用灭活的酶液作为对照。以木糖为底物绘制标准曲线,计算木聚糖酶酶活。
2 结果与分析
2.1 重组质粒的构建
本研究中我们通过木聚糖酶融合绿色荧光蛋白的方式,将木聚糖酶的表达量和酶活性转化为液滴微流控筛选所需的荧光信号,为后续根据荧光信号的强弱进行工程菌株分选奠定基础。
将从sp. QH14/XynQH14 PCR扩增的木聚糖酶片段和绿色荧光蛋白通过PCR扩增融合得到1 400 bp的片段,并构建至毕赤酵母重组载体pPIC9K上。对转化子提取质粒和RⅠ和Ⅰ双酶切的验证结果表明,琼脂糖凝胶电泳分析显示1 400 bp大小的目的片段和9 000 bp载体片段(图1)。进一步测序结果表明酵母重组表达载体pPIC9K构建正确。
2.2 重组质粒的转化与表达鉴定
毕赤酵母表达系统中外源目的基因需要整合到酵母染色体中进行稳定表达。实验中,我们通过电转化方法将重组质粒pPIC9K导入到毕赤酵母GS115中进行整合。通过提取基因组以pPIC9K载体通用引物5ʹAOX1和3ʹAOX1进行PCR扩增验证整合效率。琼脂糖凝胶电泳检测结果表明PCR扩增条带1 400 bp与外源基因片段大小一致,表明毕赤酵母GS115/pPIC9K构建成功。

图1 重组质粒的酶切鉴定
上述转化子经含有1%甲醇的BMMY培养基诱导培养24 h后,置于荧光显微镜检测。空宿主菌株GS115未见绿色荧光,转化成功的转化子可见细胞呈绿色荧光(图2),表明整合到染色体上的外源荧光蛋白基因成功表达。其中,荧光表达信号最强的重组转化子SG作为后续实验出发菌株。
2.3 液滴微流控筛选方法建立
2.3.1 单细胞液滴包埋条件优化
液滴微流控技术可以将单细胞包埋在液滴中,每个液滴皆可作为独立的微反应器进行细胞的培养及其代谢物或酶生产,并根据液滴的物质信号进行检测和分选。前期研究结果表明,毕赤酵母细胞存在多细胞粘连现象(图2),为获得最佳的单细胞液滴包埋效果,本研究分别从粘连细胞的超声分散处理和液滴包埋起始细胞浓度两方面进行探究。

图2 毕赤酵母与重组毕赤酵母转化子荧光显微镜图
超声处理1 min后,毕赤酵母的粘连聚集情况显著下降,95%以上为分散的单细胞。按照泊松分布计算,当起始细胞浓度600为0.3时,理论单细胞液滴包埋率是19.2%。实验结果表明超声处理显著提高了单细胞包埋率,经过超声处理后,实际得到的单细胞包埋率是13%,比未经超声处理的单细胞包埋率高13倍。当增大起始细胞浓度(600为0.5) 时,实际得到的单细胞包埋率仅为8% (表1)。实时观测显示过高的起始细胞浓度易造成细胞在微流控芯片内堆积成团,使得实际分散细胞的数目减少,致使细胞液滴包埋率降低。综上,最终确定最佳单细胞液滴包埋条件为菌体超声分离处理1 min,细胞起始600为0.3。
2.3.2 液滴内木聚糖酶的荧光检测
荧光底物是探测酶活性的灵敏手段,本研究通过木聚糖酶的酶促催化反应,将无荧光的底物Sxyn13生成有荧光的产物,并根据反应前后荧光强度变化评价工程菌的木聚糖酶活性。
在单细胞液滴制备过程中,加入20 μmol/L或者10 μmol/L浓度的荧光反应底物Sxyn13与细胞共同包埋在液滴。静置培养细胞不同时间后,通过观察不产木聚糖酶的空宿主对照菌(GS115) 和产木聚糖酶的工程菌(SG) 液滴内的荧光信号强度,检测不同条件下的木聚糖酶表达量和酶活性。结果表明,随着底物浓度增高,液滴荧光信号增强;随着细胞液滴培养时间的增加,液滴内的荧光信号强度也同时增强,且未包埋细胞的空液滴也存在较强的背景荧光信号。在底物浓度为20 μmol/L时,工程菌SG的液滴荧光信号略强于对照菌株GS115的荧光信号,但两者差显不著异(图3)。当底物浓度降低为10 μmol/L时,不同液滴间的荧光信号差异与高底物浓度时类似,未见明显差异。综上,采用荧光底物获得荧光信号强弱差异用于筛选高酶活菌株的方式不适合本研究。
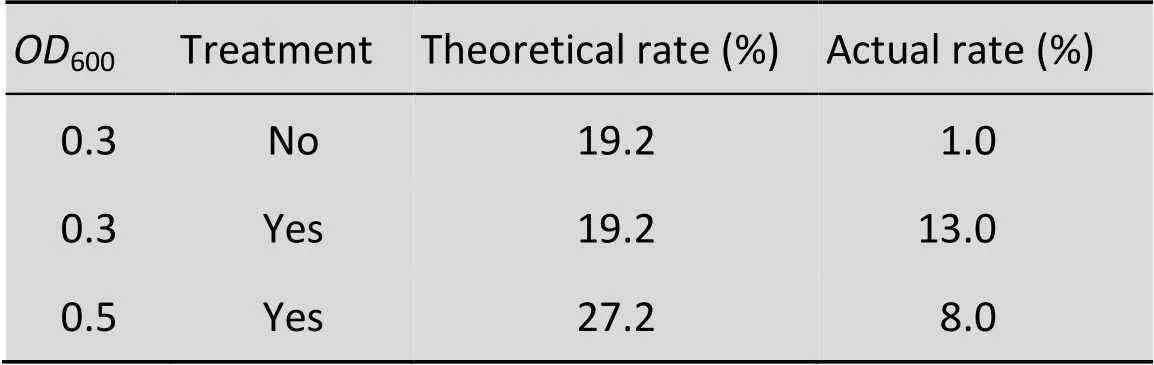
表1 不同条件下液滴的单细胞包埋率
Treatment: ultrasound treatment to disperse adherent cells; Theoretical rate (%): theoretical single cell droplets proportion; Actual rate (%): actual single cell droplets proportion.
2.3.3 液滴培养时间的优化
单细胞液滴随着培养时间增加,液滴内的工程菌表达木聚糖酶和融合的荧光报告蛋白表达量增大。我们通过对不同培养时间(16 h、24 h和48 h)的单细胞液滴内融合荧光蛋白的荧光信号和木聚糖酶活性测定,探索了空宿主菌株和工程菌株的表达差异和最适液滴培养时间。随着时间增加,工程菌株SG的荧光蛋白表达量增加,液滴的荧光信号对应增强(图4A)。酶标仪测定木聚糖酶的结果显示,SG工程菌株的木聚糖酶酶活随着时间增加显著增大,在24 h时SG工程菌株的木聚糖酶酶活比GS115空宿主对照菌株提高近4倍(图4B)。结果显示木聚糖酶酶活性的变化趋势和液滴荧光信号一致,可以通过GFP荧光信号的强弱间接反映木聚糖酶酶活,用于液滴微流控筛选。继续培养至48 h时检测,两种菌株的差异信号未见明显增加,考虑缩短筛选周期的需求,因此单细胞液滴培养24 h后进行液滴微流控高通量分选。

图3 对照菌和工程菌液滴的木聚糖酶酶活检测荧光信号图
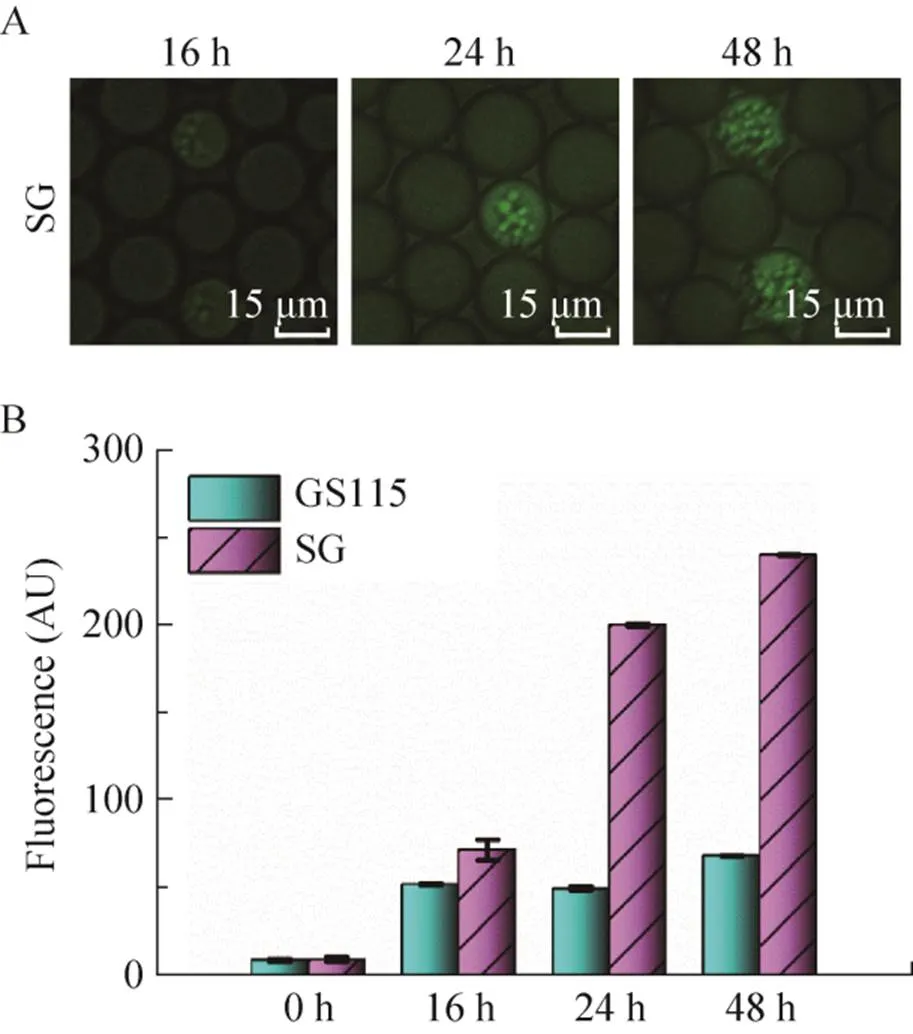
图4 液滴GFP荧光信号和木聚糖酶活检测
通过上述研究,确定了液滴微流控的检测筛选条件为:细胞经1 min间歇超声处理分散成单细胞后,调整细胞起始浓度600为0.3制备单细胞液滴,液滴培养在含有1%甲醇的BMMY培养基,30 ℃诱导培养24 h后进行液滴微流控筛选。
2.4 ARTP诱变和突变体菌株库构建
ARTP诱变通过控制等离子强度破坏其DNA结构,进而改变其生物特性,较高的致死率能获得有效的突变率,研究表明致死率90%以上效果较佳[12]。分别选取0、30、40、50、60、90 s共计6个不同的ARTP处理时间,对出发菌株SG进行诱变处理并统计菌落数,绘制致死率曲线(图5)。结果显示30 s内致死率急速增长到60%,从40 s到90 s缓慢增大致死率接近100%。根据现代育种理论,当致死率在90%–95%之间时,突变库中突变体正向突变概率最大[13],结合致死曲线图可知当诱变时间为60 s时,突变库致死率为95%处于最佳诱变致死区间,且该时间点的正突变率为20%,高于其他时间点的正突变率,因此本实验选择60 s为最佳诱变时间。
2.5 突变菌株库的液滴微流控筛选
以SG为出发菌株,经ARTP诱变后建立突变菌株库,进行单细胞液滴制备、培养和筛选,得到蛋白荧光信号强的液滴涂布平板。从筛选获得的单菌落中随机挑选出部分菌株,采用摇瓶发酵,甲醇诱导24 h后测定发酵液上清的荧光值及酶活,得到一株木聚糖酶高表达的菌株SG-m1。以SG-m1为出发菌株,进行同样流程的第二轮诱变建库和液滴微流控筛选,以此类推。经过5轮筛选,突变菌株表达木聚糖酶的酶活力逐步增加,最终得到一株木聚糖酶高表达菌株SG-m5,发酵液上清的酶活力值为149.17 U/mg,比出发菌株SG提高300% (图6)。

图5 ARTP诱变致死曲线
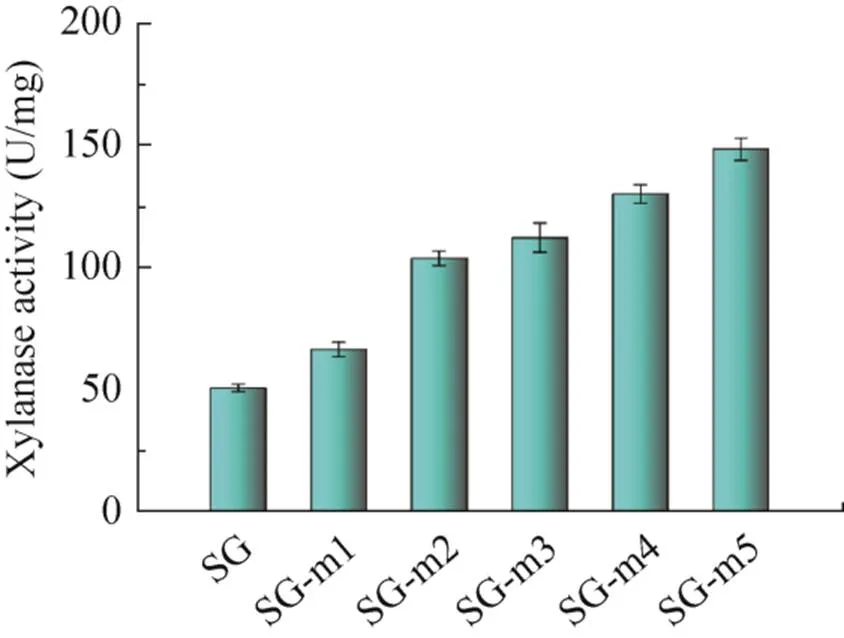
图6 菌株发酵上清液的木聚糖酶酶活
2.6 菌株分泌特性研究
通过测定菌体的发酵液的上清和细胞菌体的荧光值,计算上清/细胞菌体的荧光比例来探究菌株的分泌特性。
将5轮依次筛选出的高表达菌株分别进行50 mL摇瓶发酵,甲醇诱导24 h后测定其600值,上清荧光值、细胞菌体荧光值,并计算出分泌比例。对菌体的细胞生长曲线和镜检结果表明,菌体处于对数生长期,菌体完整未裂解,且菌体沉淀的荧光信号高于菌体上清液的荧光信号。经过多轮的液滴微流控筛选,获得的高产菌株不仅木聚糖酶的产量得到提高,而且分泌能力也得到了提高,对比出发菌株SG,筛选获得突变菌株SG-m5的分泌能力提高了160% (图7)。

图7 菌株分泌特性分析
3 讨论
毕赤酵母作为一种成熟的外源蛋白表达系统,已经实现了1 000多种外源蛋白的表达,其多个优良的表达特性早已得到广泛验证,如分泌效率高、遗传操作简单、培养成本低等。目前,针对外源蛋白在毕赤酵母中的高效表达,一方面在分子水平上对外源基因进行改造,能够大大提高外源基因的表达,另一方面利用高通量筛选技术来获得高表达菌株[3]。先前报道中,毕赤酵母的筛选方法主要是基于平板等传统方法,如利用刚果红染色法或者G418抗性筛选,其筛选的库容量为2 000个左右[14-15]。由于毕赤酵母的外分泌特性,表达的产物分泌到细胞外,不能使用针对细胞筛选的流式细胞仪[16]。液滴微流控作为新兴的高通量筛选方法,能将单细胞包埋在独立的微反应器中,进行细胞的培养及其代谢物或酶表达,并通过对液滴内物质信号的检测进行分析与分 选[6-10]。本研究以木聚糖酶融合荧光蛋白的毕赤酵母菌株为例,通过对单细胞液滴制备、液滴内荧光信号检测、筛选模型测试等条件探索,建立了毕赤酵母液滴微流控的筛选方法,其单细胞包埋效果及分选速度和效果等与已报道的酿酒酵母液滴微流控筛选体系具有可比性。本研究建立的毕赤酵母液滴微流控筛选方法的筛选通量可以达到每小时10万个菌株,筛选百万容量的菌株库仅需10 h,消耗荧光试剂体积100 μL,对比传统的微孔板筛选方法降低试剂成本近百万倍,填补了毕赤酵母高通量筛选技术的空缺,为高效、低成本筛选获得表达和分泌外源蛋白能力提高的毕赤酵母菌株提供了一条新途径。
[1] Juturu V, Wu JC. Heterologous protein expression in: latest research progress and applications. ChemBioChem, 2018, 19(1): 7–21.
[2] Zhu W, Hu YJ, Xie LP. Related strategies and research progress of efficient expression of heterologous proteins in. Chin J Pharm, 2018, 49(4): 417–425 (in Chinese). 朱文, 胡又佳, 谢丽萍. 毕赤酵母高效表达外源蛋白的相关策略及研究进展. 中国医药工业杂志, 2018, 49(4): 417–425.
[3] Ahmad M, Hirz M, Pichler H, et al. Protein expression in: recent achievements and perspectives for heterologous protein production. Appl Microbiol Biotechnol, 2014, 98(12): 5301–5317.
[4] Yuan HL, Dong LB, Tu R, et al. Micro-droplet characterization and its application for amino acid detection in droplet microfluidic system. Chin J Biotech, 2014, 30(1): 139–146 (in Chinese). 袁会领, 董立兵, 涂然, 等. 液滴微流控芯片系统中微液滴特性表征及氨基酸检测应用. 生物工程学报, 2014, 30(1): 139–146.
[5] Agresti JJ, Antipov E, Abate AR, et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proc Natl Acad Sci USA, 2010, 107(9): 4004–4009.
[6] Baret JC, Miller OJ, Taly V, et al. Fluorescence-activated droplet sorting (FADS): efficient microfluidic cell sorting based on enzymatic activity. Lab Chip, 2009, 9(13): 1850–1858.
[7] Ma FQ, Chung MT, Yao Y, et al. Efficient molecular evolution to generate enantioselective enzymes using a dual-channel microfluidic droplet screening platform. Nat Commun, 2018, 9(1): 1030.
[8] Qiao YX, Zhao XY, Zun J, et al. Fluorescence-activated droplet sorting of lipolytic microorganisms using a compact optical system. Lab Chip, 2018, 18(1): 190–196.
[9] Huang MT, Bai YP, Sjostrom SL, et al. Microfluidic screening and whole-genome sequencing identifies mutations associated with improved protein secretion by yeast. Proc Natl Acad Sci USA, 2015, 112(34): E4689–E4696.
[10] Sjostrom SL, Bai YP, Huang MT, et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab Chip, 2014, 14(4): 806–813.
[11] Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem, 1959, 31(3), 426–428.
[12] Li HY, Zeng WZ, Zhou JW. High-throughput screening offor high production of pyrroloquinoline quinone. Chin J Biotech, 2018, 34(5): 794–802 (in Chinese).李宏月, 曾伟主, 周景文. 高产吡咯喹啉醌扭脱甲基杆菌的高通量选育. 生物工程学报, 2018, 34(5): 794–802.
[13] Lu Y, Wang LY, Ma K, et al. Characteristics of hydrogen production of anmutant generated by a new atmospheric and room temperature plasma (ARTP). Biochem Eng J, 2011, 55(1): 17–22.
[14] Yang R, Fan GS, Li JL, et al. Screening of high-yield xylananse produced by recombinantand of its fermentation condition optimizing. J Chin Inst Food Sci Technol, 2017, 17(12): 95–104 (in Chinese). 杨然, 范光森, 郦金龙, 等. 重组毕赤酵母高产木聚糖酶菌株筛选及发酵条件优化. 中国食品学报, 2017, 17(12): 95–104.
[15] Wang DD, Zhou CY, Li TB, et al. Efficient expression of the xylanase gene-2 fromXZ-3S in. Sci Technol Food Ind, 2015, 36(7): 200–203, 280 (in Chinese). 王丹丹, 周晨妍, 李同彪, 等. 黑曲霉XZ-3S木聚糖酶基因-2在毕赤酵母中的高效表达. 食品工业科技, 2015, 36(7): 200–203, 280.
[16] Abatemarco J, Sarhan MF, Wagner JM, et al. RNA-aptamers-in-droplets (RAPID) high-throughput screening for secretory phenotypes. Nat Commun, 2017, 8(1): 332.
Development and application of a droplet-based microfluidic high-throughput screening of Pichia pastoris
Tong Lü1,2, Ran Tu2, Huiling Yuan2, Hao Liu1, and Qinhong Wang2
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China 2 Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
is one of the most convenient and widely used heterologous protein expression systems. To further improve its ability to express heterologous proteins, we developed a high-throughputscreening method based on droplet microfluidic and demonstrated the method by screening and obtaining mutants with enhanced xylanase expression and secretion abilities. We used PCR (Polymerase Chain Reaction) amplification to obtain a fusion fragment of xylanasegene and green fluorescent proteingene, and cloned this fragment into pPIC9K, the expression vector of, to construct the plasmid pPIC9K-that recombined the DNA fragments of xylanase and green fluorescent protein. After this plasmid enteredGS115 by electroporation, theSG strain that could express xylanase and green fluorescent protein was obtained. The above-said strains were then mutagenized by atmospheric room temperature plasma and subsequently encapsulated to form single-cell droplets. After 24-hour cultivation of the droplets, microfluidic screening was carried out to obtain the mutant strain with high xylanase expression for further construction and screening of the next mutagenesis library. After five rounds of droplet microfluidic screening, a highly productive strainSG-m5 was obtained. The activity of the expressed xylanase was 149.17 U/mg, 300% higher than that of those expressed by the original strain SG. This strain’s ability to secrete heterologous protein was 160% higher than that of the original strain. With a screening throughput of 100 000 strains per hour, the high-throughputscreening system based on single-cell droplet microfluidic developed by the present study screens a library with million strains in only 10 hours and consumes only 100 µL of fluorescent reagent, thus reducing the reagent cost by millions of times compared with the traditional microplate screening and more importantly, providing a novel method to obtainwith high abilities to express and secret heterologous proteins by efficient and low-cost screening.
, droplet microfluidics, high-throughput screening, single cell, heterologous protein expression, protein secretion
February 1, 2019;
April 15, 2019
Science and Technology Service Network Initiative of the Chinese Academy of Sciences (No. KFJ-SW-STS-165),Instrument Developing Project of the Chinese Academy of Sciences (No. YJKYYQ20170023).
s: Ran Tu. Tel/Fax: +86-22-24828705; E-mail: tu_r@tib.cas.cn Qinhong Wang. Tel/Fax: +86-22-84861950; E-mail: wang_qh@tib.cas.cn
中国科学院科技服务网络计划(No. KFJ-SW-STS-165),中国科学院科研装备研制项目(No. YJKYYQ20170023) 资助。
2019-04-24
http://kns.cnki.net/kcms/detail/11.1998.q.20190424.1038.001.html
吕彤, 涂然, 袁会领, 等. 毕赤酵母液滴微流控高通量筛选方法的建立与应用. 生物工程学报, 2019, 35(7): 1317–1325.
Lü T, Tu R, Yuan HL, et al. Development and application of a droplet-based microfluidic high-throughput screening of. Chin J Biotech, 2019, 35(7): 1317–1325.
(本文责编 郝丽芳)

