基于基因检测方法快速鉴别不同种类畜肉
耿 多,陈 辉,罗瑞明,王丽娟
(宁夏大学,宁夏银川 750021)
随着人们生活水平的提高和消费观念的转变,肉制品的需求量逐年攀升,在利益的驱使下,很多商贩为了提高商业利润,在高价肉及肉制品中掺入廉价肉,同时使用各种添加剂调整产品口味及色泽,以达到以假乱真的效果。尤其是牛、羊肉卷和羊肉串等加工制品,消费者难以从纹理和口感上对其进行甄别。这些掺假肉制品的出现不仅严重侵犯了消费者权益,更对消费者的身体健康造成了严重危害。因此,建立一种精准、快速、高通量的检测方法,为动物源性食品监管提供有力的技术支撑,是当前亟需解决的重要问题。
目前,肉类食品成分鉴别分析技术大多只针对单一畜种样品检测,能够对多畜种畜肉同时检测且检测时间低于2 h的检测方法研究较少,能对牛、羊、猪、狗、马5个畜种畜肉同时检测的尚未有报道。因此国内外学者致力于降低检测时间达到快速检测及提高检测通量等相关方面的研究[1]。已报道的相关检测方法主要基于核酸分析,包括限制性内切酶酶切片段长度多态性分析(PCR-RFLP)[2-3]、随机扩增多态性DNA技术(RAPD-PCR)[4]、物种特异性PCR(SSR)[5]、DNA序列分析(SA,Sequence Analysis)[6]、实时荧光定量PCR(Real-Time PCR)[7]、DNA条形码(DNA Barcoding)[8]等。从核酸分子水平上进行物种鉴别相较于蛋白质和光谱分析具有显著优势[9],因此本研究中选择具有特异性强、不受组织类别限制等优势的以聚合酶链式反应(PCR)为基础的PCR凝胶电泳法,以动物种属间遗传信息的差异作为检测靶点,采用缩短检测耗时及避免操作繁琐的梯度PCR对多畜种同时检测。
本研究基于物种特异性PCR技术,建立针对牛、羊、猪、狗、马五个畜种源性肉的检测方法,在研究过程中,针对牛、羊、猪、狗、马线粒体基因筛选特异性引物,优化各畜种检测条件。退火温度是PCR扩增成功的关键因素,为了扩增出清晰目的条带同时避免杂带对试验结果的判定产生影响,利用梯度PCR技术优化得到每对引物的最适退火温度,对牛、羊、猪、狗、马分别设计了从51~67 ℃的共计69组相应的适宜温度及温度梯度,并且通过比对重组质粒测序结果与GenBank中的目的基因序列,确定牛、羊、猪、狗、马的PCR产物序列分别与各自目的序列的同源性差异,以制备各畜种动物源重组质粒,建立常见肉及肉制品快速检测模型,以期为快速鉴别牛、羊、猪、狗、马多畜种畜肉提供依据。
1 材料与方法
1.1 材料与仪器
蛋白酶K、红色荧光核酸染色液(EB1)、琼脂糖、Tris-Base、核酸提取液(氯仿/异戊醇(24∶1))、D2000、50×TAE、Loading Buffer、氨苄青霉素钠、IPIG 北京索莱宝科技有限公司;HCl、乙二胺四乙酸(EDTA)、NaCl、三水合乙酸钠、冰乙酸(分析纯) 天津市北联精细化学品开发有限公司。
TGL-16D冷冻高速离心机 常州中捷实验仪器制造有限公司;TLTERTEK BERTHOLD微量核酸蛋白浓度测定仪 美国Bio-Rad公司;Minisc及SC型水平电泳槽 美国Bio-Rad公司;Analyticjena Biosystems Tone Manual普通PCR仪 美国Bio-Rad公司;Azure Biosystems双激光-近红外分子成像系统 美国Azure Biosystems公司。
1.2 实验方法
1.2.1 DNA的提取 将5种畜肉分别使用液氮研磨仪研磨至肉糜粉末状,4 ℃封口保存。取100 mg畜肉组织样品,加入500 μL SDS裂解液和20 μL蛋白酶K,55 ℃水浴至溶液透明,加入等体积Tris,12000 r/min离心10 min,取上清液,重复此步操作一次,加入0.5倍体积的Tris和0.5倍体积的氯仿/异戊醇(24∶1),12000 r/min离心10 min,取上清液加入0.1倍体积的乙酸钠溶液和2.5倍体积的4 ℃无水乙醇,待白色沉淀析出,-20 ℃沉淀2 h,12000 r/min离心5 min,吸除上清,70%乙醇500 μL洗涤沉淀,12000 r/min离心5 min弃乙醇,室温放置挥发残余乙醇,加入100 μL TE缓冲液溶解DNA沉淀,-20 ℃保存DNA样品。
1.2.2 特异性引物的筛选 根据已报道的现行检测单一畜种方法[12-16]中的引物序列(见表1)进行筛选。DNA提取[10-11]后,采用核酸蛋白浓度测定仪和琼脂糖凝胶电泳评估DNA质量。PCR条件:总体积50 μL,2×Taq Plus Master Mix 25 μL,上下游引物(10 μmol·L-1)各2 μL,DNA模板0.5 μg。PCR条件:94 ℃预变性5 min,94 ℃变性30 s,各引物退火温度不同,遵循种间特异性原则,分别按表1设定温度梯度反应,退火时间均为30 s,72 ℃延伸60 s,循环数分别为30、35、37和40个;72 ℃延伸7 min。取5 μL PCR扩增产物经1%琼脂糖凝胶电泳后,分析凝胶成像结果。

表1 引物序列、扩增片段大小及退火温度范围Table 1 The primer sequence,the size of amplified fragments and the range of specific annealing temperature
1.2.3 重组质粒的构建及PCR产物的序列测定 a.目的片段的扩增、鉴定、回收与纯化:挑选每个畜种中提取两管DNA作为模板,用已筛选得到的各畜种特异性引物在优化得到的最适退火温度下进行PCR扩增,凝胶电泳成像仪鉴定后,将鉴定结果良好的PCR产物分两个点样孔全部点到琼脂糖凝胶上,电泳结束后进行切胶操作,然后用DNA纯化回收试剂盒对琼脂糖凝胶中的DNA进行回收和纯化。b. LB平板制备:待已倒好的LB平板完全凝固后,在其表面加入16 μL 50 mg/mL IPIG和40 μL 20 mg/mL的X-gal,用无菌弯头玻璃棒将其轻轻刮涂均匀,37 ℃下放置2 h以使得溶解X-gal 的二甲基甲酰胺挥发干净。c.冰浴操作载体连接与转化反应:将p GM-T 克隆试剂盒中的组分在冰上完全融化后应先瞬时离心,将挂在壁上的液滴收集到管底。d.阳性克隆筛选:转化子在平板上培养12~16 h后,挑选白色菌斑,此为正确的转化子,将其挑取接种到LB液体培养基中,37 ℃、150 r/min摇床振荡培养过夜。e.菌液保存、送样及质粒提取:将摇床培养过夜后得到的浑浊菌液分成三部分,一部分按照质粒小提试剂盒的说明进行质粒提取;一部分送样,由上海生工生物有限公司进行单向测序,测序所用的引物均为p GM-T载体通用引物;另一部分转到冻存管中加入甘油保护后放置在-80 ℃条件下作为保存菌液。f.重组质粒的鉴定。质粒提取出来后,在微量核酸蛋白浓度测定仪上测定其浓度,同时应进行质粒完整性检测,最终用EB2(Emotion Buffer)将其稀释成10 ng/μL,进行质粒PCR。
1.2.4 序列分析软件 利用软件DNA star对测序结果进行处理,Gen Bank在线软件Blast n比对测序处理结果。
1.2.5 生、熟肉检测灵敏度及稳定性测定 各畜种生肉清理洁净后,水浴煮沸,99 ℃时开始计时30 min(模拟肉的蒸煮过程),沥干水分。DNA提取后,评估DNA质量,系列10倍稀释,采用已筛选的特异性PCR条件进行扩增反应,无菌双蒸水作阴性对照,确定最低DNA浓度检测限,分析该方法灵敏性。
1.2.6 常见肉检测准确性及可行性验证 购买20种常见熟肉制品和复杂加工处理的生肉制品,经冲洗后在蒸馏水中浸泡1 h,提取DNA,评估DNA质量合格后,分别采用国家标准推荐方法与本研究优化的快速高效检测法进行检测,对比本研究与国家标准检测常见肉及肉制品动物源性成分鉴定结果,分析该方法的准确性与可行性。
1.3 常见肉类检测
鉴别方法建立优化后,从宁夏某几个市场随机购买20种常见肉类产品进行实际样品检测,进一步验证该方法的准确度和可行性。熟肉制品和复杂加工处理的生肉制品经冲洗后在蒸馏水中浸泡1 h,去除产品中部分调味料和添加剂。每个样品DNA采用五个检测体系同时进行检测,综合检测结果得出鉴定结论。
2 结果与讨论
2.1 DNA质量评估结果
采用核酸蛋白浓度测定仪和琼脂糖凝胶电泳对DNA质量进行评估,DNA在260、280 nm处的值均在1.8~2.0之间;DNA完整性良好,条带清晰明亮。
2.2 特异性引物筛选结果
特异性引物和退火温度是影响检测结果特异性是否显著的重要参数[17-18],因此退火温度参数的筛选广泛应用于物种鉴定及其群体和个体水平的遗传差异分析中[19-21]。通过对牛、羊、猪、狗、马的特异性引物筛选,对5畜种、9对引物、69组温度变化、4组平行样本(1组空白组、3组对照组)通过梯度PCR-凝胶电泳成像方法进行共计12000余次摸索筛选引物及反应条件试验,分别比对牛(271、79 bp)、羊(133、294、98 bp)、猪(263 bp)、狗(213 bp)、马(127 bp)等引物(图1~图5)退火温度、循环数对鉴定结果的影响,分析摒弃有交叉反应、引物二聚体及无明亮清晰条带等引物特异性差者,确定特异性引物。
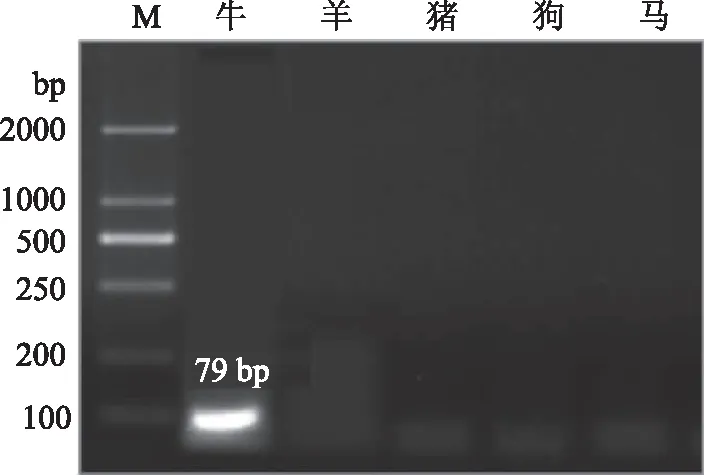
图1 牛引物快速检测凝胶成像图

图2 羊引物快速检测凝胶成像图
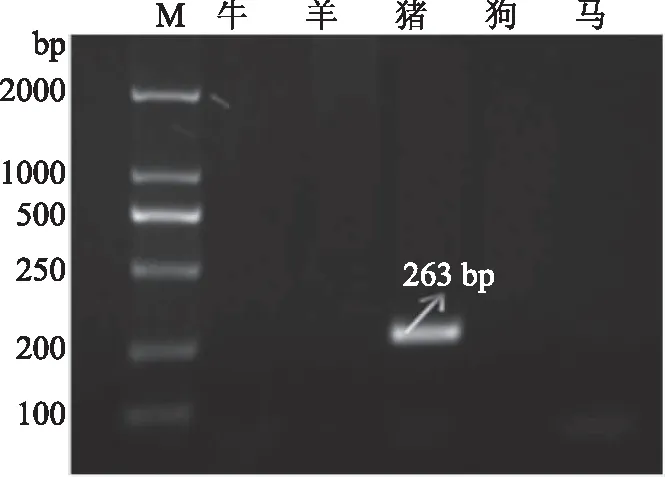
图3 猪引物快速检测凝胶成像图

图4 狗引物快速检测凝胶成像图

图5 马引物快速检测凝胶成像图
在此过程中,检测到牛引物1在退火温度为63 ℃时与马有交叉反应,在63.5 ℃时只有添加马DNA模板的PCR体系能扩增出条带,而当退火温度进一步提高到64、65 ℃时无任何条带扩增出,说明该引物特异性不好,与马有交叉反应,弃用;牛引物2经检测,确定其在54 ℃退火温度下特异性良好。分析得到,当羊引物1退火温度为59、59.5 ℃时,其与其他五个畜种均有交叉反应,当进一步提高退火温度到60、60.5 ℃时只能扩增出马源性DNA,而退火温度高于61 ℃后无任何条带出现,说明该引物特异性差,与马有交叉反应,弃用;羊引物2在53 ℃退火温度下与其他畜种均有交叉反应,当退火温度提高到58 ℃时能扩增出其他五个畜种的DNA,只有羊DNA无法扩增出,该引物不适用于本实验,弃用;羊引物3在低于65 ℃的退火温度下与其他畜种均有交叉反应,而在65 ℃时特异性良好,当进一步提高退火温度到67 ℃时无任何条带出现。在猪引物方面,当退火温度低于62 ℃时与其他畜种均有交叉反应,当退火温度为60.5、61 ℃时,其与马有交叉反应,当退火温度提高到62 ℃时,其具有良好且稳定的特异性。狗引物经反复实验,最终确定其在46 ℃时特异性良好,而退火温度提高到47 ℃时该引物不稳定。马引物1在66 ℃的退火温度下与驴有交叉反应,当退火温度提高到67 ℃时其特异性良好,当退火温度提高到67 ℃以上时无任何条带出现;马引物2在60 ℃的退火温度下与其他畜种均有交叉反应,而当退火温度提高到62 ℃时无任何条带出现,弃用。
此外,本研究中曾选用的牛引物1、羊引物1(见表1)分别为Tartaglia、Herman等设计,其均为国内饲料中牛、羊源性成分检测行业标准所标示出来的引物,但在实验过程中发现,将退火温度升至63 ℃时,此两对引物对马源性成分仍有扩增。但这并不意味着前人的研究有误,而是由于前人在实验中未对引物是否对马源性成分有交叉反应[22]做分析和讨论,本实验的研究结果可作为对前人研究结果的补充。由此可进一步验证,在PCR反应条件摸索确定方面,退火温度降低时会导致非特异性扩增[23],提高退火温度可提高反应的特异性[24],但同时扩增效率也会下降。这与桑付明[25]、黄亚威[26]、Thapana[27]等在研究中的详尽讨论相一致。在序列影响方面,有文献[28-29]提供了根据序列中A、T、G、C四种碱基的数量来估计引物退火温度的公式,但这些公式对其它影响因素进行考量的程度尚有缺乏,计算出的退火温度往往和实际有较大的差距,因此理论值作为重要参考指标同时,依然需要试验进一步摸索条件[30]。本研究在确定某一引物的退火温度时,以引物合成报告为基准,上下5 ℃做梯度PCR,以筛选特异性退火温度。在特异性引物筛选过程中,反应循环数的确定至关重要,一般循环数变化范围在30~40个循环之内,通过实验发现,当循环数为30时,得到的扩增产物量较少,直观表现为PCR产物经电泳后在凝胶成像仪上显示的条带亮度不足,而加大循环数后,非特异性条带增多的同时也延长了扩增时间,故在同时考虑条带亮度和扩增所需时间的基础上,本实验最终确定的最佳循环数为30。
因此,确定如图1~图5显示最终五畜种的特异性引物及退火温度为牛2(54 ℃)、羊3(65 ℃)、猪(62 ℃)、狗(46 ℃)、马2(67 ℃),最佳循环数为30,同时检测5种畜肉凝胶电泳检测时长30 min。表明该方法具有对多种畜肉可同时检测、特异性好、可重复性高、稳定性好的优点。
2.3 PCR产物的重组质粒初测结果及测序结果分析
2.3.1 质粒电泳及质粒PCR结果分析 将特异性扩增产物切胶纯化回收后连接到p GM-T载体上,挑取经连接转化、单克隆摇管培养完成后的浑浊培养基中牛源、羊源、猪源、狗源、马源重组质粒进行初步检测,结果如图6所示。由图6可知,牛、羊、猪、狗、马的质粒PCR电泳,初步表明此5种特异性目的片段已成功转化到Top10中。继而将提取的牛源、羊源、猪源、狗源、马源重组质粒模板进行PCR扩增检测。如图7所示,牛(79 bp)、羊(98 bp)、猪(263 bp)、狗(213 bp)、马(127 bp)的重组质粒样品皆获得与预期大小相符条带,证实牛源、羊源、猪源、狗源、马源性目的片段已成功转化到质粒中,表明该引物为目标特异性引物,可进行下一步重组质粒测序的分析。

图6 质粒PCR电泳结果

图7 重组质粒PCR电泳结果
2.3.2 重组质粒测序结果 如表2所示,将牛、羊、猪、狗、马源性的重组质粒PCR 产物测序结果与靶基因序列分析同源性结果,该结果表明,牛、羊、猪、狗、马源性的PCR产物序列分别与Gen Bank 中的目的基因序列均有100%的同一性,测序结果进一步证明重组质粒转化成功。因此本研究中最终确定的特异性引物确为目标筛选的各畜种Cyt b中存在的牛源、羊源、猪源、狗源、马源的特异性引物。表明本研究确定的方法真实可靠,可用于检测鉴定此5种常见畜肉。

表2 动物源性成分测序结果与Gen bank中序列的比对Table 2 Comparison between the sequencing result and genome of bovine,ovies,pig,dog and horse
2.4 生、熟肉检测灵敏度及稳定性
如图8所示,将牛、羊、猪、狗、马的生、熟肉DNA模板量系列10倍稀释,最低至10-8μg,采用已筛选的特异性PCR条件进行扩增反应,无菌双蒸水作阴性对照,确定各畜种畜肉的DNA浓度检测限。结果表明,羊的生肉和熟肉源的DNA扩增结果相同浓度间无显著差异;牛、猪、狗和马源性生、熟肉的DNA相同浓度间检测结果差异显著,牛肉的生肉检测限为10-7μg,熟肉为10-2μg;羊肉的生、熟肉检测限均为10-2μg;猪肉的生、熟肉检测限分别为10-3、10-2μg;狗肉的生、熟肉检测限分别为10-2、10-1μg;马肉的生、熟肉检测限分别为10-3、10-2μg。说明本研究建立的快速检测方法不仅适用于生肉样品检测,同时还适用于熟肉样品的检测,最低检测限为5×10-7μg,表明该方法灵敏度高。

图8 各畜种DNA(生、熟肉)用于PCR时的灵敏度比较
2.5 常见肉类检测
从宁夏某几个市场随机购买如表3所示的20种常见肉类产品进行实际样品检测,通过分析比对本研究与现行国家标准检测常见肉及肉制品动物源性成分鉴定结果,进一步验证该方法的准确性与可行性。现行标准每次检测1个样品,每个样品检测时长40 min;本研究建立的快速检测方法每次检测5个样品,每5个样品检测时长30 min。从表3中实际样品检测结果可以看出,该快速检测方法与现行标准比较,具有同等检测效力,且该检测方法特异性更强,5个动物源性核酸样品可同时检测,检测通量更大,检测时间极大缩短,可为畜种鉴别及检验检疫工作者提供数据理论参考。

表3 肉类检测结果(20份样品)Table 3 Test results of meat(20 samples)
3 结论
本文通过梯度PCR电泳法成功建立了基于牛、羊、猪、狗、马等动物源性核酸特异性引物的快速检测肉及肉制品基因的快速检测方法。与现行肉及肉制品国家标准及地方标准相比,最低检测限得到进一步精确,其中牛肉的生肉检测限为10-7μg,熟肉为10-2μg;羊肉的生、熟肉检测限均为10-2μg;猪肉的生、熟肉检测限分别为10-3、10-2μg;狗肉的生、熟肉检测限分别为10-2、10-1μg;马肉的生、熟肉检测限分别为10-3、10-2μg。蛋白质及光谱分析检测方法往往不适用于熟肉制品的鉴别,而本研究建立的快速检测方法不仅适用于生肉样品的检测,而且完全可用于熟肉制品的检测。此外,5个动物源性核酸样品的同时检测,平均每组5个样品节省200 min,检测通量更大,极大地缩短了检测时间。综上所述,本研究建立的快速检测试剂盒方法耗时短、通量高,5种畜肉可同时进行检测。本实验为各检验检疫等分析机构进行实际样品检测提供理论依据、方法指导和技术支持,有望在各基层单位推广应用。

