穿心莲内酯对IL-6诱导的非小细胞肺癌细胞侵袭转移的影响及机制
杨金华 刘向前 赵天增
(南阳医学高等专科学校第一附属医院普胸外科,河南 南阳 473000)
穿心莲内酯(AD)是传统中药穿心莲的有效成分之一,被证实可通过抑制核因子(NF)-κB信号通路和基质金属蛋白酶(MMP)-9发挥抗肺癌的作用,是一种有前途的抗肺癌候选药物〔1〕。白细胞介素(IL)-6是一种癌症相关炎症因子,不仅介导肿瘤细胞的微环境,还可通过调控细胞的增殖、侵袭、转移和血管生成等途径促进肿瘤的发生发展〔2,3〕。上皮间质转化(EMT)是使上皮细胞获得运动能力进而引起癌细胞转移的重要生物过程。已有研究〔4~6〕证实,IL-6可通过激活NF-κB信号通路促进EMT发生,增强肺癌细胞侵袭和转移;AD可通过抑制促EMT细胞因子IL-6的表达抑制前列腺癌的进展,但其是否影响IL-6诱导的肺癌侵袭和转移并不清楚。非小细胞肺癌是肺癌最常见的病理类型,约占肺癌的80%,而肺腺癌又占非小细胞肺癌的50%以上〔7〕。本研究旨在探讨AD对IL-6诱导的A549细胞侵袭转移的影响及其机制。
1 材料与方法
1.1材料 AD(纯度≥95%)、二甲基亚砜、噻唑蓝(MTT)试剂购于美国Sigma公司。RPMI1640培养基和胰蛋白酶购于美国Gibco公司,胎牛血清购于杭州四季青公司。IL-6购于美国 BioVision公司。MMP-9抗体、磷酸化NF-κB抑制蛋白(p-IκBα)抗体、IκBα抗体和β-actin抗体购于美国Santa Cruz公司。钙黏蛋白E(E-cadherin)抗体和波形蛋白(Vimentin)抗体购于美国Bioworld公司。辣根过氧化酶标记的山羊抗兔/鼠免疫球蛋白(Ig)G购于美国Cell Signaling Technology公司。二喹啉甲酸(BCA)蛋白定量试剂盒购于北京普利莱基因技术有限公司,ELX800酶标仪购于美国Bio-Tek公司。倒置荧光显微镜购于日本Olympus公司,凝胶成像系统购于美国Bio-Rad公司,Transwell小室购于美国Millipore公司。细胞培养箱购于美国Thermo Scientific Heraeus公司。
1.2细胞来源及其培养 将来自上海生命科学院细胞资源中心的人肺腺癌细胞株A549在温度为37℃、CO2体积分数为5%条件的细胞培养箱中以含有10%胎牛血清的RPMI1640培养基常规培养。
1.3细胞增殖 采用MTT法检测AD对A549细胞增殖的影响。将生长良好的对数生长期的A549细胞以每孔200 μl(浓度106个/ml)平铺于96孔细胞板上。置于细胞培养箱中培养过夜。将其分为9组,分别加入含有0、0.5、1.0、3.0、5.0、10.0、15.0、30.0和50.0 μmol/L浓度AD的培养基120 μl,每组设置6个平行孔。作用24 h后,加入20 μl MTT溶液。反应4 h后,加入100 μl二甲基亚砜使结晶充分溶解。以酶标仪检测各孔细胞在490 nm波长处的吸光度值。根据公式:细胞抑制率(%)=(1-药物组吸光度值/对照组吸光度值)×100%计算各组细胞的抑制率。后期以20 μg/L、50 μg/L和100 μg/L浓度IL-6的作用于A549细胞,MTT法检测IL-6对A549细胞增殖的影响,具体步骤同上。上述实验重复3次。
1.4细胞侵袭实验 将不同浓度AD处理后的A549细胞以0.25%胰蛋白酶消化后,加入无血清的培养基制成浓度为3×105个/ml的细胞悬液。以每孔100 μl加入到matrigel胶包被的Transwell小室的上室中。下室内,加入500 μl含10%胎牛血清的培养基。放入细胞培养箱中培养24 h后,从24孔细胞板中取出小室,以棉签小心擦去小室上表面未穿过的细胞。采用甲醇和苏木精-伊红分别对小室下表面的细胞进行固定和染色。采用显微镜观察统计侵袭细胞数。结果取随机选取的6个视野内细胞数的均值。上述实验重复3次。
1.5Western印迹检测 参照总蛋白提取试剂盒步骤提取待测A549细胞的总蛋白后,采用BCA法对总蛋白的浓度及其纯度进行检测。取蛋白样品50 μg加入到十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳通道孔中行电泳分离。采用湿式法转聚偏氟乙烯(PVDF)膜后,置于含5%脱脂奶粉的TBST溶液中封闭处理2 h。分别加入MMP-9抗体(1∶500)、E-cadherin抗体(1∶500)、Vimentin抗体(1∶800)、p-IκBα抗体(1∶500)、IκBα抗体(1∶500)和内参β-actin抗体(1∶1 000)孵育过夜。次日,经TBST溶液洗膜5 min×3次后,避光条件下滴加化学发光剂显色曝光。采用Gel-Pro 3.1软件进行分析。以目的条带的灰度值/内参条带的灰度值表示目的蛋白的相对表达水平。上述实验重复3次。
1.6统计学分析 采用SPSS22.0软件进行方差分析、SNK-q及t检验。
2 结 果
2.1不同浓度的AD对A549细胞增殖的影响 以不同浓度的AD处理A549细胞24 h后,与0.0 μmol/L的抑制率〔(1.64±1.52)%〕比较,0.5 μmol/L、1.0 μmol/L和3.0 μmol/L AD对A549细胞的增殖无显著影响〔(2.16±1.67)%、(4.16±2.23)%、(8.15±5.48)%,P>0.05〕,而5.0 μmol/L、10.0 μmol/L、15.0 μmol/L、30.0 μmol/L和50.0 μmol/L浓度的AD能够呈浓度依赖性抑制A549细胞增殖〔(18.31±2.11)%、(27.24±3.46)%、(48.92±4.93)%、(65.38±5.76)%、(73.59±7.07)%,F=130.315,P=0.000〕。
2.2不同浓度IL-6对A549细胞增殖的影响 与0 μg/L抑制率〔(2.80±1.54)%〕比较,20 μg/L、50 μg/L和100 μg/L IL-6处理A549细胞24 h后,IL-6对A549细胞增殖无显著影响〔(5.14±2.68)%、(8.31±4.76)%、(6.21±3.80)%,F=1.352,P=0.325〕。后续选用低浓度(20 μg/L)的IL-6进行实验。
2.3AD对IL-6诱导的A549细胞侵袭的影响 给予20 μg/L浓度的IL-6处理后,A549细胞的侵袭能力较对照组明显增强(126.37±11.45 vs 48.35±6.72,P<0.05)。然而,给予0.5 μmol/L、1.0 μmol/L和3.0 μmol/L AD处理后,IL-6对A549细胞侵袭的促进作用明显受到抑制(101.55±8.72、40.62±6.34、36.72±4.94 vs 126.37±11.45,P<0.05),且呈现一定的浓度依赖性。见图1。

图1 Transwell小室检测各组A549细胞的侵袭结果(×200)
2.4AD对IL-6诱导A549细胞EMT的影响 采用Western印迹进一步检测AD对IL-6诱导的EMT的影响。结果发现,IL-6刺激能够明显降低A549细胞中E-cadherin蛋白的表达,而升高Vimentin蛋白的表达;而以0.5 μmol/L、1.0 μmol/L和3.0 μmol/L AD作用后,IL-6对A549细胞上述作用明显减弱,且呈一定的浓度依赖性。见图2和表1。
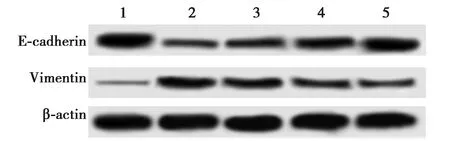
1~5:对照组、IL-6组、0.5 mol/L AD+IL-6组、1.0 mol/L AD+IL-6组、3.0 mol/L AD+IL-6组,下图同图2 Western印迹检测A549细胞中E-cadherin和Vimentin蛋白的表达

组别E-cadherinVimentin对照组2.34±0.160.17±0.03IL-6组 1.00±0.081)1.00±0.061)0.5 μmol/L AD + IL-6组1.27±0.112)0.83±0.052)1.0 μmol/L AD + IL-6组1.59±0.132)3)0.60±0.062)3)3.0 μmol/L AD + IL-6组1.75±0.152)3)0.55±0.052)3)F/P值46.644/0.000104.141/0.000
与对照组相比较:1)P<0.05;与IL-6组比较:2)P<0.05;与0.5 μmol/L AD+ IL-6组相比较:3)P<0.05
2.5AD对IL-6诱导A549细胞NF-κB通路活化的影响 为了探讨AD对IL-6诱导A549细胞侵袭转移的分子机制,采用Western印迹进一步检测A549细胞中NF-κB通路相关蛋白的表达变化。结果发现,IL-6刺激后,A549细胞中p-IκBα蛋白表达升高,而IκBα蛋白表达降低,NF-κB信号通路激活;而0.5 μmol/L、1.0 μmol/L和3.0 μmol/L AD能够呈浓度依赖性明显抑制IL-6对549细胞中NF-κB通路的活化。见图3和表2。

图3 Western印迹检测A549细胞中NF-κB通路相关蛋白的表达

组别p-IκBαIκBα对照组0.13±0.021.55±0.06IL-6组1.00±0.081)1.00±0.091)0.5 μmol/L AD + IL-6组0.83±0.072)1.23±0.072)1.0 μmol/L AD + IL-6组0.62±0.062)3)1.56±0.042)3)3.0 μmol/L AD + IL-6组0.24±0.042)3)4)2.15±0.022)3)4)F/P值123.666/0.000151.508/0.000
与对照组相比较:1)P<0.05;与IL-6组比较:2)P<0.05;与0.5 μmol/L AD+ IL-6组比较:3)P<0.05;与1.0 μmol/L AD+ IL-6组比较:4)P<0.05
2.6AD对IL-6诱导的A549细胞转移相关蛋白MMP-9的影响 给予IL-6处理后,A549细胞中MMP-9蛋白的表达水平较对照组明显升高(1.03±0.11 vs 0.68±0.08,P<0.05);而给予0.5、1.0和3.0 μmol/L AD作用后,IL-6对MMP-9蛋白表达的促进作用明显减弱(0.73±0.08、0.55±0.05、0.47±0.04 vs 1.03±0.11,P<0.05),且呈一定的浓度依赖性。见图4。

图4 Western印迹检测MMP-9蛋白表达
3 讨 论
IL-6可协调辅助性T细胞(Th)17型细胞因子、TNF-α激活细胞信号转导与转录激活因子(STAT)3和NF-κB促进结直肠癌细胞的生长〔8〕。骨髓中高表达的IL-6可通过MMP-9促进胰腺癌的侵袭性生长和转移〔9〕;IL-6可激活酪氨酸激酶(JAK)2/STAT3信号通路促进胃癌EMT和癌细胞转移,抑制其表达可改善肿瘤腹膜转移〔10〕。IL-6与肺癌的发生发展关系密切,在癌细胞的侵袭转移过程中发挥着重要作用〔11〕。IL-6在非小细胞肺癌组织中高表达,与腺癌组织类型相关〔12〕。本研究结果与姜伊娜〔4〕研究发现的IL-6可通过激活毛细血管扩张共济失调突变基因(ATM)-NF-κB通路促进EMT的发生,增强肺癌细胞迁移的分子机制部分吻合。NF-κB信号通路是一条公认的炎症信号通路,也是细胞内重要的核转录因子,IκBα是NF-κB的抑制蛋白;一般情况下以无活性的三聚体复合物p65/p50/IκBα形式存在,但当细胞受到炎症因子等刺激时,IκBα磷酸化降解释放p65/p50二聚体进入细胞核,激活下游相关基因,进而参与调控细胞增殖、侵袭、炎症反应和免疫应答等过程〔13,14〕。细胞外基质的降解是肿瘤细胞发生转移的重要病理过程,而MMPs蛋白家族在该过程中发挥着重要作用;MMP9是MMPs家族成员,也是NF-κB信号通路下游相关基因,在肺癌的侵袭转移密切相关〔15,16〕。可见,IL-6刺激可通过激活NF-κB信号通路增强了A549细胞的侵袭转移能力。
AD是从穿心莲中提取的一种二萜内酯类化合物,具有抗炎、抗肿瘤和抗心血管疾病等药理活性〔17,18〕;而近年来随着中药抗肿瘤研究的热潮,AD抗肿瘤的作用备受关注。研究〔19,20〕发现,AD不仅可通过Toll样受体(TLR)4/NF-κB/MMP-9信号通路抑制人结肠癌SW620细胞增殖;还可通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳类动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路抑制卵巢癌SKOV-3细胞的活力与侵袭能力,并增强细胞的凋亡能力。AD可通过抑制肿瘤细胞活性、癌细胞侵袭转移、生长因子信号传导和诱导细胞凋亡等机制发挥抗肿瘤作用,是一种潜力巨大的新型抗肿瘤药物。近年来有研究〔6〕指出,AD可通过抑制促EMT的细胞因子IL-6的表达抑制前列腺癌进展,但其是否通过这一机制改善非小细胞肺癌的侵袭转移过程尚未可知。本研究提示,AD可通过抑制NF-κB信号通路的活化抑制IL-6诱导的非小细胞肺癌细胞的侵袭转移。

