338例胃癌患者营养风险筛查及营养治疗的效果
姚代琴 黄珣 黄小明
摘 要:目的:采用营养风险筛查 2002(NRS 2002)评估338例胃癌患者营养风险并探讨营养治疗对胃癌患者的效果。方法:于2015年1月—2017年6月选取宜宾市第一人民医院住院治疗的胃癌患者338例,采用NRS 2002评估其营养风险,并将存在营养风险的202例患者随机分为治疗组(107例)和對照组(95例),分别给予个性化精准营养支持和家属自备饮食,观察并比较其一般住院指标、营养状况指标和远期生存质量等。结果:338例胃癌患者有202例存在营养风险,发生率59.8%;治疗组住院时间、住院费用、并发症发生率和1年再入院率均低于对照组(P<0.05);治疗组治疗后营养相关指标(体重、白蛋白、前白蛋白和血红蛋白)优于治疗前(P<0.05),治疗组营养相关指标治疗前后差值优于对照组(P<0.05);癌症患者生活质量评价量表QLQ-C30(躯体、情绪、恶心呕吐和食欲下降)和QLQ-STO22(疼痛、反流、饮食受限、焦虑和味觉改变)评分治疗组高于对照组(P<0.05)。结论:胃癌患者营养风险发生率高,个体化精准营养支持不仅能缩短住院时间、降低术后并发症、改善患者营养状况甚至提高患者远期生存质量,针对胃癌患者制定个体化营养支持方案,有利于提高疾病预后和患者远期生存质量。
关键词:胃癌;营养风险;营养治疗;效果
胃癌是一种高度侵袭性癌症,在全球癌症死亡排序中位居前列,最新数据显示,中国男女胃癌发病率分别约41.08~42.93/10万和18.36~19.03/10万,男性远高于女性,城市低于农村,胃癌死亡率高达21.48~22.04/10万[1-2]。消化系统恶性肿瘤发生营养不良风险高[3],严重影响肿瘤患者预后和生存质量,积极有效的营养治疗会显著改善肿瘤患者的临床结局和并发症发生率[4]。及时评估患者营养状况并积极采取营养支持,是提高治疗效果、减少并发症的重要保证。本研究对宜宾市第一人民医院住院治疗的338例胃癌患者进行营养风险评估,积极采取营养支持,并观察营养支持的效果。
1 对象与方法
1.1 研究对象
选取2015年1月—2017年6月于宜宾市第一人民医院肿瘤科住院进行手术治疗的胃癌患者338例,其中男277例、女61例,年龄33~81岁,平均年龄55.2±9.4岁,NRS 2002评分≥3分者202例,将存在营养风险的202例患者按住院号单双号随机分为治疗组(107例,其中男88例、女19例)和对照组(95例,其中男79例、女16例),两组患者年龄、性别、病程、TNM分期差异均无统计学意义(P>0.05),具有可比性。本研究经宜宾市第一人民医院医学伦理委员会批准。
1.2 纳入标准与排除标准
纳入标准:(1)参考《胃癌诊疗规范(2011年版)》[5]进行诊断确诊,即结合临床表现、影像、内镜和组织病理学检查联合诊断;(2)需进行手术胃全切或大部切除者;(3)认知和理解能力正常;(4)经患者和家属知情同意。排除标准:(1)病情危重不允许参与者;(2)认知、读写和理解能力有问题者;(3)患者或家属不同意参与者;(4)非手术治疗者。
1.3 调查工具
1.3.1 营养风险筛查表2002[6](NRS 2002)NRS 2002量表含3部分,疾病严重程度0~3分、营养状况0~3分、年龄评分0~1分,最高分7分。以≥3分定义为存在营养风险,需要进行营养支持。
1.3.2 癌症患者生活质量问卷(QLQ) 包括2个问卷:(1)针对所有癌症患者的QLQ-C30[7]。包括功能(5项)、症状(3项)和单项(6项)和总体健康水平(1项)4个维度共30个条目,采用Likert分级评分赋值,得分越高说明生活质量越差。(2)针对胃癌患者的QLQ-STO22量表[8](QLQ-STO22)。包括9个分量表共22个条目(吞咽困难、胃部疼痛 、呃逆、饮食受限、焦虑 、口干 、味觉 、身体外观、掉头发),每条内容采用Likert-4级评分法分别赋值,通过专项公式计算出各因子得分和总平均分,得分越高说明生活质量越差。以上2个量表于出院3个月后进行评价。
1.4 营养干预
两组在住院期间均由医护人员进行常规营养教育。对照组嘱家属自备流质膳食,进食原则和分量自行把握;治疗组则由营养医师根据患者实际情况计算需求量,选择合理的营养支持手段(积极选择肠内营养(EN)或采用肠内营养联合肠外营养(EN+PN),EN制剂包括自制流食和口服营养补充剂(ONS),适当辅以组件制剂,术前严重营养不良者先纠正营养不良,围手术期营养参照加速康复外科营养管理原则。
1.5 观察指标
观察指标包括一般住院指标、营养相关指标、远期生存质量评价等。
1.6 统计学处理
所有数据采用SPSS 19.0录入并处理,计量资料用±s描述,组间比较用t检验;计数资料用频数或率描述,组间比较用χ2检验,检验水准α=0.05。
2 结果与分析
2.1 患者NRS 2002评分情况
共检出NRS 2002≥3分者202例,营养风险发生率为59.8%,其中男性发生率为60.3%,女性发生率为57.4%,男女差异无统计学意义(P>0.05)。
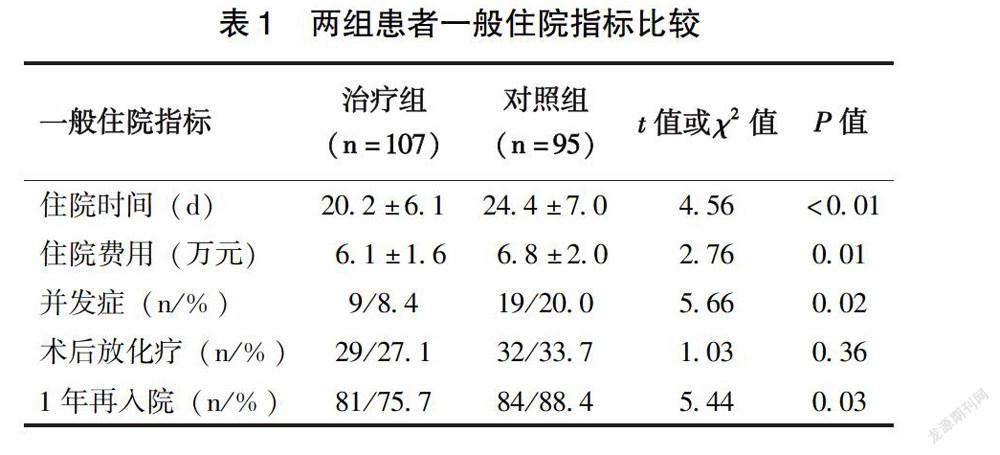
2.2 两组患者一般住院指标比较
除术后放化疗率两组差异无统计学意义(P>0.05)外,住院时间、住院费用、并发症发生率和1年再入院率治疗组均低于对照组(P<0.05)(表1)。
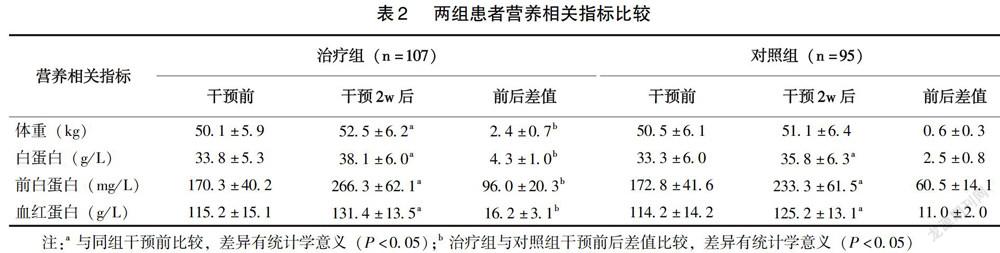
2.3 两组患者营养相关指标比较
治疗组干预2w后,体重、白蛋白、前白蛋白和血红蛋白均高于干预前,对照组除体重外,其余指标干预2w后也高于干预前(P<0.05);干预前后差值比较,治疗组各项指标均优于对照组(P<0.05)(表2)。
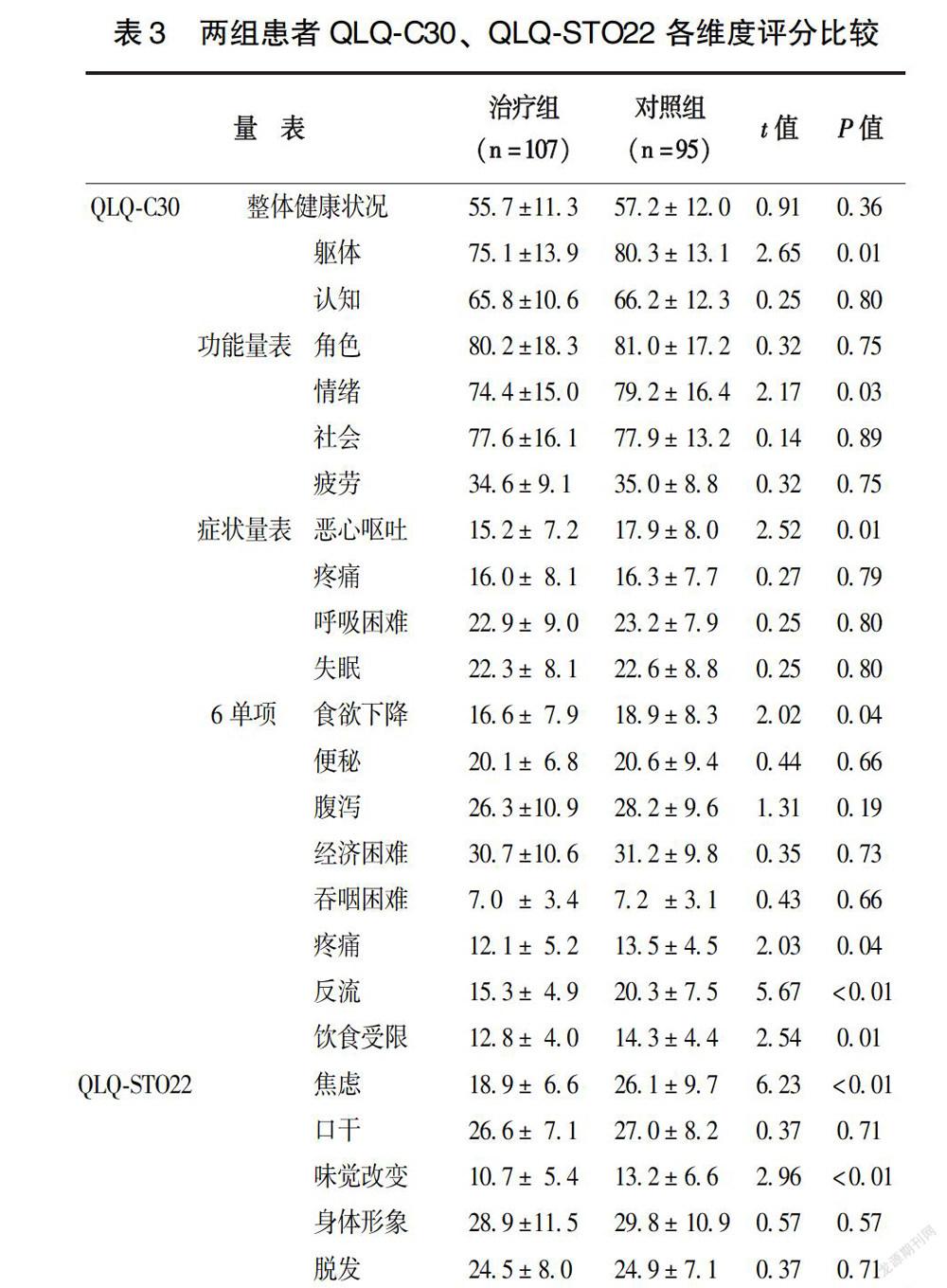
2.4 两组患者远期生存质量比较
QLQ-C30功能量表中躯体功能和情绪功能评分治疗组低于对照组(P<0.05),症状量表中恶心呕吐评分治疗组低于对照组(P<0.05),6个单项问题评分中“食欲下降”项治疗组低于对照组(P<0.05);而QLQ-STO22量表中疼痛、反流、饮食受限、焦虑和味觉改变5项治疗组均低于对照组(P<0.05)(表3)。
3 讨论
胃癌是最重要和常见的消化道肿瘤之一,发病率较高[9]。研究表明,全球2/3以上胃癌发生和死亡病例都发生在欠发达地区。近年来,尽管我国胃癌病死率在不断下降,但整体发病率还处于较高水平[10],胃癌仍是居民重要的死亡原因之一[11]。肿瘤的高代谢、高应激常导致不同程度的营养不良,有报道癌症患者营养风险高达39%~44%[12],患者的营养状况直接影响治疗效果、术中术后并发症发生率及远期结局,早期营养干预能显著提高治疗耐受性和患者生存率[13]。但国内肿瘤营养治疗仍是短板,尤其是精准营养治疗,需要精确了解患者对能量和营养素的需求量,再合理选择营养支持方式,最终达到精准营养治疗的目的。
本研究发现,有59.8%的胃癌患者存在营养风险,与王昌平等[14]报道接近,精准营养支持对患者病死率和住院天数都有明显影响,尤其明显缩短住院时间[15]。對于营养支持方式的选择、营养素的数量及构成、营养制剂的选择等方面还应当根据患者的实际情况制定个性化的营养支持方案。对能自主进食者通过增加能量、蛋白质和改善食物形状和口感等方式增加能量和营养素摄入,不能自主进食者及时建立营养通道(鼻胃管、胃造瘘等)完成营养素的补充,必要时可选用特殊医疗配方食品(FSMP)。术后早期通常采用胃管用FSMP进行营养支持,辅以特殊组件制剂(如精氨酸[16]、谷氨酰胺等)配合EN支持,必要时辅以PN。2017年出版的《肿瘤患者营养支持指南》为肿瘤患者合理营养支持提供了专业化的指导意见[17]。本研究根据患者实际情况计算营养素需要量,采用EN或EN+PN的营养支持方式,发现精准营养治疗显著缩短患者住院时间、降低并发症发生率和1年再入院率,提示积极的营养治疗显著减少患者术后并发症。术后营养支持2w后,治疗组和对照组营养相关指标均有明显提高,治疗组提高的程度高于对照组,说明精准营养治疗对改善患者营养状况有良好的效果。
肿瘤术后可能出现疼痛、吞咽困难和饮食受限等问题,对患者生理和心理均产生较大影响[18-20],积极营养支持可能改善胃癌患者预后,对患者的生理和心理方面均有积极意义。本研究发现,治疗组QLQ-C30(躯体、情绪、恶心呕吐和食欲下降)和QLQ-STO22(疼痛、反流、饮食受限、焦虑和味觉改变)某些维度评分高于对照组,说明个体化精准营养治疗后对患者远期生存质量也有积极影响。
综上,胃癌患者营养风险发生率高,根据营养风险筛查结果采用个体化精准营养治疗有利于改善患者营养状况、降低术后并发症、缩短住院时间甚至提高患者远期生存质量,有必要对胃癌患者术前、术后进行营养风险筛查,制定个体化营养治疗方案,改善患者营养状况,提高预后和生存质量。
参考文献
[1]Nie YZ,Wu KC,Yu J,et al.A global burden of gastric cancer:the major impact of China[J].Expert Rev Gastroent,2017,11(7):651-661.
[2]左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J].中国肿瘤临床,2017,44(1):52-58.
[3]Fukuda Y,Yamamoto K,Hirao M,et al.Prevalence of malnutrition among gastric cancer patients undergoing gastrectomy and optimal preoperative nutritional support for preventing surgical site infections[J].Ann Surg Oncolo,2015,3(Suppl 3):S778-785.
[4]Choi WJ,Kim J.Nutritional care of gastric cancer patients with clinical outcomes and complications:a review[J].Clin Nutr Res,2016,5(2):65-78.
[5]中华人民共和国卫生部医政司.胃癌诊疗规范(2011年版)[J].中国医学前沿杂志(电子版),2012,4(5):62-71.
[6]van Bokhorst-de van der Schueren MA,Guaitoli PR,Jansma EP,et al.Nutrition screening tools:does one size fit all? A systematic review of screening tools for the hospital setting[J].Clin Nutr,2014,33(1):39-58.
[7]Kim SG,Ji SM,Lee NR,et al.Quality of life after endoscopic submucosal dissection for early gastric cancer:a prospective multicenter cohort study[J].Gut Liver,2017,11(1):87-92.
[8]Woo A,Fu T,Popovic M,et al.Comparison of the EORTC STO-22 and the FACT-Ga quality of life questionnaires for patients with gastric cancer[J].Ann Palliat Med,2016,5(1):13-21.
[9]Shah S,Fox EU,Wee Khoon Ng,et al.The global incidence of gastric cancer in the 21st century:a systematic review of population-based studies from 2007—2017[J].Gastroenterology,2018,154(6 suppl 1):S986.
[10]Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
[11]Sitarz R,Skierucha M,Mielko J,et al.Gastric cancer:epidemiology,prevention,classification,and treatment[J].Cancer Manag Res,2018(10):239-248.
[12]Emmanuel G,Bruno R,Jean-Philippe D,et al.Malnutrition in patients with cancer:comparison of perceptions by patients,relatives,and physicians-results of the nutri cancer 2012 study[J].JPEN,2018,42(1):255-260.
[13]Ravasco P,Monteiro-Grillo I,Camilo M.Individualized nutrition intervention is of major benefit to colorectal cancer patients:long-term follow-up of a randomized controlled trial of nutritional therapy[J].Am J Clin Nutr,2012,96(6):1346-1353.
[14]王昌平,陳德,黄小明.恶性肿瘤患者营养不良发生率调查及诊断指标探讨[J].安徽医药,2016,20(12):2273-2277.
[15]Joon LV,Jahit MS.The role of nutrition therapy team in the management of malnourished gastric cancer patients undergoing gastrectomy[J].Clin Nutr,2016,35(suppl 1):S257-S257.
[16]Huebner J,Muecke R.Arginine-supplemented enteral nutrition[J].J Cancer Res Clin Oncol,2014,140(4):681-683.
[17]中华医学会肠外肠内营养学分会.肿瘤患者营养支持指南[J].中华外科杂志,2017,55(11):801-829.
[18]Yu W,Park KB,Chung HY,et al.Chronological changes of quality of life in long-term survivors after gastrectomy for gastric cancer[J].Cancer Res Treat,2016,48(3):1030-1036.
[19]林丽,谢飞,彭峰,等. 318例胃癌患者营养状况和幽门螺杆菌感染情况调查[J].中国食物与营养,2018,24(3):86-88.
[20]林丽,张吉才,谢飞,等. 患者全面主观营养评定和营养风险筛查2002在消化系统肿瘤患者营养评估中的应用比较[J].中国食物与营养,2018,24(3):78-81.

