p38MAPK抑制剂联合辅酶Q10对氧化应激条件下大鼠心肌细胞的保护作用
张思洁,吴亚琼,李星涛
河北医科大学第四医院心内科石家庄050000
心血管系统疾病是一种严重影响人类生活质量的常见疾病,心肌梗死、心力衰竭等常伴随心肌组织氧化损伤,而氧化应激是目前为止人们发现的心肌损伤发生的起始因素[1]。辅酶Q10常用于治疗高血压、心力衰竭、心绞痛等心血管系统疾病,具有清除自由基、维持细胞稳定、抑制心肌细胞凋亡等作用[2-3]。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)是 MAPK信号通路中最为重要的分支之一,其对于细胞凋亡、炎症反应、氧化应激等均具有重要的调控作用[4]。很多研究[5-8]表明,p38MAPK在糖尿病心肌病、心肌缺血再灌注、药物诱导的心肌毒性、心力衰竭等多种心肌损伤中过度激活,并且参与心肌细胞氧化损伤过程。本研究观察了辅酶Q10和p38MAPK抑制剂单用以及二者联用对大鼠心肌细胞氧化应激损伤的作用,并初步探讨其可能机制。
1 材料与方法
1.1 材料 大鼠H9c2心肌细胞购自百恩维生物科技有限公司,p38MAPK抑制剂SB203580购自美国ApexBio科技公司,辅酶Q10购自西南药业股份有限公司,丙二醛(MDA)含量检测试剂盒购自上海笃玛生物科技有限公司,p38MAPK抗体购自北京博奥森生物技术有限公司,磷酸化 p38MAPK(pp38MAPK)抗体购自美国CST公司,C-caspase-3抗体购自美国CST公司,超氧化物歧化酶(SOD)活性检测试剂盒、乳酸脱氢酶(LDH)含量检测试剂盒购自美国Abnova公司,过氧化氢酶(CAT)活性检测试剂盒购自美国Cell Biolabs公司。
1.2 实验分组 H9c2细胞分为5组,对照组常规培养,模型组给予100μmol/L过氧化氢处理以建立氧化应激模型,辅酶Q10组给予100μmol/L过氧化氢、0.3 g/L辅酶 Q10处理,SB203580组给予100 μmol/L过氧化氢、10μmol/L SB203580处理,辅酶Q10+SB203580组给予100μmol/L过氧化氢、0.3 g/L辅酶Q10、10μmol/L SB203580处理。培养条件:体积分数5%CO2、37℃,体积分数10%胎牛血清的DMEM细胞培养液中培养。
1.3 各组细胞p38MAPK磷酸化水平检测 采用Western blot法。H9c2细胞按1.2分组处理24 h后,提取蛋白并用BCA法定量,之后电泳、转膜,加入50 g/L牛血清白蛋白溶液,室温封闭2 h,再将膜放在抗体反应液中孵育结合,p38MAPK、p-p38MAPK一抗按1∶800稀释,二抗按1∶4 000稀释。用增强型化学发光试剂盒发光以后,室温孵育5 min。扫描图像,以目的条带和内参GAPDH条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.4 各组细胞LDH漏出率检测 H9c2细胞按1.2分组处理24 h后,分别收集培养液上清及细胞,采用二硝基苯肼显色法,按照LDH含量检测试剂盒步骤测定LDH含量。总LDH含量=上清中LDH含量+细胞中LDH含量,LDH漏出率=(上清中LDH含量/总LDH含量)×100%。实验重复3次。
1.5 各组细胞存活率检测 H9c2细胞接种于96孔板,接种密度为1×104个/孔,分别按1.2分组处理24 h后,每孔添加5 g/L的MTT溶液20μL,37℃孵育4 h后,添加二甲基亚砜,待结晶溶解以后,以酶标仪测定560 nm波长处的吸光度(A)值,用不含细胞的孔调零。存活率=(处理组A值/对照组A值)×100%。实验重复3次。
1.6 各组细胞凋亡检测 H9c2细胞按1.2分组处理24 h后,添加2.5 g/L胰蛋白酶消化,收集细胞,与300μL缓冲液混合,添加Annexin V-FITC和PI工作液各5μL,用流式细胞仪检测前再添加200μL结合缓冲液。计算细胞凋亡率。实验重复3次。
1.7 各组细胞中C-caspase-3蛋白表达水平检测H9c2细胞按1.2分组处理24 h后,以Western blot法检测细胞中C-caspase-3蛋白表达,C-caspase-3抗体按1∶600稀释,余步骤同1.3。实验重复3次。
1.8 各组细胞中SOD、CAT活性及MDA含量检测 H9c2细胞按1.2分组处理24 h后,收集细胞,采用硫代巴比妥酸法检测细胞中MDA含量,用黄嘌呤氧化法检测细胞中SOD活性,用钼酸铵法检测细胞中CAT活性,均按试剂盒说明操作。实验重复3次。
1.9 统计学处理 采用SPSS 21.0处理数据。应用单因素方差分析比较各组细胞上述指标的差异,组间比较用SNK-q检验,检验水准α=0.05。
2 结果
2.1 各组细胞中p38MAPK磷酸化水平检测结果结果见图1、表1。由图1、表1可知,过氧化氢能够提高心肌细胞中p38MAPK磷酸化水平,而辅酶Q10和SB203580均能降低过氧化氢诱导的p38MAPK磷酸化水平升高,二者联用,p38MAPK磷酸化水平进一步降低。

图1 各组细胞中p-p38M APK和p38M APK的表达

表1 各组细胞中p-p38MAPK和p38MAPK水平比较(n=3)
2.2 各组细胞LDH漏出率和存活率检测结果结果见表2。由表2可知,过氧化氢能够提高心肌细胞LDH漏出率,降低心肌细胞存活率;辅酶Q10和SB203580能够抑制过氧化氢诱导的心肌细胞LDH漏出率升高和细胞存活率降低,二者联用作用更强。
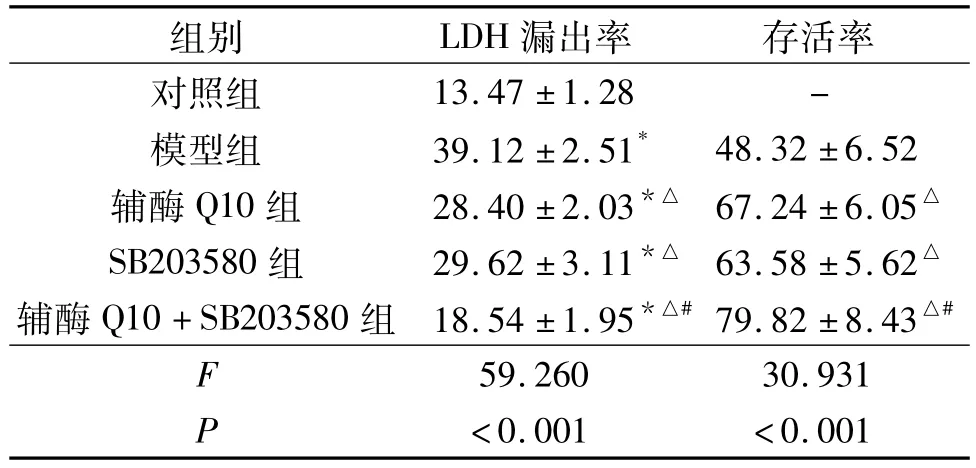
表2 各组细胞LDH漏出率和存活率比较(n=3) %
2.3 各组细胞凋亡率和C-caspase-3蛋白表达水平检测结果 结果见图2和表3。由图2、表3可知,过氧化氢能够提高心肌细胞凋亡率和C-caspase-3蛋白水平;辅酶Q10和SB203580能够抑制过氧化氢诱导的心肌细胞凋亡和C-caspase-3蛋白表达,二者联用作用更强。

图2 各组细胞C-caspase-3蛋白的表达
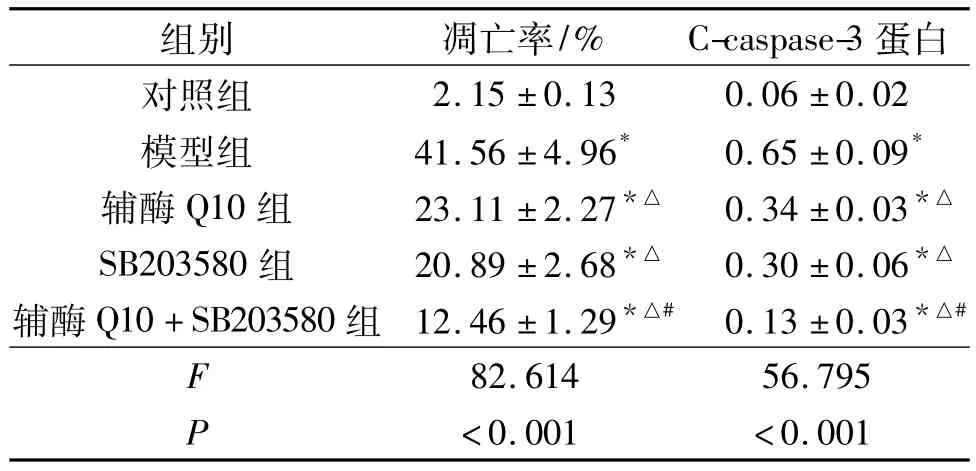
表3 各组细胞凋亡率和C-caspase-3蛋白表达水平比较(n=3)
2.4 各组细胞中SOD、CAT活性及MDA含量检测结果 结果见表4。由表4可知,过氧化氢能够提高心肌细胞中MDA水平,降低细胞中SOD、CAT活性;辅酶Q10和SB203580能够抑制过氧化氢诱导的心肌细胞SOD、CAT活性降低和MDA含量升高,并且二者联用作用更强。

表4 各组细胞中SOD、CAT活性及MDA含量比较(n=3)
3 讨论
辅酶Q又名泛醌,是一种存在于细胞膜中的化合物,不同来源的辅酶Q的侧链上异戊烯单位数量不同,人类辅酶Q异戊烯单位数量为10,因此又称为辅酶Q10[9]。辅酶Q10具有抑制细胞凋亡、抗氧化、增强免疫、保护神经系统等多种作用,目前发现辅酶Q10对于帕金森综合征、糖尿病、心肌病、肿瘤等具有治疗作用[10-13]。有关心肌缺血再灌注损伤的研究[14]显示,辅酶Q10能够抑制心肌细胞中氧自由基的产生并促进其降解,在心室功能和结构维持中具有保护作用。针对体外缺氧复氧致心肌细胞损伤的研究[15]表明,辅酶Q10能够抑制心肌细胞凋亡,提高心肌细胞活性。本研究结果显示,辅酶Q10可以提高氧化应激条件下心肌细胞的活性,并减少细胞LDH漏出率,提示辅酶Q10对于过氧化氢诱导的心肌细胞损伤具有保护作用。
p38MAPK作为一种重要的信号转导通路在人体组织中广泛表达,参与肿瘤、心血管系统疾病、神经损伤等的发生[16-18]。近年来的研究[5-8]表明,心肌缺血再灌注损伤、糖尿病心肌病、药物诱导的心肌病等的发生均与p38MAPK活化有关,p38MAPK信号在受到外界因素刺激以后能够诱导心肌细胞凋亡,降低心肌细胞活性,造成心肌细胞损伤。本研究结果显示,p38MAPK抑制剂可以提高氧化应激条件下心肌细胞活性,减少细胞凋亡,具有抗心肌细胞氧化应激的作用。另外,过氧化氢处理后的心肌细胞p38MAPK信号通路被激活,而辅酶Q10能够降低p38MAPK蛋白的磷酸化水平,提示辅酶Q10减轻过氧化氢诱导的心肌细胞损伤的机制可能与p38MAPK信号通路有关。
细胞中过量的氧自由基可以诱导细胞凋亡。细胞内氧自由基的积累与细胞中抗氧化酶活性降低有关,SOD、CAT是细胞内重要的抗氧化酶,其活性降低可以直接导致细胞中氧自由基清除受阻;细胞内过量的氧自由基可以诱导细胞中正常的脂质发生过氧化,生成大量的MDA[19]。另外,氧自由基可以诱导细胞中 Caspase活化,导致细胞凋亡发生,Caspase-3是细胞凋亡的执行因子,其活化水平升高是细胞凋亡发生的标志[20]。本研究显示,p38MAPK抑制剂和辅酶Q10单独使用均可以提高心肌细胞中SOD、CAT活性,减少MDA产生,减少细胞中活化的Caspase-3蛋白的表达,降低细胞凋亡率,并且p38MAPK抑制剂和辅酶Q10联合使用效果更优。
总之,p38MAPK抑制剂联合辅酶Q10可抑制氧化应激诱导的心肌细胞损伤,p38MAPK抑制剂可能是提高辅酶Q10治疗心肌损伤的潜在途径。

