超高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定蔬菜中的百草枯
韩 梅,侯 雪,邱世婷,焦 颖,罗晓梅,先正其,王 天
(1.四川省农业科学院 分析测试中心,农业部农产品质量安全风险评估实验室(成都),四川 成都 610066;2.赛默飞世尔科技(中国)有限公司,上海 201206)
百草枯又名对草快,是杂环类除草剂,属于吡啶类衍生物,极易溶于水,微溶于醇类及丙酮,不溶于烃类,在酸性及中性溶液中稳定,在碱性溶液中易分解[1]。其对人、畜有较强的急性毒性,且无特效解毒药。作为速效灭生性除草剂,百草枯曾广泛应用于农业生产,但目前已被20多个国家禁用或限用。我国自2016年7月1日起停止在国内销售和使用百草枯水剂,2020年9月26日起禁止在境内销售和使用百草枯可溶胶剂[2]。国家标准GB 2763-2016对蔬菜、水果、谷物、油料中的百草枯作出了限量要求,规定各类蔬菜中百草枯允许的最大残留限量为0.05 mg/kg[3]。由于百草枯的高毒性和广泛应用性,因此建立快速、高选择性、高灵敏度的百草枯检测方法非常必要。
目前有关百草枯的前处理主要采用固相萃取柱净化[4],方法较为复杂;检测方法主要有气相色谱-质谱法[5-6]、高效液相色谱法[4,7-9]和高效液相色谱-串联质谱法[10-13],但上述方法对复杂基质的抗干扰能力不足,易出现假阳性;而静电场轨道离子阱(Orbitrap)可在很大程度上弥补上述不足。高分辨质谱具有较强的抗干扰能力和高通量,且前处理简单,能解决基质干扰问题。其中,四极杆/静电场轨道阱高分辨质谱(Q-Exactive)是将四极杆与Orbitrap相结合,不仅具有很好的定性效果,且显著改善了高分辨质谱的定量效果,可与三重四极杆质谱相媲美[14-15]。目前将Orbitrap高分辨质谱技术应用于蔬菜中百草枯的检测尚未见报道。
本研究建立了蔬菜中百草枯残留的超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UHPLC-Q-Exactive MS)分析方法,样品以乙腈-0.2%甲酸水溶液(1∶1,体积比,下同)提取,分散固相萃取(DSPE)法净化。该方法前处理简单快速、灵敏度高,适用于蔬菜样品中百草枯的快速检测。
1 实验部分
1.1 仪器与试剂
Q-Exactive 四极杆/静电场轨道阱高分辨质谱仪(配加热电喷雾离子(HESI)源)、Thermo UltiMate 3000 高效液相色谱仪,配置六通道在线脱气机、自动进样器(带大体积进样组件)、柱温箱(带2位六通阀)、双三元梯度泵(美国Thermo Fisher公司);WH-3微型涡旋混合仪(上海沪西分析仪器厂);TGL-16LM高速离心机(湖南星科科学仪器有限公司);AE240电子天平(瑞士Mettler公司)。
标准品:百草枯二氯盐标样(纯度大于99.0%,DR.Ehrenstorfer公司)。
乙腈、甲酸、甲酸铵、乙酸铵(色谱纯,美国Fisher Scientific公司);盐酸(优级纯,四川西陇化工有限公司);十八烷基键合硅胶(C18)吸附剂、N-丙基乙二胺(PSA)和石墨化碳黑(GCB)(上海安谱实验科技股份有限公司);实验用水为纯净水(由Milli-Q超纯水仪制备)。蔬菜样品来自四川省农贸市场及蔬菜基地抽检样。
1.2 标准溶液的配制
称取适量百草枯标准品,用0.1 mol/L盐酸配制成20 mg/L标准储备溶液,于-4 ℃保存。根据需要,用试剂或基质溶液配制标准储备溶液,得到不同质量浓度的标准工作溶液。
1.3 样品前处理
准确称取5 g(精确至0.01 g)蔬菜样品于50 mL塑料离心管中,加入10 mL乙腈-0.2%甲酸水溶液(1∶1),涡旋提取1 min后,以4 000 r/min离心5 min,取上层提取液至25 mL容量瓶中,残留物用10 mL乙腈-0.2%甲酸水溶液(1∶1)重复提取1次,合并提取液于同一容量瓶中,用水定容至刻度,摇匀。取6 mL提取液于预先加有300 mg PSA 和300 mg C18的10 mL塑料离心管中,涡旋1 min后,再以4 000 r/min离心力离心5 min。取上清液过0.22 μm滤膜后,待测。
1.4 仪器条件
1.4.1 色谱条件色谱柱:Acquity UPLC BEH HILIC柱(100 mm× 2.1 mm,1.7 μm,美国Waters公司);流动相:A为0.2%甲酸水溶液(含50 mmol/L甲酸铵),B为乙腈;流速:0.3 mL/min;进样量:10 μL,柱温:40 ℃。梯度洗脱程序:0~1.0 min,70%B;1.0~2.0 min,70%~20%B;2.0~4.0 min,20%B;4.0~4.1 min,20%~70%B;4.1~10.0 min,70%B;分析时间:10.0 min。
1.4.2 质谱条件离子源:电喷雾离子源(ESI源);喷雾电压:3 kV;采集方式:正离子采集模式;检测方式:平行反应监测(PRM),分辨率:17 500,碰撞能量:21 eV;鞘气压力:3.5 MPa,辅助气压力:1 MPa;离子传输温度:350 ℃;辅助加热温度:400 ℃。
2 结果与讨论
2.1 提取溶剂的选择
百草枯为碱性离子型化合物,易溶于酸性水溶液,不易溶于乙腈等有机试剂,但纯水溶液以及酸性水溶液对蔬菜中百草枯的提取效率并不高,而通过加入一定比例的乙腈可以显著提高回收率[16]。本研究分别选取水、0.2%甲酸水溶液、2%甲酸水溶液、乙腈、乙腈-0.2%甲酸水溶液(1∶1)以及乙腈-2%甲酸水溶液(1∶1)作为提取溶剂,结果显示,乙腈-0.2%甲酸水溶液(1∶1)和乙腈-2%甲酸水溶液(1∶1)为提取溶剂时百草枯的回收率均超过90%。考虑到酸度过大对仪器、色谱柱性能有影响,因此选择乙腈-0.2%甲酸水溶液(1∶1)为提取溶剂。进一步比较了不同体积比(1∶9、3∶7、1∶1、7∶3、9∶1)的乙腈-0.2%甲酸水溶液的提取效率,发现两者比例为1∶1时百草枯的提取回收率较好且稳定,故最终选择乙腈-0.2%甲酸水溶液(1∶1)为提取溶剂。
2.2 净化方式的选择
由于蔬菜基质较复杂,需将提取液进一步净化,从而减少对仪器的损伤以及基质效应。本研究采用DSPE技术进行净化,并对PSA、C18和GCB净化剂进行考察。其中PSA 能有效去除提取液中的极性物质、有机酸和脂肪酸等杂质;C18对亲脂性杂质和脂肪等具有较好的吸附效果;而GCB可吸附色素、甾醇等大分子非极性干扰物[17]。
比较了无净化剂和采用上述不同净化剂对百草枯回收率的影响。结果显示,不使用净化剂时的回收率能达到分析要求,但杂质较多,不利于仪器维护;而单独使用1种净化剂时的回收率相对较差。由于本实验提取出的色素相对较少,而C18具有一定的去除色素能力,且C18和PSA配合使用对杂质的吸附范围较广,因此选用C18和PSA进行净化处理。进一步实验发现,6 mL样品提取液使用300 mg PSA和300 mg C18即可达到净化效果,当增加吸附剂用量时,净化效果并无明显改善。因此实验采用300 mg PSA和300 mg C18进行DSPE净化。
2.3 质谱与色谱条件的优化
2.3.1 质谱条件的优化根据百草枯的结构特征,选择ESI+作为电离模式。先用全扫描(Full scan)模式找到百草枯的母离子、子离子,然后采用 PRM模式对百草枯进行定性和定量采集。在 PRM 模式下,进一步对二级质谱的碰撞能量(CE)进行优化,结果显示,CE值为21 eV时能够获得最佳的二级质谱定量离子响应(图1A)。由图1A可知,母离子的精确质量数为m/z186.113 05,二级质谱特征子离子的精确质量数为m/z171.091 19,理论上母离子的分子式为C12H14N2,精确质量数为186.115 15,实际与理论的精确质量数相差≤5 ppm[18],质量准确度能够满足要求。图1B为百草枯定量子离子的提取离子色谱图。

2.3.2 流动相的选择参考标准SN/T 0293-2014[4],本实验选择乙腈作为流动相的有机相。考察了不同pH值的水系流动相(纯水、甲酸水溶液)对百草枯分离效果的影响,结果表明,不加酸或流动相酸度较高时,峰形较差。而在流动相中添加0.2%甲酸时,可提高百草枯的离子化效率,分离效果满意。这是由于流动相中加入甲酸,可促进化合物的离子化[19];而百草枯为碱性化合物,甲酸能调节流动相的pH值使之呈酸性,在正离子模式下,流动相呈酸性有利于提高百草枯的离子化效率和灵敏度,改善其峰形[20]。因此,选择乙腈和0.2%甲酸水溶液为流动相。
进一步比较流动相中添加盐的分离效果,考察了乙腈-0.2%甲酸水溶液、乙腈-0.2%甲酸水溶液(含5 mmol/L乙酸铵)、乙腈-0.2%甲酸水溶液(含5 mmol/L甲酸铵)、乙腈-0.2%甲酸水溶液(含10 mmol/L甲酸铵)、乙腈-0.2%甲酸水溶液(含50 mmol/L甲酸铵)、乙腈-0.2%甲酸水溶液(含100 mmol/L甲酸铵) 6种流动相体系。结果发现,流动相中加入铵盐可改善峰形,且加入甲酸铵比加入乙酸铵的峰形更好,色谱柱达到平衡状态的时间更短。另外,随着甲酸铵的浓度升高,峰形变得尖锐,响应值增大。当甲酸铵浓度为50 mmol/L和100 mmol/L时,峰形和响应值无显著区别,但高浓度的甲酸铵会形成盐析,损伤色谱柱和管路系统。故最终选择乙腈-0.2%甲酸水溶液(含50 mmol/L甲酸铵)作为流动相。
2.4 基质效应
本实验依据基质标准曲线和溶剂标准曲线的斜率比值评价基质效应,若斜率比值>1,则表示基质对分析物的响应产生增强效应;若斜率比值<1,则表示产生抑制效应;若斜率比值为1,则表示不存在基质效应。当斜率比值为0.8~1.2时,表示基质干扰程度较低;当斜率比值为0.5~0.8或1.2~1.5时,表示有中等程度的基质干扰效应;当斜率比值小于0.2或大于1.5时,表示基质效应干扰强[21]。
采用“1.3”方法得到的空白基质提取液和乙腈-0.2%甲酸水溶液(1∶1)分别配制质量浓度为0.005~0.5 mg/L的标准溶液,按照本方法进行测定,并绘制基质标准曲线和溶剂标准曲线。由表1可见,7种蔬菜中百草枯具有不同程度的基质增强效应。本实验采用基质匹配标准工作溶液外标法进行定量,以降低基质效应的影响。
2.5 线性关系与检出限
以“1.3”方法得到的空白基质提取液,配制质量浓度为0.08~500 μg/L的百草枯基质匹配标准溶液。在“1.4”条件下进行测定,以百草枯的质量浓度(x,mg/L)为横坐标,响应峰高(y)为纵坐标,绘制标准工作曲线。表1结果表明,百草枯在不同蔬菜基质(番茄、辣椒、茄子、黄瓜、菜豆、芹菜、油麦菜)中线性关系良好,相关系数(r2)为0.992 7~0.999 4。并以信噪比S/N≥3 确定仪器的检出限(LOD),S/N≥10 确定仪器的定量下限(LOQ),得到百草枯的 LOD和LOQ分别为0.1~0.5 μg/kg和0.4~1.8 μg/kg,能够满足主要蔬菜品种中百草枯的限量要求[3]。

表1 百草枯在蔬菜中的基质效应、线性关系、检出限和定量下限Table 1 Matrix effects,linear relationships,limits of detection(LOD) and limits of quantitation(LOQ) of paraquat in vegetables
2.6 准确度与精密度
选用7种代表性蔬菜空白样品,在优化条件下进行加标回收实验,加标水平为50、100、200 μg/kg。由表2可知,百草枯在7种不同蔬菜中的平均回收率为70.8%~113%,相对标准偏差(RSD)为0.30%~7.9%,方法的准确度和精密度符合农药残留分析的要求[18]。图2为黄瓜基质中添加50 μg/kg百草枯的总离子流图和提取离子流图。
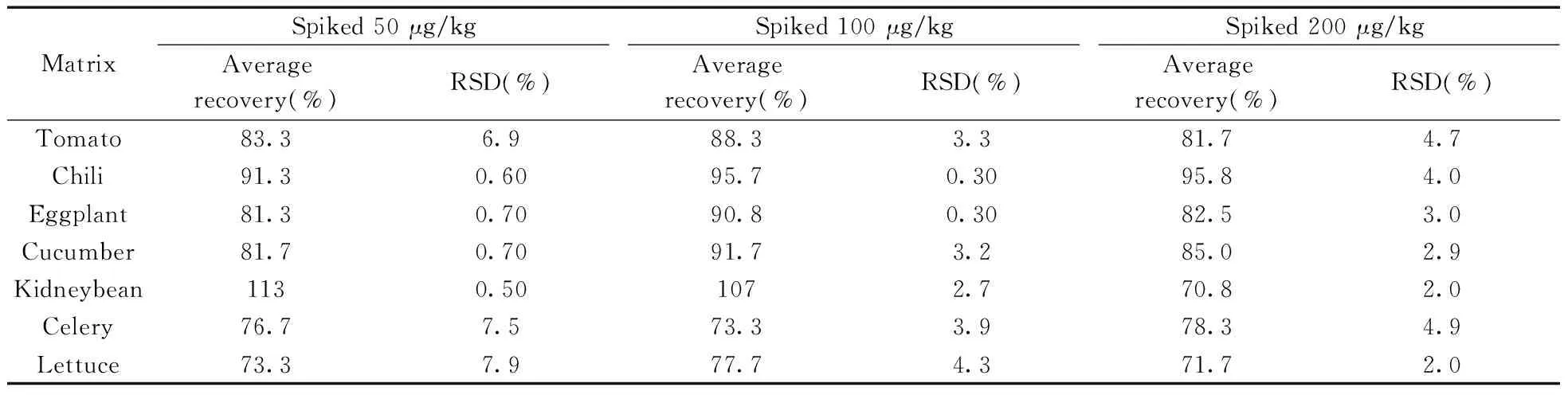
表2 不同加标水平下百草枯的平均回收率和相对标准偏差(n=6)Table 2 Average recoveries and relative standard deviations of paraquat at different spiked levels(n=6)
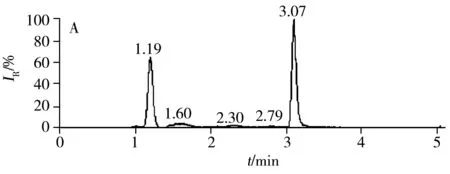
图2 黄瓜中添加百草枯(50 μg/kg)的总离子流图(A)和提取离子流图(B)
Fig.2 Total ion chromatogram(A) and extracted ion chromatogram(B) of paraquat spiked in cucumber(50 μg/kg)
2.7 实际样品测定
应用本方法对四川省多个地区随机抽取的36个番茄、33个茄子、33个辣椒、41个黄瓜、10个菠菜、9个芹菜、5个小白菜、5个莴苣、4个普通白菜、3个土豆、2个莲花白、2个萝卜和2个芫荽样品中的百草枯进行测定。结果显示,从川西平原抽检的2个小白菜、1个普通白菜、1个莲花白和1个芫荽中检出百草枯,含量分别为2.06、3.14、3.16、2.31、15.6 μg/kg,说明该地区曾有使用百草枯的现象,具体来源需进一步研究。
3 结 论
本方法采用乙腈-0.2%甲酸水溶液(1∶1)提取、分散固相萃取净化,超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速定性筛查和定量分析蔬菜中的百草枯,利用PRM模式监测其子离子的精确质量数,进一步降低了背景噪音,从而提高了灵敏度和准确性。结果表明,蔬菜中百草枯的检出限为0.1~0.5 μg/kg,定量下限为0.4~1.8 μg/kg,平均回收率为70.8%~113%,相对标准偏差为0.30%~7.9%。该方法前处理操作简单快速,灵敏度高,准确性好,可用于主要蔬菜品种中百草枯的检测。

