微生物转化制备20-去甲基DM1
(浙江海正药业股份有限公司,浙江省抗真菌药物重点实验室,浙江 台州 318000)
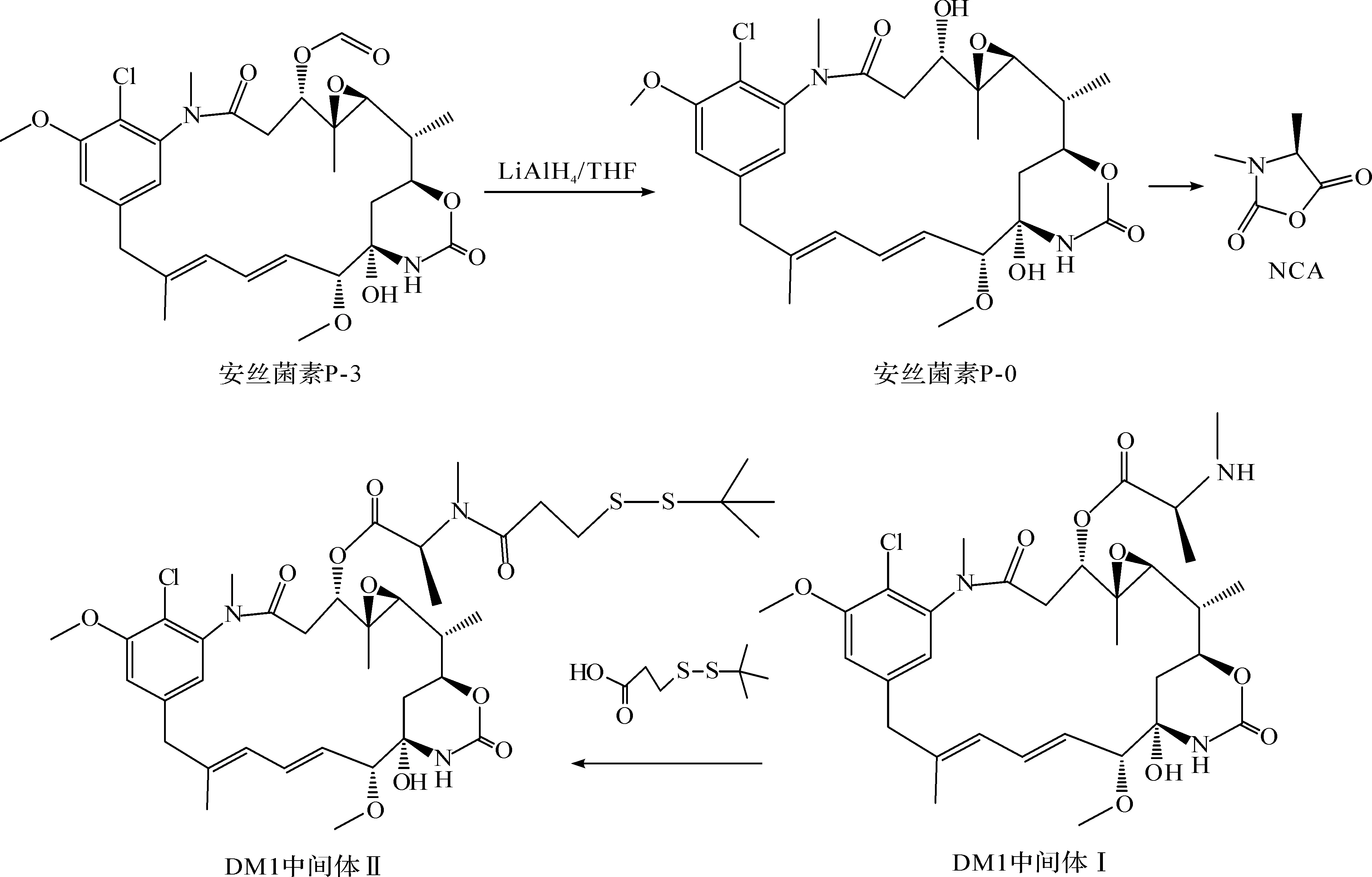
2013年2月美国FDA正式批准瑞士罗氏公司的Kadcyla用于治疗HER-29(人表皮生长因子受体2)阳性晚期转移性乳腺癌。在临床研究过程中Kadcyla被简称为T-DM1(ado-trastuzumabemtansine)。T-DM1是由曲妥珠单抗(Trastuzumab)与微管抑制药DM1(美登素衍生物)通过稳定硫醚连接物MCC(N-Succinimidyl 4-(N-maleimido-methyl)cyclohexane-1-carboxylate,4-[N-马来酰亚胺甲基]环己烷-1-羧酸琥珀酰亚胺酯)共价连接的抗体药物偶联物[1-3]。小分子组分DM1是微生物发酵产物安丝菌素P-3(Ansamitocin P-3,AP3)通过化学修饰获得[4-7],DM1是一种细胞毒药物,具有很强的抑制细胞分裂的作用。曲妥珠单抗和DM1均具有抗肿瘤活性,两者偶联后,不仅具有协同作用,同时由于曲妥珠单抗的靶向性可以将DM1更加精准地输送到肿瘤细胞内,从而减少正常体细胞的毒性作用[8]。
T-DM1的药代动力学研究试验中,需要用到T-[3H]DM1,它是由20-去甲基DM1(去甲基DM1)通过连接放射性同位素标记的甲基而获得[9]。笔者尝试找到一种更加高效便捷的方法以获得少量的20-去甲基DM1,满足T-DM1的临床研究需求。
1 仪器与材料
恒温恒湿培养箱,德国宾得公司;LC1200型高效液相色谱,美国Agilent 公司;6540 UHD Q-TOF LC/MS,美国Agilent 公司;工业摇床,上海智诚分析仪器制造有限公司;高压蒸汽灭菌柜,山东新华医疗仪器设备有限公司;净化工作台,江苏江阴璜土空气净化设备有限公司。
DM1中间体Ⅱ样品,质量分数为90%,由本公司合成部门提供,是以AP3为起始物料,经3步合成获得的去甲基DM1中间体Ⅱ[10],DM1中间体Ⅱ的合成路径为扁平链霉菌(Streptomycesplatensis)CGMCC 4.1975,黄发链霉菌(Streptomycesflavotricini) CGMCC 4.1959由本公司保藏。
固体培养基配方:酵母抽提物4.0 g/L,葡萄糖4.0 g/L,麦芽抽提物10.0 g/L,微量元素5.0 mL,琼脂16.0 g/L,灭菌前调pH至7.0,121 ℃灭菌20 min。
微量元素:MgSO4·7H2O 80.0 g/L,CaCO320.0 g/L,FeSO4·7H2O 6.0 g/L,ZnSO4·7H2O 2.0 g/L,MnSO4·7H2O 2.0 g/L,CoCl2·6H2O 0.5 g/L,Na2MoO4·6H2O 1.0 g/L。
种子培养基:麦芽糊精10.0 g/L,葡萄糖10.0 g/L,甘油10.0 g/L,蛋白胨5.0 g/L,酵母抽提物5.0 g/L,牛肉浸膏 5.0 g/L,MgSO4·7H2O 1.0 g/L,NaCl 3.0 g/L,CaCO35.0 g/L,灭菌前调pH至7.0,121 ℃灭菌20 min。
发酵培养基:麦芽糊精10.0 g/L,葡萄糖30.0 g/L,黄豆饼粉10.0 g/L,酵母抽提物5.0 g/L,牛肉浸膏5.0 g/L,MgSO4·7H2O 1.0 g/L,NaCl 3.0 g/L,CaCO35.0 g/L,灭菌前调pH至7.0,121 ℃灭菌20 min。
2 方法与结果
2.1 工艺流程图
以DM1化学合成过程的中间体Ⅱ为底物,通过筛选合适的微生物,采用生物转化的方法,专一性地去除20位羟甲基,获得20-去甲基DM1中间体Ⅱ,再进一步还原制备得到20-去甲基DM1,工艺流程为

2.2 培养方法
斜面培养:将CGMCC 4.1975菌株和CGMCC 4.1959菌株的孢子悬液接种到固体斜面培养基上,28 ℃培养7 d。
种子培养:刮取少量斜面孢子转接到装有35 mL种子培养基的250 mL三角摇瓶中,置于28 ℃,250 r/min培养48 h。
发酵培养:将培养好的种子液按2%的接种量转接到装有35 mL发酵培养基的250 mL三角摇瓶中,置于28 ℃,250 r/min培养至48 h,加入2.9 g/L的DM1中间体 Ⅱ 溶液0.5 ml(终浓度为40 mg/L),补入底物后继续培养24 h,至发酵72 h,收集发酵料液。
2.3 分析检测方法
取发酵液10 mL, 4 000g离心10 min。取3 mL上清液,加入3 mL无水乙醇,4 000g离心10 min,用0.45 μm滤膜过滤,进行HPLC检测。色谱条件:色谱柱welch materials vltimate AQ-C18(4.6 mm×250 mm,5 μm);波长252 nm;流速1.0 mL/min;流动相A为V(三氟乙酸)∶V(乙腈)=3∶7,流动相B为体积分数0.1%的甲酸水溶液,洗脱方法如表1描述。

表1 液相洗脱方法Table 1 Elution method of HPLC
2.4 去甲基DM1的标定
由于无法外购去甲基DM1的标准品,只能以DM1中间体Ⅱ样品为对照,根据DM1中间体Ⅱ样品液相峰单位面积来估算去甲基DM1的产量。
2.5 转化DM1中间体Ⅱ微生物的筛选
笔者团队前期的研究发现黄发链霉菌CGMCC 4.1959与扁平链霉菌CGMCC 4.1975均能转化底物AP3[11],获得去甲基AP3,因此进一步考察这两株菌能否直接转化DM1获得去甲基DM1。实验结果中并没有得到相应的产物(去甲基DM1分子量为723),而是多了一个分子量为1 475.6[M+H]+的产物,转化产物的质谱图见图1)。根据分子量判断是由两分子的DM1形成的聚合物,表明直接以DM1为底物进行转化不可行,因为DM1的结构有末端巯基,不稳定,容易降解或者形成二聚体。

图1 DM1为底物的转化产物的质谱图Fig.1 Mass spectrogram of the product from DM1 as substrate
进一步考察这两株微生物是否有转化DM1中间体Ⅱ的能力。转化后,两株菌的液相图谱中均有分子量为812.3[M+H]+的产物,其质谱图见图2,与去甲基DM1中间体Ⅱ的分子量一致。比较两株菌对底物的转化效率,CGMCC4.1975转化率为92%,CGMCC4.1959为8%,表明CGMCC4.1975菌株的转化活性更高,可用于下一步的研究。
2.6 去甲基DM1中间体Ⅱ转化条件优化
按2.2节方法进行CGMCC 4.1975菌株的摇瓶发酵培养,发酵培养至48 h,添加2.9 g/L的DM1中间体Ⅱ底物,控制底物质量浓度10.0~60.0 μg/mL,继续培养至72 h,检测去甲基DM1中间体Ⅱ的产量,计算转化率,结果见表2。由表2可知:当底物质量浓度低于40.0 μg/mL时,去甲基DM1中间体Ⅱ的转化产量随底物质量浓度的升高逐步升高;当底物质量浓度高于40.0 μg/mL时,随底物质量浓度的升高,去甲基DM1中间体Ⅱ的转化产量基本保持不变。因此,确定最适的底物质量浓度为40.0 μg/mL,去甲基DM1中间体Ⅱ产量为24.4 μg/mL。

表2 DM1中间体Ⅱ的浓度对转化率的影响
笔者考察了转化时间对DM1中间体Ⅱ转化的影响。在发酵48 h时添加2.9 g/L的DM1中间体Ⅱ溶液0.5 mL(终质量浓度为40.0 μg/mL),在不同的转化时间检测去甲基DM1中间体Ⅱ的产量,结果见表3。从结果可知,转化至24~36 h时,转化效率为61%~63%,继续延长则产量,可能是产物不稳定,发生降解造成的,故最佳转化时间为24~36 h。

表3 转化时间对转化率的影响Table 3 The effect of reaction time on conversion rate
2.7 去甲基DM1的制备
在前述优化条件的基础上,进行去甲基DM1样品的制备[12-13]。共收集发酵料液30 L,去甲基DM1中间体Ⅱ的质量浓度为24.4 μg/mL,加硅藻土,抽滤收集滤液。第一次加入20 L乙酸乙酯萃取,收集有机相,第二次加入10 L乙酸乙酯萃取,收集有机相。合并有机相,50 ℃真空浓缩至油状物。用250 mL二氯甲烷溶解,上1 L硅胶柱,用洗脱液洗脱,洗脱液为V(二氯甲烷)∶V(甲醇)=40∶1,分段收集样品,浓缩,得到去甲基DM1中间体 Ⅱ 粗品500 mg。
粗品用体积分数为45%的乙腈溶解到100 mg/mL,过滤,上制备柱SHIMADZU PRC-ODS 2 cm×25 cm,按2.3节洗脱条件进行洗脱,收集目标峰。洗脱液用二氯甲烷萃取,收集有机相,浓缩得到250 mg样品。以TECP(三-[2-羧乙基]-膦)为还原剂在三氟乙醇反应体系中将去甲基DM1中间体Ⅱ样品进行巯基还原,待反应结束后,浓缩反应液。浓缩后用20 mL乙酸乙酯萃取,收集乙酸乙酯相,并将乙酸乙酯相浓缩并干燥,再用5 mL二氯甲烷溶解,上层析柱,洗脱,洗脱液为V(二氯甲烷)∶V(甲醇)=50∶1,共获得200 mg样品。经过质谱分析,样品分子量为724.3[M+H]+,质谱图见图3,与DM1进行氢谱比对,见图4,确认样品为20-去甲基DM1,总产率约为19.3%。

图3 去甲基DM1的质谱图Fig.3 Mass spectrogram of demethylation DM1

图4 DM1和去甲基DM1的氢谱对比Fig.4 The contrast of DM1 and demethyl DM1
去甲基DM1的氢谱:1H NMR(CDCl3)δ为0.80(3H, s), 1.24(1H, m), 1.30(6H, m), 1.46(1H, m), 1.54(1H, d,J=13 Hz), 1.65(3H, s), 1.69(1H, t,J=8 Hz), 2.20(1H, dd,J=3,14 Hz), 2.57(1H, m), 2.61(1H, m), 2.73(3H, m), 2.84(3H, s), 3.02(1H, d,J=9 Hz), 3.10(1H, d,J=12 Hz), 3.21(3H, s), 3.36(3H, s), 3.52(1H, d,J=9 Hz), 3.62(1H, d,J=12 Hz), 4.28(1H, t,J=11 Hz), 4.76(1H, dd,J=3,12 Hz), 5.41(1H, q,J=7 Hz), 5.62(1H, dd,J=9,15 Hz), 5.81(1H, s), 6.22(1H, s), 6.44(1H, dd,J=11,15 Hz), 6.65(1H, d,J=1.6 Hz),6.69(1H, d,J=11 Hz), 6.96(1H, d,J=1.6 Hz)。
DM1的氢谱[6]:1H NMR(CDCl3)δ为0.84(3H, s), 1.33(3H, d,J=5 Hz),1.35(3H, d,J=5 Hz), 1.60(3H, s), 1.68(3H, s), 2.22(1H, dd,J=3,14 Hz), 2.60-2.82(2H, m), 2.88(3H, s), 3.08-3.20(2H, m), 3.25(3H, s), 3.39(3H, s), 3.55(1H, d,J=9 Hz), 3.71(1H, d,J=12 Hz), 4.02(3H, s), 4.32(1H, t,J=10 Hz), 4.81(1H, dd,J=3,12 Hz), 5.45(1H, q,J=7 Hz), 5.67(1H, dd,J=9,15 Hz), 6.25(1H, s), 6.47(1H, dd,J=11,15 Hz),6.70(1H, d,J=1.5 Hz), 6.75(1H, d,J=11 Hz), 6.86(1H, d,J=1.5 Hz).
由于没有文献资料报道过去甲基DM1的氢谱资料,笔者只能与DM1的氢谱数据进行比对,发现两者存在比较明显的差异,去甲基DM1的氢谱在5.81有一个氢的信号,而DM1的氢谱在相近位置处并没有此信号,而是羟基氢的信号。DM1的氢谱在4.02处有一个连氧甲基的信号,而去甲基DM1氢谱在相近位置处并没有此信号,而是20-羟甲基的3个氢的信号。其他位置的信号都能够对应,并无明显差异,而两者的分子量正好相差14,说明是DM1的20-去甲基产物。
3 结 论
通过筛选,分离纯化,获得对去甲基DM1中间体Ⅱ具有较好的转化率的扁平链霉菌CGMCC 4.1975,通过转化条件的优化,提高了转化效率,从而建立DM1中间体Ⅱ的微生物转化工艺,并通过一步还原反应制备去甲基DM1,为T-DM1的临床研究提供了样品,是制备20-去甲基DM1的一种高效简便的方法,不仅充分利用了DM1合成过程的中间产物,同时也避免了以AP3为起始物合成去甲基DM1的繁琐过程。