CRISPR/Cas9技术编辑淀粉合成基因PUL
奉宝兵 魏祥进 焦桂爱 胡时开 邬亚文 谢黎虹 圣忠华 邵高能 唐绍清
(中国水稻研究所/农业部水稻生物学与遗传育种重点实验室/水稻生物学国家重点实验室,杭州310006;第一作者:tuopuyigou@163.com;*通讯作者:sqtang@126.com)
胚乳中淀粉的生物合成是通过一系列酶促反应转变成淀粉的过程,因此ADP-葡萄糖焦磷酸化酶(AGPase,ADP glucose pyrophosphorylase)、淀粉合成酶(SS,starch synthase)、淀粉分支酶(SBE,starch branching enzyme)和淀粉去分支酶(DBE,debranching enzyme)被称为淀粉合成过程中的4类关键酶[1-4]。
DBE家族分为异淀粉酶亚家族ISA1、ISA2、ISA3和PUL普鲁兰酶。DBEs在淀粉的合成与降解中都具有重要作用[5-7]。在支链淀粉合成过程中,可以移除不合理分子的短链,并且将其连接到新链上,保证淀粉形成稳定的晶体结构;在种子萌发的过程中,可以特异性切割支链淀粉的α-1,6糖苷键,保证淀粉降解,促进种子发芽[8-9]。
前人对DBEs的异淀粉酶(isoamylase)研究报道很多,但对OsPUL的研究较少。FUJITA等[10]认为,OsPUL可以部分恢复isa1瘪粒突变体的表型,并报道不同突变位点与千粒重(脱壳后)既有正相关也有负相关。FUJITA等鉴定了3种不同pul等位突变体e10、i16和EM1003。对千粒重分析发现,EM1003(启动子上游1 266 bp处C替换了T)千粒重为22.42±0.29 g,比野生型(千粒重为 20.37±0.03 g)增加 10.06%;而e10(第 10个外显子内突变)和i16(第16个内含子内突变)千粒重分别为 20.12±0.02 g和 19.00±0.03 g,与野生型相比略有下降。LI等[11]报道OsPUL是胚乳特异性表达基因,在开花后15 d相对表达量最高,认为在OsPUL的启动子区存在GCN4、AACA和E2F等多个顺式作用元件。
近几年基因组编辑(Genome editing)育种迅速发展[12-13],其主要优势是不依赖随机重组或杂交过程、可以精准诱变、易获得纯合突变。基因组编辑技术主要有三种人工核酸酶,分别是锌指核酸酶(ZFNs)、TALE核酸酶(TALENs)以及CRISPR系统[14]。中科院遗传所高彩霞课题用优化的Cas9蛋白对水稻OsBADH2、OsPDS和OsMPK2单个基因进行定点编辑,之后科研人员定点编辑了OsBadh2、OsGn1a、OsGT3、OsTGW6等重要的产量和品质相关基因[15-16]。
本研究用CRISPR/Cas9技术对调控稻米脱支酶基因OsPUL进行定点编辑,进一步探索OsPUL对淀粉合成和产量的关系,期望获得具有重要育种价值的PUL等位变异,并为分子育种提供材料基础和理论指导。
1 材料与方法
1.1 试验材料
本研究所用水稻材料为粳稻品种中花11(Zhonghua 11,ZH11),以及以ZH11为转基因受体的T0代植株、T0代植株自交后代T1植株等。所有转基因材料单本移栽到转基因安全圃,中耕除草,水肥管理和病虫草害防治同大田管理。
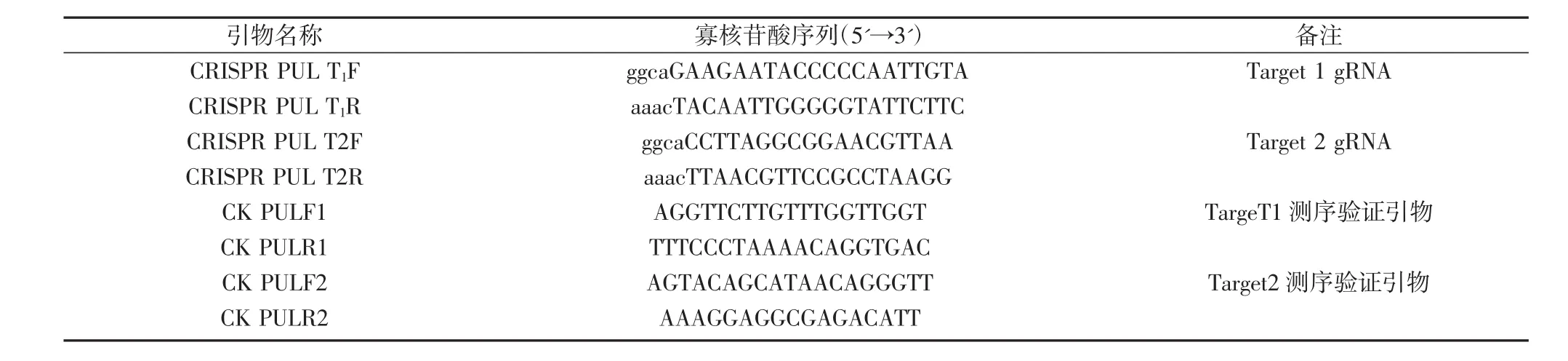
表1 CRISPR所用引物
1.2 PUL编辑载体构建
根据CRISPR/Cas9的引物设计原理[17-18],设计2个靶序列CRISPR-PUL-1和CRISPR-PUL-2(表1)。靶序列的引物退火成双链后,与线性化的SK-gRNA/AarI(20~50 ng)连接,构建成中间载体gRNA::PUL1和gRNA::PUL2。然后,用一步法将 gRNA::PUL1、gRNA::PUL2和pC1300-Cas9等3个载体同时线性化,利用同尾酶具有相同的粘性末端的特性,将三者连接成pC1300-Cas9::PUL1-PUL2。CRISPR/Cas9相关载体SK-gRNA和pC1300-Cas9等由中国水稻研究所王克剑课题组馈赠。
1.3 转基因阳性植株鉴定
将构建好的双靶点pC1300-Cas9::PUL1-PUL2载体通过农杆菌EHA105介导转化水稻品种ZH11成熟胚愈伤组织,T0代转基因植株经过炼苗后单本移栽转基因安全圃。分蘖期取叶片并编号,提取转基因水稻基因组DNA。用潮霉素引物HptF/R(产物750 bp)和Cas9蛋白引物Cas9-Protein F/R(产物500bp)进行PCR扩增。
同时,根据靶位点序列特征设计CAPS标记,对PCR扩增产物用内切酶酶切鉴定(PCR-RE),能被切开成两条带,说明靶位点序列没有发生突变,反之,则发生突变。此外,以ZH11和转基因植株基因组DNA为模板,CK-PUL-F1/R1和CK-PUL-F2/R2为引物分别扩增PUL基因的2个靶位点,PCR产物测序结果用SnapGene 2.32软件进行序列比对和峰图分析,鉴定转基因植株中PUL的基因型。
1.4 农艺性状考察
在田间选择同一小区里长势一致,剔除边行的植株,测定T1部分突变体的株高、穗长、剑叶长、剑叶宽,并计算这些植株的分蘖数、穗粒数、结实率。收种后烘干种子,去除瘪粒,枝梗;随机挑选饱满的种子称量千粒重,并用万深考种仪考察粒长、粒宽、长宽比等粒形性状。
1.5 稻米生理生化品质
对T0和T1两代种子进行稻米品质以下生理指标检测:总淀粉含量、直链淀粉含量、蛋白质含量、糊化温度等,每个样品测3次,取平均值进行统计分析。总淀粉含量测定采用分光光度计法,直链淀粉含量用Megazyme试剂盒(K-AMYL07/II)测定;蛋白质含量用近红外透射光谱技术测定,实验步骤参照孙成效的方法[3]。糊化温度用差示扫描仪(DSC)测定,参照 Kweon M[19]的方法。
1.6 粒重和淀粉合成相关基因表达分析
取开花后12 d的种子,立即放入液氮中,然后转入-80℃冰箱长期保存。选5粒冷冻种子进行RNA提取,参照Prescott和Marti的方法。用赛默飞公司的Nanodrop 2000检测总RNA的纯度和浓度,RNA质量合格后进行反转录。在Roche Light Cycle 480 Real-Time PCR仪上,以Ubiquitin作内参,用SYBR qPCR Mix配置反应体系,反应程序为:95℃ 30 s,95℃ 5 s/60℃ 10 s/72℃ 10 s(40 个循环),68℃ 10 min,10℃ 8 min。利用仪器自带软件进行分析,并用2-△△CT方法计算各基因的相对表达量和制作直方图。
2 结果与分析
2.1 PUL基因编辑阳性植株鉴定
为了验证PUL基因是否被成功敲除,我们首先利用CAPS引物对获得的45株T0代转基因植株进行PCR扩增及酶切检测。从图1可知,Psp1406I的酶切结果显示,转基因植株中靶位点2处有6株不能被限制酶切开,即发生突变,分别为 T0-3、T0-18、T0-21、T0-22、T0-32和T0-39。MunI酶切结果显示,转基因植株中靶位点1处有19株不能被限制酶切开,产生突变,分别为 T0-1、T0-3、T0-4、T0-7、T0-8、T0-11、T0-12、T0-15、T0-18、T0-21、T0-22、T0-25、T0-27、T0-32、T0-33、T0-36、T0-40、T0-43 和 T0-45(图 2)。综上所述,2 个靶位点处共有20株发生了基因编辑事件。

图1 Psp1406I酶切靶位点2

图2 MunI酶切验证靶位点1

图3 Sanger测序结果
PCR产物酶切结果可大致判断靶位点处是否发生突变,却不能准确判断是纯合突变还是杂合突变,以及突变类型。因此,我们对靶序列处的500 bp左右PCR产物进行测序鉴定突变类型。结果表明,T0代转基因植株中靶位点1处有11株野生型、34株突变体,突变率为75.5%;靶位点2处有21株野生型、24株突变体,突变率为53.3%。我们对上述转基因材料于成熟期单株收种,并对T0-1、T0-6、T0-11和T0-18共4个转基因系进行遗传分析。从图3可知部分T1单株的突变类型主要以单碱基的插入和单碱基的缺失为主,并造成移码突变导致氨基酸序列改变,从而影响蛋白质功能。
由考种数据可知T0-18的粒重极显著增加(图4 F),于是重点对T1-18的转基因系进行遗传分析,结果表明,敲除载体在T1-18后代中发生了分离(图5)。此外,通过对T1-18的24个单株PUL 2个靶位点进行测序分析,发现目的基因的突变位点也发生了分离(表2)。并获得了纯合单株,2个靶位点都是纯合突变用mu表示;2个靶位点存在1个杂合突变用H表示。因此,我们通过CRISPR/Cas9基因编辑技术对水稻淀粉脱支酶家族的普鲁兰基因进行编辑,获得了pul的纯合突变体,同时还获得剔除载体骨架的遗传材料2个,分别为T1-18-10和T1-18-21(图5和表2)。
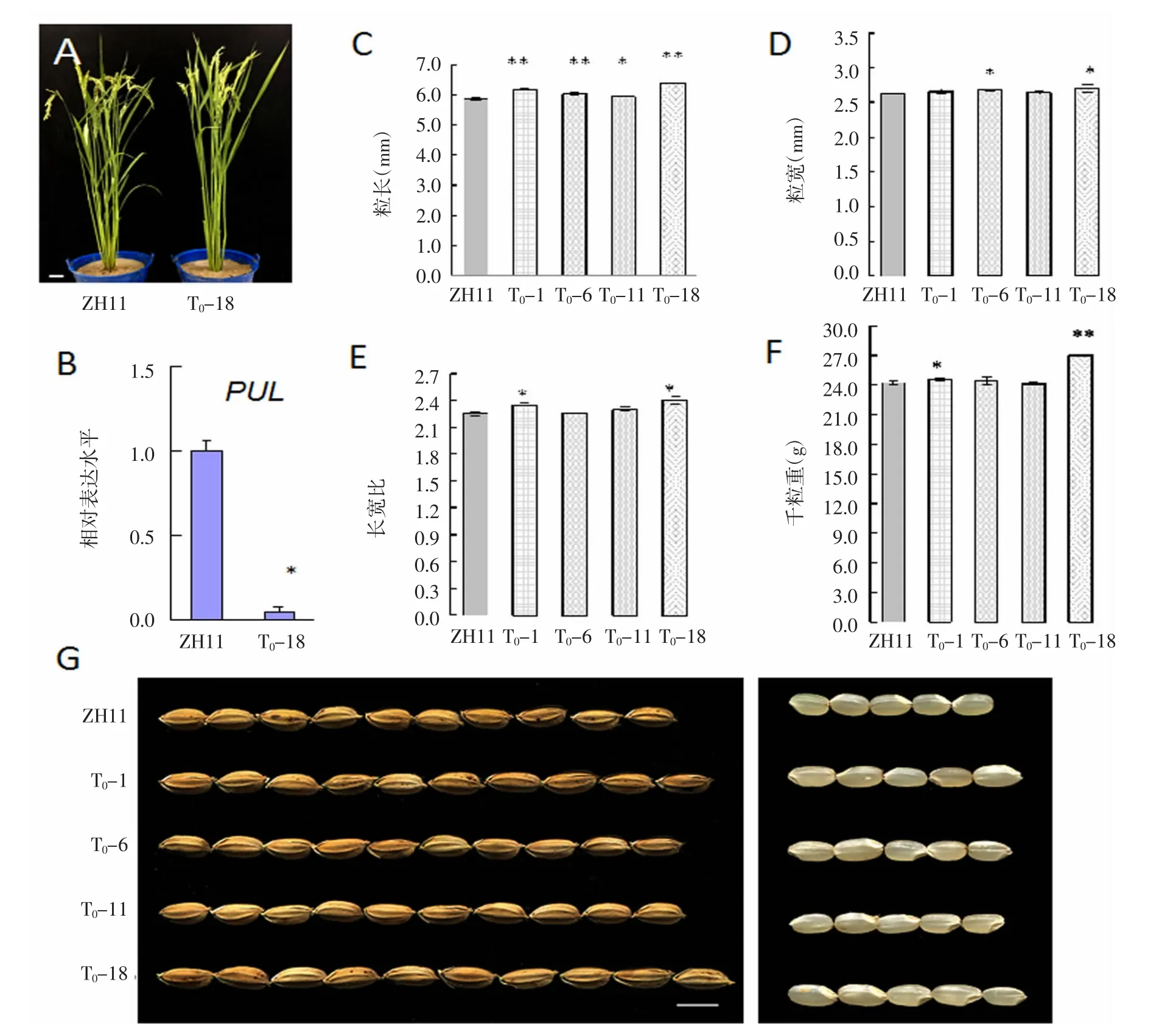
图4 相关农艺性状及PUL表达量

图5 T1-18转基因植株载体序列的分离

表2 T1-18转基因植株PUL基因型的分离
2.2 产量相关性状考察分析
为探明PUL基因突变后对产量相关性状的影响,我们对T0代突变体和野生型ZH11进行产量性状考察。
以转基因系T0-18为代表进行详细调查,在大田中可以看出T0-18的生育期比ZH11长,前者处于灌浆中期,后者处于灌前初期,生育期相差3~5 d,但是T0-18的株高和野生型没有差异(图4 A),RT-PCR结果表明,与野生型相比,T0-18植株中PUL基因的相对表达水平降低了17倍(图4 B),从RNA水平上验证了PUL基因被成功敲除。

图6 稻米品质分析结果
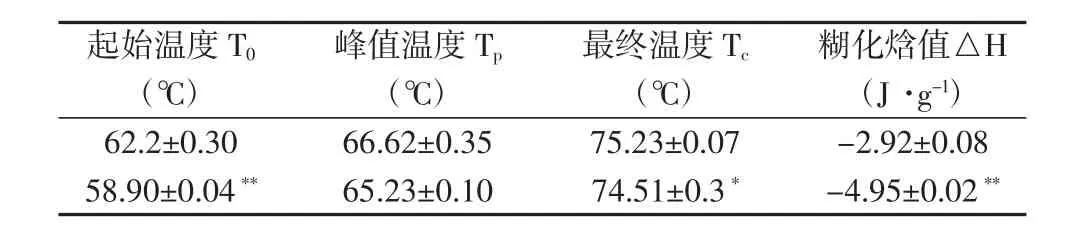
表3 野生型和T0-18胚乳的糊化特性

图7 T0-18的相关基因表达
RT-PCR结果表明,T0-18的PUL基因的相对表达水平,与野生型相比降低了17倍(图4 D);从RNA水平上验证了PUL基因被成功敲除。转基因系T0-18的千粒重与对照(ZH11)相比增加10.3%(图4 F)。
粒形分析表明,T0-1、T0-6、T0-11和 T0-18株系的粒长都比ZH11增加,达到显著差异,其中T0-18的粒长(6.39 mm)比 ZH11的粒长(5.88 mm)增加 8.6%(图4 B、G);T0-6和T0-18株系的粒宽与ZH11相比显著提高,而T0-1和T0-11株系的粒宽与ZH11无显著差异。T0-1和T0-18的长宽比均比野生型ZH11显著增加(图4 E、F、G)。此外,转基因系T0-18的千粒重与野生型ZH11相比增加10.3%(图4 F)。
2.3 稻米品质分析
普鲁兰酶主要功能是去除极限糊精中的α-1,6糖苷键,虽然普鲁兰酶的功能在玉米、水稻、小麦、拟南芥等植物中都证实有上述功能。但是,普鲁兰酶在水稻种子淀粉合成的报道还比较少。为了探讨OsPUL敲除后对稻米品质的影响,我们检测了总淀粉、直链淀粉、支链淀粉、蛋白质的相对含量(图6)和糊化温度。
相比野生型。T0转基因系的淀粉含量降低,蛋白质含量极显著增加(图6),糊化温度略低0.7℃~2.0℃(表3)。T0-11和T0-18比野生型的直链淀粉含量极显著降低,其他达到显著水平。相对而言,T0-1、T0-6、T0-11、T0-18比野生型的蛋白质含量都极显著增加。
2.4 品质及粒形相关基因表达
进一步解释敲除突变体的稻米品质变化,及粒形、粒重与野生型的差异,我们检测了品质及粒形相关基因的相对表达量。结果表明,淀粉合成相关基因和粒重相关基因在T0-18种子中的相对表达量有升有降(图7)。表达量增加的有淀粉合成酶1(SSI)、淀粉分支酶2(BE2),以及正向调控粒形和千粒重的丝氨酸羧肽酶编码基因GS5[11,20]和正向调控粒长的Gl7[21]。而粒重负调控基因 GS3[16,22]和 GW8[23]的表达量都较低。
3 讨论与结论
本文通过CRISPR/Cas9基因编辑技术获得了PUL基因的不同等位变异植株,且获得了剔除转基因成分的纯合突变株系,为进一步利用该基因进行水稻遗传改良提供了重要材料基础。
FUJITA等[10]认为,OsPUL可以部分恢复isa1瘪粒突变体的表型,该基因还影响千粒重,此外OsPUL影响淀粉的晶体结构和淀粉含量。我们研究发现,OsPUL不仅调控淀粉合成,还影响储藏蛋白的含量。以ZH11作对照,选4个代表性的T0代植株,检测其淀粉、蛋白质和糊化温度等稻米营养指标发现,T0-18的直链淀粉含量降低了18.70%,其蛋白质含量增加了22.02%,而OsPUL敲除后对稻米外观品质无显著差异(图4 G)。
根据前人报道,在淀粉合成酶基因中,SSI有利于促进支链淀粉合成,而SSIIIa则促进支链淀粉和超长支链淀粉合成[8]。SSI表达量增加,SSIIIa表达量下降(图7),可以从侧面推测参与直链淀粉合成的酶减少,同时参与支链淀粉合成的酶增加,这与T0代稻米中直链淀粉含量降低的结果相佐证(图6)。PUL属于淀粉脱支酶(DBEs)家族基因,当pul功能缺失时,并没有像同家族的isa1(亦称sug1)突变体一样导致种子干瘪,而是形成稍许腹白,可能淀粉脱支酶家族的基因有功能冗余,ISA1可以弥补pul突变对支链淀粉合成的影响。
PUL基因编辑材料可能促进粒长增加,具有增产潜力。已有研究表明,GW8是具有SBP结构域的转录因子,可以与GL7的启动子结合,抑制其表达[21]。根据T0-18株系中粒形相关基因表达分析发现,GW8表达量下降,可导致对GL7的抑制作用减弱,从而使得GL7的表达量升高,导致粒长、粒重增加。T0-18纯合突变体千粒重增加,可能是光合产物增加,也可能是粒形粒重相关基因的表达量变化,促使千粒重增加。此外,千粒重的正调控基因GS5和GL7表达量升高,而粒形和粒重的负调控基因GW8和GS3表达量降低[16,22,24],多个粒重相关基因形成复杂的调控网络,共同作用促进了纯合突变体的千粒重增加(图7)。

