石漠化地区野生多花木蓝根瘤资源调查与分析
席 溢,赵丽丽,王小利,曾庆飞,陈 超*
石漠化地区野生多花木蓝根瘤资源调查与分析
席 溢1,赵丽丽1,王小利2,曾庆飞2,陈 超1*
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省草业研究所,贵州 贵阳 550006)
为充分发挥豆科植物在生态恢复与重建中的作用,调查了贵州省境内石漠化部分地区的野生多花木蓝根瘤资源.结果表明:隶属于干热河谷南亚热带季雨林生态区的野生多花木蓝根瘤菌及内生细菌资源较为丰富;野生多花木蓝的共生结瘤率只达50%左右,根瘤全部着生于寄主的侧根及须根上,大小可达0.5~3.0mm;12株根瘤菌分布在6个属10个种,其中慢生根瘤菌属()的分布频率最高41.67%,慢生根瘤菌属的和伯克霍尔德菌属的发生频率最高16.67%;16株根瘤内生细菌分布在4个属11个种,其中芽孢杆菌属()的分布频率最高43.75%,芽孢杆菌属的的发生频率最高31.25%.
石漠化;多花木蓝;根瘤菌;内生细菌;区系分析
喀斯特地区生境普遍土层浅薄、岩石裸露率高、保水性差,土壤养分易流失,生态系统脆弱,易遭破坏且难于恢复.再加上强烈的人为干扰,造成喀斯特地区土壤侵蚀严重,土地生产力严重下降,最终出现石漠化[1].石漠化治理的关键是提高植被覆盖度,保持水土,增加土壤中碳、氮、磷含量等.相对化学手段,通过生物学手段促进土壤中氮积累,更环保[2].豆科植物()与根瘤菌()的共生固氮作用,是最重要的生物固氮形式[3].共生固氮量占生物固氮总量的80%左右[4].根瘤菌是与豆科植物共生,在其根部或茎部形成根瘤,并固定空气中氮气为植物提供营养的一类革兰氏染色阴性需氧杆菌[1].因此,相对非豆科植物,豆科植物对土壤中全氮、速效氮和有机碳的改善作用更显著[6-7].目前,常将豆科植物与非豆科植物进行轮作、套种,以改善土壤质量和提高农作物产量,并利用共生固氮进行生态修复[8].豆科植物被公认为逆境生态恢复和贫瘠退化土壤修复最有效的先锋植物[9],能有效增加植被覆盖度,减少径流、泥沙及养分的流失[10].
某些豆科植物与根瘤菌形成固氮共生体的同时,其根瘤内还存在多种其他类群的内生细菌[11-12].此外,根瘤菌与豆科植物建立共生关系,不仅需要与寄主相互识别,还受地理环境的影响[13-14].寄主要适应所在环境,而与其结瘤的根瘤菌受到寄主和环境的选择.
多花木蓝()为豆科木蓝属灌木,耐贫瘠性和抗旱性较强,有水土保持作用;蛋白质含量高,有多种氨基酸成分,具有一定的饲用价值.研究表明,多花木蓝也是结瘤植物之一[15],其根瘤菌具有丰富的遗传多样性[16].贵州是我国唯一没有平原支撑的内陆山区省份,喀斯特环境独特,针对该地区野生多花木蓝根瘤资源系统研究工作缺乏[17-18].
本研究采集了贵州省境内石漠化部分地区的多花木蓝根瘤资源,分离纯化根瘤菌株,采用16S rDNA序列分析比对,鉴定菌株,并进行了区系分析.以期挖掘地区资源,为石漠化地区生态恢复与重建中充分发挥豆科植物与根瘤菌共生固氮技术提供理论支持.
1 材料与方法
1.1 资源调查区域及概况
根据云贵高原地形地貌和天然豆科牧草分布特点,于2016年7月~2017年6月,对贵州省境内野生多花木蓝根瘤菌资源进行了调查.调查范围涉及全省36个县(市)(图1).
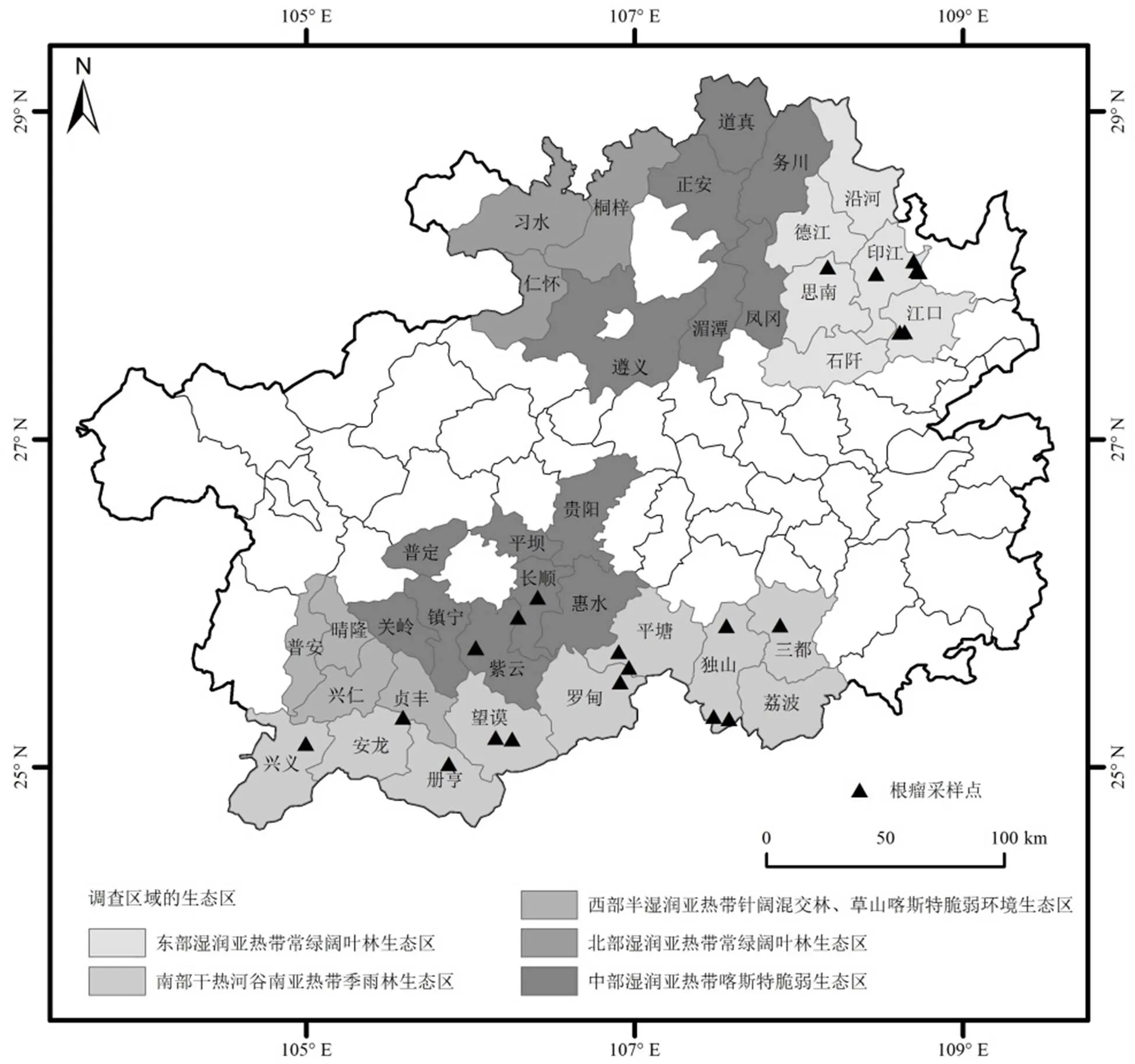
图1 多花木蓝根瘤资源调查区域的生态区及根瘤采集点
依据《贵州省生态功能区划》[19],调查区域涉及了全省全部的生态区:(1)东部湿润亚热带常绿阔叶林生态区.德江、沿河、印江、江口、思南、石阡,属中亚热带季风湿润气候区,年均气温13.5~17.6℃,年均降水量1110~1410mm;(2)南部干热河谷南亚热带季雨林生态区.兴义、安龙、册亨、望谟、罗甸、平塘、荔波、三都、独山,属典型的亚热带温暖温润的季风气候,年均气温13.6~19.6℃,年均降雨量1100~1400mm;(3)西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区.普安、晴隆、兴仁、贞丰,属亚热带季风湿润气候,年均气温14.0~19.0℃,年降水量1100~1500mm;(4)北部湿润亚热带常绿阔叶林生态区.仁怀、桐梓、习水,属亚热带季风气候,年均气温15.1℃,年均降水量1200mm;(5)中部湿润亚热带喀斯特脆弱生态区.贵阳、遵义、湄潭、凤冈、务川、正安、道真、惠水、长顺、平坝、普定、镇宁、关岭、紫云,属典型的高原型湿润亚热带季风气候,年均气温14℃,年均降雨量1360mm.
1.2 野生多花木蓝根瘤标本的采集
相邻采样点要求路程距离大于15km,或海拔差大于50m.选择生长状况良好的植株,采集个大、饱满根瘤.根瘤装入离心管中密封、编号,并记录采集点信息.
1.3 根瘤菌株与内生细菌的分离与纯化
自来水冲净样品泥土,无菌水浸泡直至根瘤吸胀.每份样品挑选10~20颗个大、饱满的根瘤,95%酒精浸泡5min,0.1%HgCl2处理5min,无菌水冲洗数次,转至无菌研钵.加无菌水1000mL,研磨成悬浊液,将悬浊液转到YMA平板(加有刚果红),均匀涂布,恒温(28℃)倒置培养3~7d后,先后有菌落长出.及时挑取单菌落,进行革兰氏染色,镜检.纯化菌株接种到YMA液体培养基中,振荡培养7d(28℃),30%甘油保种,-70℃保藏.
1.4 纯化菌株16S rDNA的测定
菌株DNA利用试剂盒(UNIQ-10柱式)提取.引物为P1和P6.PCR反应条件:预变性94℃ 5min,变性94℃ 30s,退火54℃ 1min,延伸72℃ 2min;循环35次;延伸72℃ 10min.纯化回收PCR产物,连接质粒载体PMD18-T,转化大肠杆菌DH5α;筛选获取转化子,验证提取的质粒DNA[20].产物送昆明硕擎生物公司测序.序列结果利用NCBI中Blast和GenBank数据库中已知序列进行比对,确定分离菌株的分类地位.
1.5 根瘤菌株与内生细菌的区系分析
分析根瘤菌及内生细菌的种类组成、分布频率以及优势种类.
相对频率计算分布频率和发生频率:分布频率=有某菌种的样品数/有菌种的总样品数;发生频率=有某菌种的菌株数/鉴定出的菌株总数.
2 结果与讨论
2.1 野生多花木蓝根瘤资源调查
在贵州省36个县(市)不同生态环境的野生多花木蓝根瘤资源调查中,共采集到根瘤样品23份.所采样品来自于印江、独山、紫云等13个县(市)(表1).在东部湿润亚热带常绿阔叶林生态区、中部湿润亚热带喀斯特脆弱生态区、南部干热河谷南亚热带季雨林生态区中的部分县(市)采集到了野生多花木蓝根瘤资源,在北部湿润亚热带常绿阔叶林生态区和西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区未采集到.调查中发现,土壤疏松、水分条件正常的环境条件下,多花木蓝长势较好且根瘤较多,个体大;而土壤板结、干旱或低洼积水地带,多花木蓝长势较差,根瘤较少,个体小(图2).而海拔高度对多花木蓝根瘤的数量与大小没有直接的影响(表1).

a:根瘤较多根系;b:根瘤
本研究仅在部分区域采集到野生多花木蓝根瘤资源.土壤疏松、水分条件正常的环境条件下,多花木蓝长势较好且根瘤较多,这应与多花木蓝的生长习性有关.有研究也显示,阴坡或常年阳光照射不足的区域,干旱气候下很难采集到根瘤[21].未采集到根瘤资源的北部湿润亚热带常绿阔叶林生态区和西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区,可能是不适的水分条件造成形成的根瘤脱落,或是土壤条件不利于根瘤的形成,或是缺乏相应的根瘤菌[22-23].
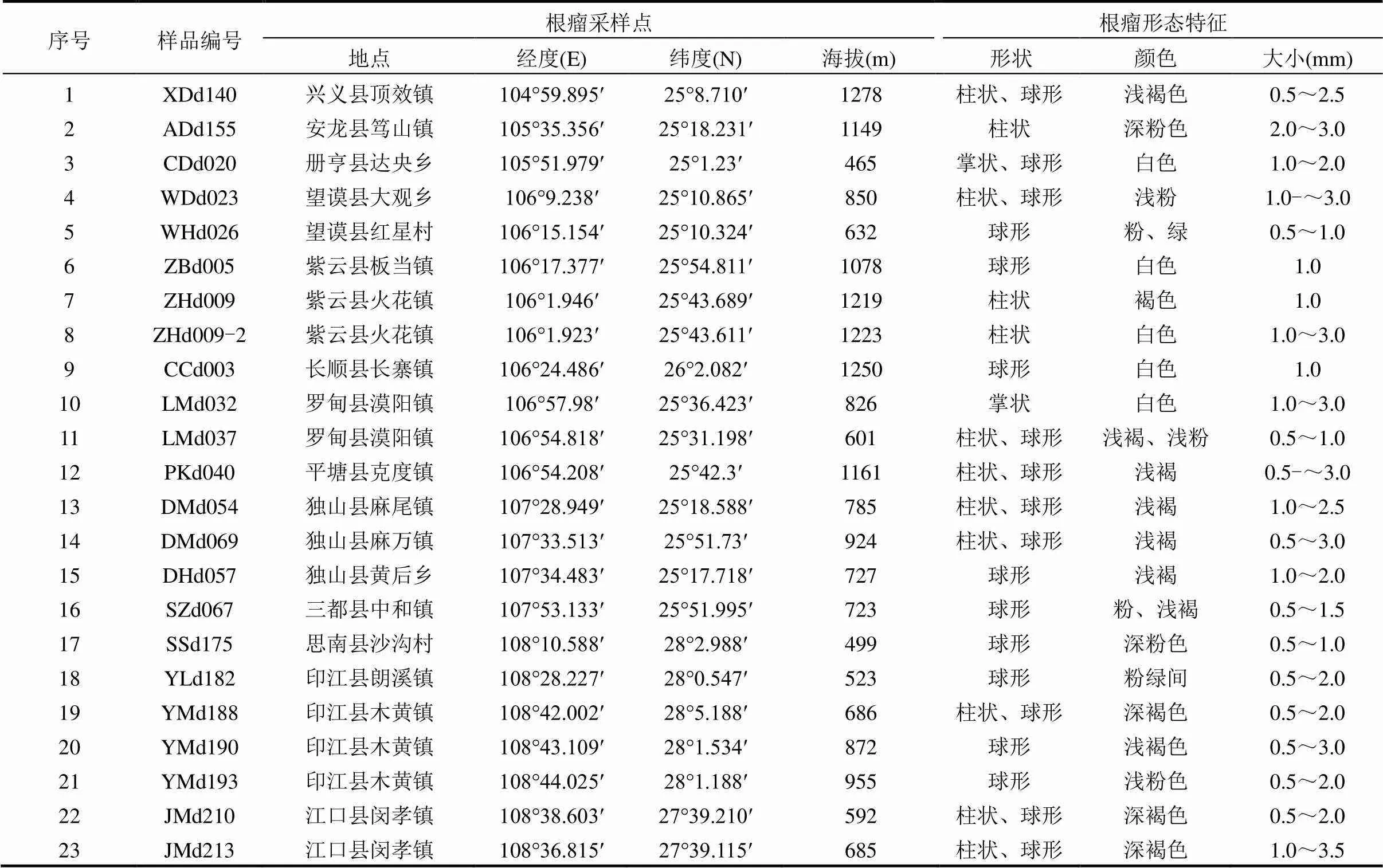
表1 野生多花木蓝根瘤形态特征
2.2 野生多花木蓝根瘤特征
本次所采集的多花木蓝的共生结瘤率只达50%,且根瘤全部着生于寄主的侧根及须根上,主根上无根瘤着生(图2).根瘤多为球形和柱状,少数为掌状;颜色呈浅/深褐色、浅/深粉色、白色等;大小可达0.5~3.0mm(表1).
Andrews等[24]研究显示,一年生豆科植物根瘤主要着生在主根及侧根上部;多年生豆科植物根瘤一般着生在侧根或须根,但少数种的粗壮主根上也会着生白色或粉红色幼瘤.本研究中野生多花木蓝为多年生植物,结果也显示,根瘤都着生于侧根及须根上.根瘤形状与寄主植物有很大关系[15].本研究中根瘤多为球形和柱状,少数为掌状.可能因为野生多花木蓝作为寄主缺乏永久分生组织,也就是缺乏感染线或感染线分布不广.由于豆血红蛋白的存在,具有固氮活性的有效根瘤断切面呈粉红色[16].本研究中的根瘤资源主要为浅/深褐色、浅/深粉色、白色.
2.3 根瘤菌株及内生细菌的分离纯化
从采集的23份野生多花木蓝的根瘤样品中分离得到28个纯化菌株.所得菌落表面光滑、湿润,呈圆形、中间隆起(图3).

图3 分离纯化的菌落
2.4 根瘤菌株及内生细菌的分子鉴定
通过PCR反应,所有待测菌株均扩增出了约1.5kb的序列片段(图4).测定序列与NCBI中Blast和已知物种的16S rDNA序列比对得出, 28个菌株中,有根瘤菌12株(表2),内生细菌16株(表3).

12株根瘤菌来自于长顺县、册亨县、望谟县、罗甸县、独山县、三都县(表2).除长顺县外,其他根瘤菌来源地均处于南部干热河谷南亚热带季雨林生态区(图1).
16株根瘤内生细菌来自于紫云县、罗甸县、平塘县、独山县、三都县、印江县、江口县(表3).大部分根瘤内生细菌来源地处于南部干热河谷南亚热带季雨林生态区(图1).
根瘤菌—豆科植物建立的共生关系有多重因子的复杂性,环境对根瘤菌能否结合共生有重要影响[25].每种植物都有一定的生态适应范围,环境影响豆科植物—根瘤菌共生结瘤可能性和稳定性[26].本研究中分离鉴定出的根瘤菌和根瘤内生细菌也主要在分布在特定区域,也说明生态地理环境影响野生多花木兰的结瘤能力.宿主植物要适应环境压力,与其结瘤的根瘤菌要面临宿主和环境的选择,导致菌株呈现区域差异.
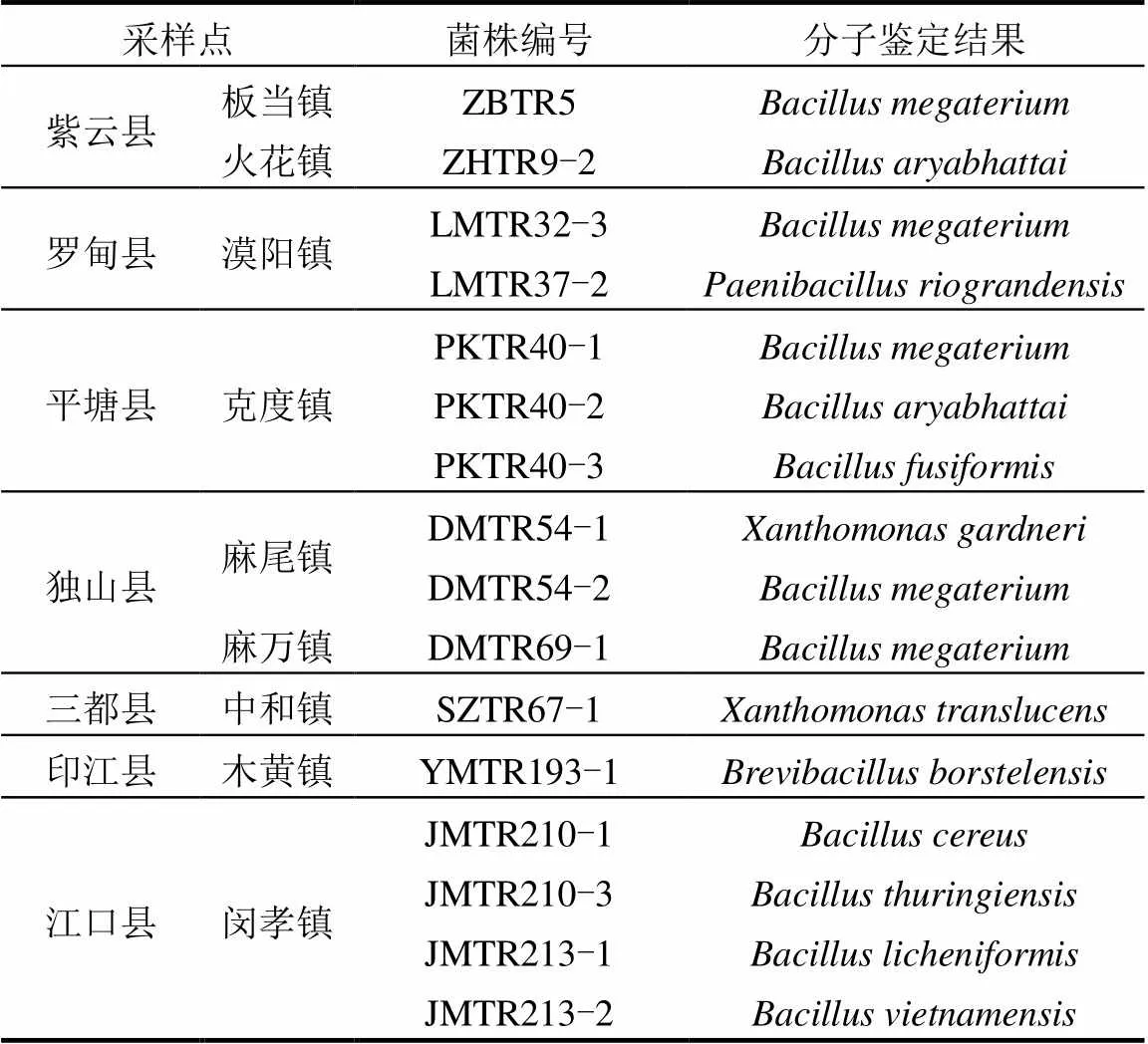
表2 野生多花木蓝根瘤菌株分子鉴定结果
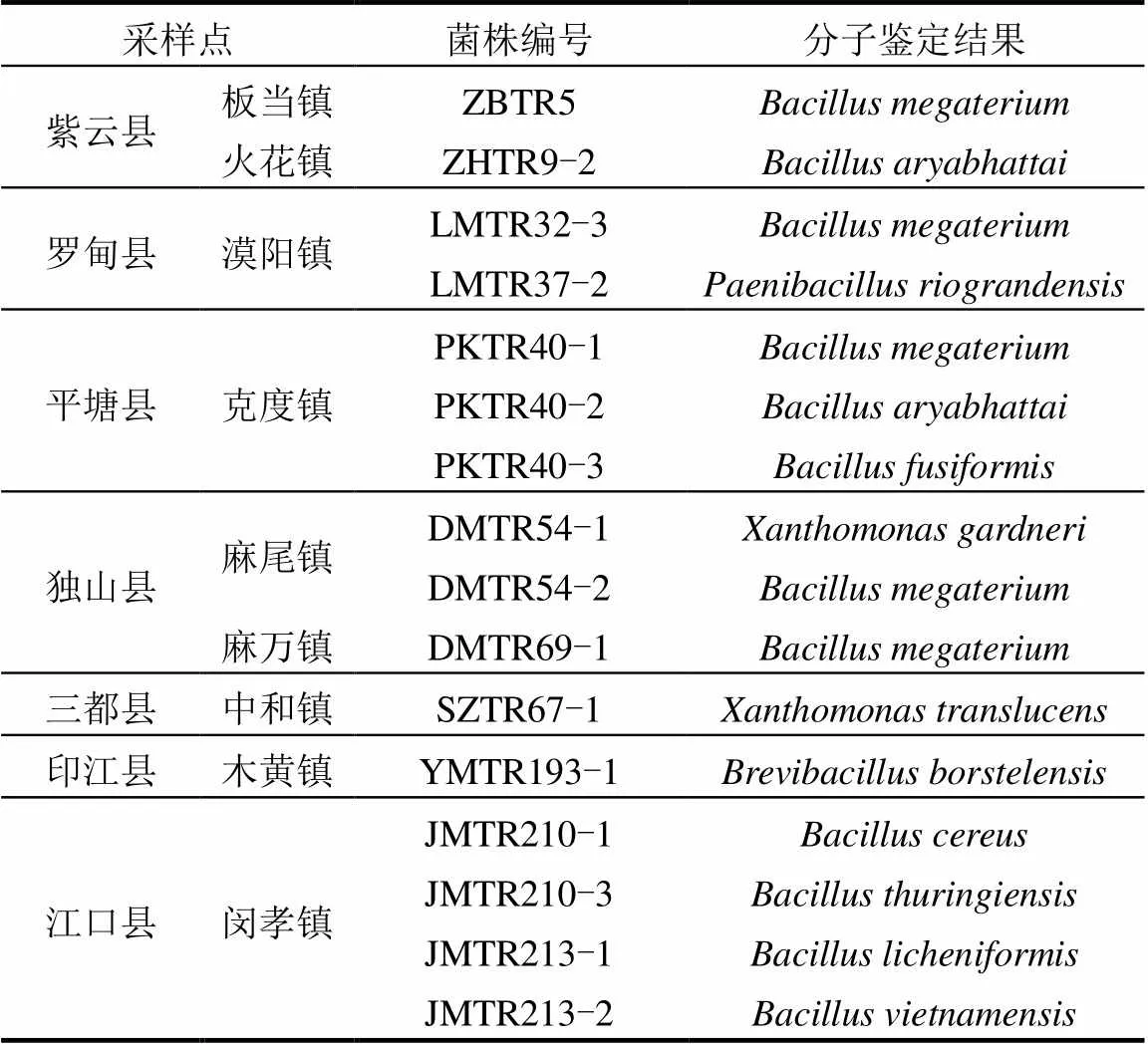
表3 野生多花木蓝根瘤内生细菌分子鉴定结果
2.5 根瘤菌株及内生细菌的区系分析
12株根瘤菌分布在6个属10个种(表4).慢生根瘤菌属()4个、根瘤菌属()2个、伯克霍尔德菌属()1个、中慢生根瘤菌属()1个、肠杆菌属()1个、土壤杆菌属()1个.慢生根瘤菌属的分布频率最高41.67%,其次是根瘤菌属和伯克霍尔德菌属为16.67%,其他的分布频率都是8.33%.
与根瘤菌共生固氮是豆科植物的显著特点.根瘤菌属于细菌域变形杆菌门[27].本研究分离鉴定的根瘤菌分布在6个属12个种,其中慢生根瘤菌属、根瘤菌属、中慢生根瘤菌属属于-变形杆菌纲,伯克霍尔德菌属属于-变形杆菌纲.慢生根瘤菌属分布频率最高,是优势种群.

表4 野生多花木蓝根瘤菌区系分析
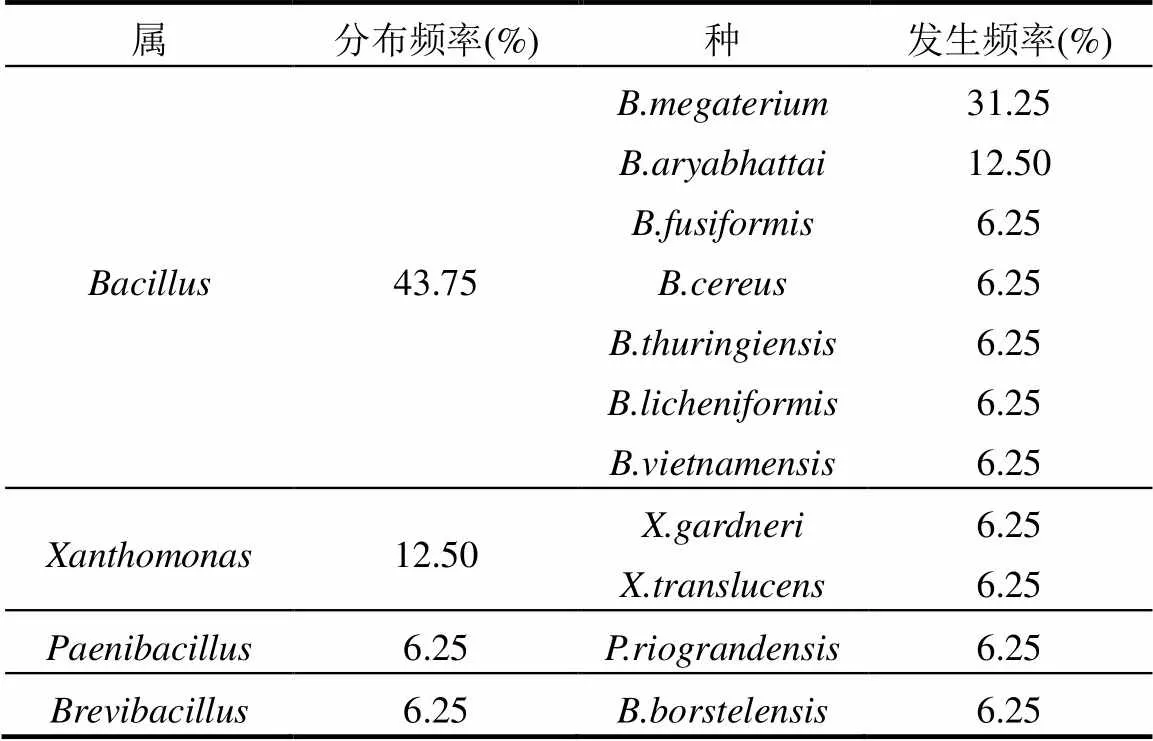
表5 多花木蓝根瘤内生细菌区系分析
16株根瘤内生细菌分布在4个属11个种(表5).芽孢杆菌属()7个、黄单胞菌属()1个、类芽胞杆菌属()1个、短芽孢杆菌属()1个.芽孢杆菌属的分布频率最高43.75%,黄单胞菌属的次之为12.50%,其他的均为6.25%.其中芽孢杆菌属的和的发生频率分别为31.25%和12.50%,其他种的发生频率均为6.25%.
除了与根瘤菌共生外,豆科植物还可以与其他微生物形成多种相互关系;在根瘤内,也存在其他类群的内生细菌[28-29].内生细菌可以促进植物生长,提高产出,担当生物控制因子[30].内生细菌的形态、种类以及生物学作用也是丰富多样[31].种类上占较大优势的主要是假单胞菌属、芽胞杆菌属、肠杆菌属和土壤杆菌属[32].本研究分离鉴定的根瘤内生细菌分布在4个属11个种,其中芽孢杆菌属的分布频率最高,芽孢杆菌属的发生频率最高.
3 结论
3.1 贵州境内隶属于南部干热河谷南亚热带季雨林生态区的野生多花木蓝根瘤菌及内生细菌资源较为丰富.
3.2 从贵州石漠化地区野生多花木蓝根分离鉴定的根瘤菌分布在6个属(、、、、、)10个种(、、、、、、、、、).
3.2 从贵州石漠化地区野生多花木蓝根分离鉴定的根瘤内生细菌分布在4个属(、、、)11个种(、、、、、、、、、、).
[1] 刘涛泽,刘丛强,张 伟,等.喀斯特地区坡地土壤可溶性有机碳的分布特征[J]. 中国环境科学, 2009,29(3):248-253. Liu T Z, Liu C Q, Zhang W, et al. Concentrations and migration features of dissolved organic carbon in the soils of slope lands in Karst area [J]. China Environmental Science, 2009,29(3):248-253.
[2] 文克俭,罗天琼,龙忠富,等.基于生态治理的豆科灌木品种筛选研究[J]. 草业与畜牧, 2017,(4):28-30. Wen K J, Luo T Q, Long Z F, et al. Study on the selection ofvarieties based on ecological management [J]. Prataculture & Animal Husbandry, 2017,(4):28-30.
[3] Werner G, Cornwell W, Cornelissen J, et al. Evolutionary signals of symbiotic persistence in the legume-rhizobia mutualism [J]. Proceedings of the National Academy of Sciences, 2015,112(33): 10262-10269.
[4] 陈利云,张海林,周志宇.生物与非生物因素对共生固氮的影响[J]. 草业科学, 2010,27(6):64-70.Chen L Y, Zhang H L, Zhou Z Y. Effect of biotic and abiotic factors on symbiotic nitrogen fixation [J]. Prataculture Science, 2010,27(6):64-70.
[5] Haichar F, Santaella C, Heulin T, et al. Root exudates mediated interactions belowground [J]. Soil Biology & Biochemistry, 2014, 77(7):69-80.
[6] Yan J, Han X Z, Ji Z J, et al. Abundance and diversity of soybean- nodulating rhizobia in black soil are impacted by land use and crop management [J]. Applied and Environmental Microbiology, 2014, 80(17):5394-5402.
[7] Mhamdi R, Nouairi I, Ben Hammouda T, et al. Growth capacity and biochemical mechanisms involved in rhizobia tolerance to salinity and water deficit [J]. Journal of basic Microbiology, 2015,55(4):51-61.
[8] 唐明灯,艾绍英,李盟军,等.紫云英对污染土壤上叶菜生长及其镉和铅含量的影响[J]. 中国环境科学, 2011,31(3):461-465. Tang M D, Ai S Y, Li M J, et al. Effect of Astragalus sinicus on the growth, Cd and Pb concentration of leafy vegetables [J]. China Environmental Science, 2011,31(3):461-465.
[9] Chen J Y, Gu J, Wang E T, et al. Wild peanutare nodulated by diverse and novelspecies in acid soils [J]. Systematic and Applied Microbiology, 2014,37(7):525-532.
[10] Ferguson B J, Mathesius U. Phytohormone regulation of legume- rhizobia interactions [J]. Journal of Chemical Ecology, 2014,40(7): 770-790.
[11] Li J, Wang E, Chen W, et al. Genetic diversity and potential for promotion of plant growth detected in nodule endophytic bacteria of soybean grown in Heilongjiang province of China [J]. Soil Biology & Biochemistry, 2008,40(1):238-246.
[12] Trujillo M, Riesco R, Benito P, et al. Endophytic actinobacteria and the interaction of micromonospora and nitrogen fixing plants [J]. Frontiers in Microbiology, 2015,(6):1341.
[13] 李艳梅,钟宇舟,谭 渊,等.四川地区结瘤大豆根际土壤中紫云英、苜蓿和三叶草根瘤菌的多样性分析[J]. 应用与环境生物学报, 2015,21(2):234-241. Li Y M, Zhong Y Z, Tan Y, et al. Diversity of rhizobia nodulating,andin nodulated soybean rhizosphere soil in Sichuan [J]. Chinese Journal of Applied & Environmental Biology, 2015,21(2):234-241.
[14] Kimeklis A, Kuznetsova G, Sazanova A, et al. Divergent evolution of symbiotic bacteria: rhizobia of the relic legume vavilovia formosa form an isolated group within rhizobiumViciae [J]. Russian Journal of Genetics, 2018,54(7):866-870.
[15] 王卫卫,胡正海,关桂兰.甘肃、宁夏部分地区根瘤菌资源及其共生固氮特性[J]. 自然资源学报, 2002,17(1):48-54.Wang W W, Hu Z H, Guan G L. The characteristics related to symbiotic nitrogen fixation and rhizobium resources in some areas of Gansu and Ningxia [J]. Journal of Natural Resources, 2002,17(1):48-54.
[16] 谢瑞美.陕西省木蓝属根瘤菌遗传多样性研究[D]. 杨凌:西北农林科技大学, 2009. Xie R M. Diversity of rhizobia isolated fromin Shaan Xi of China [D]. Yangling: Northwest A&F University, 2009.
[17] 刘 杰,汪恩涛,陈文新.豆科植物根瘤内生细菌的发现及其研究进展[J]. 微生物学报, 2011,51(8):1001-1006. Liu J, Wang E T, Chen W X. Discovery and research progress of endophytic bacteria in the root nodules of legumes——A review [J]. Acta Microbiologica Sinica, 2011,51(8):1001-1006.
[18] 邱并生.根瘤内生细菌[J]. 微生物学通报, 2013,40(3):544. Qiu B S. Nodule endophytic bacteria [J]. Microbiology China, 2013, 40(3):544.
[19] 贵州省人民政府.省人民政府关于贵州省生态功能区划的批复[N]. 贵州省人民政府公报, 2005-05-10. Guizhou Provincial People's Government. Provincial People's Government's approval of ecological function regionalization in Guizhou province [N]. Official Gazette of Guizhou Provincial People's Government, 2005-05-10.
[20] 韦兴迪,曾庆飞,谭玉兰,等.贵州部分地区野生白三叶根瘤菌资源调查与区系分析[J]. 作物杂志, 2018,(2):35-43. Wei X D, Zeng Q F, Tan Y L, et al. Investigation and floristic analysis on rhizobial resources ofin some regions of Guizhou province [J]. Crops, 2018,(2):35-43.
[21] Afkhami M, Luke M, Burns J, et al. Symbioses with nitrogen-fixing bacteria: nodulation and phylogenetic data across legume genera [J]. Ecology, 2018,99(2):502.
[22] Allen O, Allen E. The Leguminosae: A source book of characteristics, uses and nodulation [J]. Economic Botany, 1982,36(2):224.
[23] Powell A, Doyle J. Enhanced rhizobial symbiotic capacity in an allopolyploid species of glycine (leguminosae) [J]. American Journal of Botany, 2016,103(10):1771.
[24] Andrews M, Andrews M. Specificity in legume-rhizobia symbioses [J]. International Journal of Molecular Sciences, 2017,18(4):1-39.
[25] 张敬宜,王金华,思 斯.根瘤菌对石漠化生态系统三叶草生长的影响研究[J]. 安徽农学通报, 2014,20(7):15-16. Zhang J Y, Wang J H, Si S. Effects of rhizobium on the growth of clover in rocky desertification ecosystem [J]. Anhui Agricultural Science Bulletin, 2014,20(7):15-16.
[26] 熊惠洋.蚕豆土著根瘤菌的生物地理分布及其形成机制[D]. 北京:中国农业大学, 2017. Xiong H Y. The biogeography of indigenous rhizobia associated with faba bean and its underlying formation mechanism [D]. Beijing: China Agricultural University, 2017.
[27] Huys G, Coopman R, Janssen P, et al. High-resolution genotypic analysis of the genus Aeromonas by AFLP fingerprinting [J]. International Journal of Systematic Bacteriology, 1996,46(2):572.
[28] Li L, Sinkko H, Montonen L, et al. Biogeography of symbiotic and other endophytic bacteria, isolated from medicinal glycyrrhiza species in china [J]. FEMS Microbiology Ecology, 2012,79(1):46-68.
[29] 钟宇舟,余秀梅,陈 强,等.四川盆地大豆根瘤内生细菌的分离鉴定及促生效果[J]. 应用与环境生物学报, 2017,(1):46-53. Zhong Y Z, Yu X M, Cheng Q, et al. Isolation, identification and plant growth promotion ability evaluation of the endophytic bacteria isolated from soybean root nodule in Sichuan Basin [J]. Chinese Journal of Applied & Environmental Biology, 2017,(1):46-53.
[30] Forchetti G, Masciarelli O, Alemano S, et al. Endophytic bacteria in sunflower (L.): isolation, characterization, and production of jasmonates and abscisic acid in culture medium [J]. Applied Microbiology & Biotechnology, 2007,76(5):1145-1152.
[31] Rangeshwaran R, Raj J, Kumar P. Identification of endophytic bacteria in chickpea (L.) and their effect on plant growth [J]. Journal of Biological Control, 2008,22(1):13-23.
[32] Chen T, Chen Z, Ma G, et al. Diversity and potential application of endophytic bacteria in ginger [J]. Genetics & Molecular Research, 2014,13(3):4918-4931.
Investigation and analysis of root nodule resources of wildin rocky desertification areas.
XI Yi1, ZHAO Li-li1, WANG Xiao-li2, ZENG Qing-fei2, CHEN Chao1*
(1.College of Animal Science, Guizhou University, Guiyang 550025, China;2.Guizhou Institute of Pratacultural, Guiyang 550006, China)., 2019,39(10):4409~4415
In order to give full play to the role of leguminous plants in ecological restoration and reconstruction, the root nodule resources of wildin the rocky desertification region of Guizhou province were investigated. The results showed that the resources of rhizobia and endophytic bacteria of wildwere abundant in southern subtropical seasonal rain forest ecological zone in the dry and hot valley; the symbiotic nodulation rate of wildwas only about 50%, and all the nodules were on the lateral roots and fibrous roots of the host, 0.5~3.0mm in size; 12 rhizobia strains were distributed in 10 species of 6 genera, of which the distribution frequency ofwas the highest in frequency 41.67%, and the frequencies of occurrence ofofandofwere the highest in frequency 16.67%; 16 endophytic bacteria strains were distributed in 11 species of 4 genera, of which the distribution frequency ofwas the highest in frequency 43.75%, and the frequency of occurrence ofofwas the highest in frequency 31.25%.
rocky desertification;;rhizobia;endophytic bacteria;flora analysis
X176
A
1000-6923(2019)10-4409-07
席 溢(1987-),女,贵州安顺人,副教授,博士,主要从事植物生理生态学研究.发表论文10余篇.
2019-03-19
贵州省科技重大专项计划(黔科合重大专项字[2016]3002号);国家自然科学基金资助项目(31560664);贵州省科技合作计划(黔科合LH字[2016]7450号)
* 责任作者, 教授, gzgyxgc3855218@163.com

