三聚氰胺致猫慢性肾衰模型的建立
李嫣然,左之才,黄方园
(四川农业大学动物医学院/动物疫病与人类健康四川省重点实验室,成都 611130)
猫慢性肾功能衰竭(chronic renal failure,CRF)是由原发或继发肾脏病引起,导致承担肾功能的肾单位绝对数减少70%以上,由此产生的各种临床症状和代谢紊乱所组成的症候群,其对肾脏损害具有渐进性、不可逆性[1-2]。据统计,慢性肾功能衰竭为猫最大的肾脏疾病,是导致猫死亡的第二大因素,10岁以上的猫患慢性肾衰比例约45%,且临床雄猫、雌猫发病比率接近1.06∶1,无明显性别差异[3]。引起猫CRF 的原因很多,一般认为其与年龄、遗传因素、饮食、环境和肾脏疾病有关,也可由急性肾功能衰竭转化而来[4-5]。目前,由于猫CRF 的发病机制复杂,其病因不明。加之国内相关研究较少,临床上基本没有特效治疗药物,仅能通过食物疗法以及适当的对症治疗来减轻肾脏的负担[6-8],故探寻一种适合于猫的CRF 动物模型很有必要。
自2007年“美国宠物毒粮事件”[9]以来,三聚氰胺因其高含氮量被非法商贩作为添加剂以提高猫粮中蛋白质检测数值,导致临床上大量宠物猫因三聚氰胺中毒致肾衰死亡,引起各界广泛关注。研究表明,三聚氰胺本身无毒或微毒[10-11],但当三聚氰胺与其同系物混合时,形成的三聚氰胺-三聚氰酸盐在尿中溶解度低,造成结石损伤肾脏,引起肾衰,而对其他组织器官毒害作用小[12]。故本试验根据猫的生理代谢特性和三聚氰胺对猫肾脏毒害作用,建立猫慢性肾衰竭模型,为研究猫CRF 发病机理,筛选有效药物,阐明疗效机制提供有效模型基础。
1 材料和方法
1.1 试验材料
1.1.1 试验动物
取2~4 周岁健康成年猫30 只(雅安市某流浪猫中心),雌雄不限,体重 2~4.5 kg,适应性饲养 3~5 d。
1.1.2 试验试剂及仪器
材料:三聚氰胺(纯度>99%)(购自国药集团化学试剂有限公司,批号:20170306)、三聚氰酸(纯度>98%)(购自国药集团化学试剂有限公司,批号:20160203)。
仪器:自动干式生化分析仪(爱科来医疗电子有限公司,型号:SP-4430)、全自动血细胞分析仪(深圳市普康电子有限公司,型号:PE-6800VET)、尿液分析仪(爱科来医疗科技有限公司,型号:RT-4010)。
1.2 试验方法
1.2.1 试验动物分组
将30 只健康试验猫随机分为4 组(见表1),设高剂量组(Ⅰ组,n=8)、中剂量组(Ⅱ组,n=8)、低剂量组(Ⅲ组,n=8)和空白对照组(Ⅳ组,n=6)饲喂三聚氰胺与三聚氰酸1∶1 混合物。试验组饲喂:将上述两种试剂等比混合物按上述剂量用少量食用油溶解,掺入少量猫粮饲喂后,按正常猫食量添加猫粮和清洁饮用水,连续21 d,后再按1 次/两日饲喂14 d(7次);试验期间空白对照组饲喂相同猫粮,各组不限饮水;同条件环境下饲养(分组见表1)。

表1 试验猫分组给药Table 1 Grouping of experimental cats mg·kg-1
1.2.2 动物基本情况观察
造模期间,定时观察并记录各组试验猫行为变化、生长情况、死亡情况、尿量变化等,直至试验结束。
1.2.3 血液生理生化检查
于 0、22、36 d 对各组活体用 5 mL 的真空采血管通过前肢静脉(采血前12 h 不喂食)采集血液2.5 mL,其中0.5 mL 血液加入抗凝管中;检测血肌酐(CRE)、尿素氮(BUN)、红细胞计数(RBC)、红细胞压积(HCT)等指标。
1.2.4 尿常规检查
于0、22、36 d 通过膀胱穿刺法采集各组活体尿液1 mL,用尿液分析仪检测尿比重(SG)、蛋白质(PRO)等指标。
1.2.5 病理组织切片制作及观察
造模期间,对死亡猫及时进行解剖观察,采集病理组织(肾脏)制作病理组织切片,进行固定、石蜡包埋、切片、HE 染色、光镜病理组织学检查。
1.2.6 猫慢性肾衰模型建立的标准
参考国际肾脏权益组织(IRIS)猫慢性肾衰分级标准[13],试验将血清肌酐浓度作为判断猫肾衰程度的指标。当临床表现多尿,轻度脱水、贫血,检测肌酐浓度为 140~250 μmol/L,判定为轻度肾衰(失代偿);临床表现少尿,中度或重度贫血,酸中毒,肌酐浓度 250~440 μmol/L,判定为中度肾衰(氮质血症);临床表现无尿,明显嗜睡、尿中毒症状,肌酐浓度大于440 μmol/L,判定为重度肾衰(尿毒症)。
1.3 数据处理
采用Excel 软件和SPSS22.0 软件对各试验数据进行统计分析,数据以均数±标准差(±SD)的形式表示,P<0.05 为差异显著,具有统计学意义。
2 结果与分析
2.1 三聚氰胺与三聚氰酸对猫临床症状表现的影响
高剂量组猫于14 d 出现多饮多尿,食欲下降;20 d 时,多数猫的精神沉郁,少尿,活动减少,蜷缩成一团;28 d 时,其中两只猫出现食欲废绝,口臭,被毛粗乱,消瘦,严重脱水,精神高度沉郁,黏膜苍白,并分别在 30、32 d 死亡,其他猫在 33~34 d 表现精神萎靡,被毛粗乱,消瘦,脱水。中剂量组猫在造模前期基本无明显临床变化,在23 d 出现明显多饮多尿,食欲下降,精神沉郁(活动量减少),轻度脱水至中度脱水,黏膜苍白、贫血,消瘦等症状。低剂量组猫在32 d 前的精神、食欲和行为无明显变化,在32 d后出现轻微多饮多尿。对照组无任何临床症状。
2.2 三聚氰胺与三聚氰酸对猫体重的影响
试验 0 d,各组体重差异不显著(P>0.05);22 d,Ⅰ组猫体重显著低于Ⅳ组(P<0.05);36 d,Ⅰ、Ⅱ、Ⅲ组体重显著低于Ⅳ组(P<0.05)。Ⅰ、Ⅱ、Ⅲ组猫体重在22、36 d 均有所下降,但差异均不显著(P>0.05),Ⅳ组猫体重略有上升(P>0.05)(见表2)。本试验结果显示,三聚氰胺与三聚氰酸可引起猫体重下降。
2.3 三聚氰胺与三聚氰酸对猫血清肾功能指标的影响
试验0 d,各组猫的血肌酐差异不显著(P>0.05);22 d 时,Ⅰ组猫血肌酐含量显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05);36 d 时,Ⅰ、Ⅱ、Ⅲ组猫血肌酐含量显著高于Ⅳ组(P<0.05),且随药物剂量增大升高越显著。组内不同时间相比较,Ⅰ组猫22、36 d 的血肌酐含量显著高于0 d(P<0.05);Ⅱ组、Ⅲ组猫血肌酐含量于0、22、36 d 随时间增加而显著升高(P<0.05);Ⅳ组猫血肌酐含量随时间无显著变化(P>0.05)(见表3)。可见,猫血肌酐含量可随喂三聚氰胺、三聚氰酸时间的增加而升高,且随剂量的增大而升高更显著。
试验0d,各组猫尿素氮含量无显著差异(P>0.05);造模22 d 时,Ⅰ组、Ⅱ组猫尿素氮显著高于Ⅳ组(P<0.05),Ⅲ组与Ⅳ组猫尿素氮含量无显著差异(P>0.05);36 d,Ⅰ、Ⅱ、Ⅲ组猫尿素氮含量均显著高于Ⅳ组(P<0.05),其中,Ⅰ组与Ⅱ组无显著差异(P>0.05)。组内不同时间相比较,Ⅰ、Ⅱ、Ⅲ组猫于22、36 d 的尿素氮含量均显著高于0 d(P<0.05),且随时间增加而升高(见表3)。猫尿素氮随喂三聚氰胺、三聚氰酸时间的增加可显著升高,且与剂量正相关。
综上结果,三聚氰胺与三聚氰酸对猫血清肌酐、尿素氮的影响变化趋势是随着剂量的增加和饲喂时间的延长而显著升高。
表2 三聚氰胺及三聚氰酸致猫CRF 模型体重比较(±SD)Table 2 Weight comparison of cat CRF models Induced by mlamine and cyanuric acid(±SD) kg
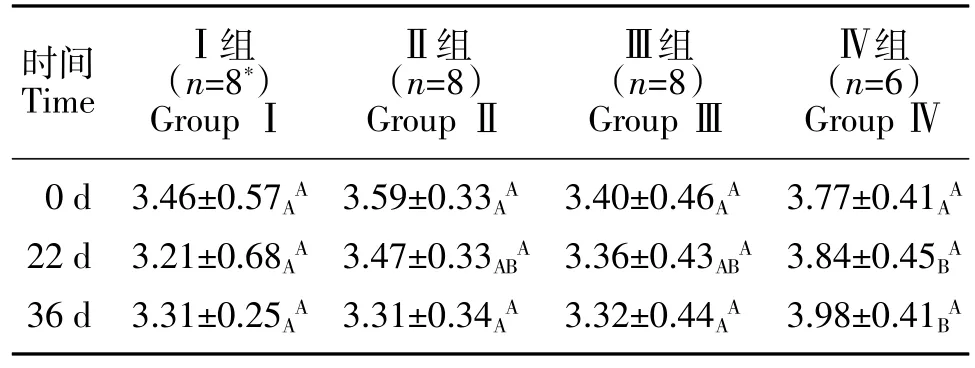
表2 三聚氰胺及三聚氰酸致猫CRF 模型体重比较(±SD)Table 2 Weight comparison of cat CRF models Induced by mlamine and cyanuric acid(±SD) kg
注:*Ⅰ组猫于 30 d、32 d 死亡两只,故 36 d 时 n=6;标有不同大写字母的数据之间差异显著(P<0.05),右下标表示同时间点组间相比,右上标表示组内不同时间点相比。下表同。Note:*Because the two cats in group Ⅰ died on 30 d and 32 d,there were 6 cats lef on 36 d;Data with different capital letters differ significantly(P<0.05),the right subscript represents the comparison between groups of time points,and the right superscript represents the comparison between groups of different time points.The same as below.
时间TimeⅠ组(n=8*)Group ⅠⅡ组(n=8)Group ⅡⅢ组(n=8)Group ⅢⅣ组(n=6)Group Ⅳ3.77±0.41AA 3.84±0.45BA 3.98±0.41BA 0 d 22 d 36 d 3.46±0.57AA 3.21±0.68AA 3.31±0.25AA 3.59±0.33AA 3.47±0.33ABA 3.31±0.34AA 3.40±0.46AA 3.36±0.43ABA 3.32±0.44AA
2.4 三聚氰胺与三聚氰酸对猫血液生理指标的影响
试验0 d,各组猫RBC 处于正常范围,无显著差异(P>0.05);22 d,Ⅱ组猫 RBC 显著低于Ⅳ组(P<0.05),Ⅰ组、Ⅲ组与Ⅳ组无显著差异(P>0.05);36 d,Ⅰ组、Ⅱ组猫RBC 显著低于Ⅲ组与Ⅳ组(P<0.05)。Ⅰ组、Ⅱ组猫于 36 d 的 RBC 显著低于 0 d(P<0.05),Ⅲ组与Ⅳ组0、22、36 d 随时间变化无显著差异(P>0.05)。Ⅰ组、Ⅱ组猫RBC 随时间不断降低,而Ⅲ组并未降低。表明猫RBC 随三聚氰胺、三聚氰酸剂量的加大而降低(见表4)。
0 d 时,各组猫 HCT 差异不显著(P>0.05);22 d,Ⅰ组显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05);36 d,Ⅰ组、Ⅱ组均显著高于Ⅲ组、Ⅳ组(P<0.05)。Ⅰ组猫22、36 d的 HCT 显著高于 0 d(P<0.05),Ⅱ组于 36 d 时显著高于 0、22 d(P<0.05);Ⅲ组、Ⅳ组猫 0、22、36 d 各时间点的 HCT 无显著差异(P>0.05)。可知,Ⅰ组、Ⅱ组HCT 均随时间显著升高,并超出正常范围(见表4)。
由此可见,猫RBC 的降低与HCT 的升高均需要三聚氰胺与三聚氰酸达到一定剂量水平的刺激,才会发生,且剂量越大,其RBC 下降、HCT 升高越显著。
2.5 三聚氰胺与三聚氰酸对猫尿生化指标的影响
0 d 时,Ⅰ、Ⅱ、Ⅲ组尿比重与Ⅳ组无显著差异(P>0.05),22 d,Ⅰ组、Ⅱ组尿比重水平显著低于Ⅲ组、Ⅳ组(P<0.05),36 d,Ⅰ、Ⅱ、Ⅲ组尿比重均显著低于Ⅳ组(P<0.05)。相比 0 d,Ⅰ、Ⅱ、Ⅲ组 36 d 时尿比重均显著下降(P<0.05),且Ⅰ组、Ⅱ组相比Ⅲ组下降更迅速。可知尿比重的变化,除Ⅰ组先下降后稍升高外,Ⅱ组、Ⅲ组均随时间持续下降(见表5)。
0 d 时,各组猫尿蛋白含量无显著差异(P>0.05);22 d,Ⅰ组、Ⅱ组尿蛋白显著高于Ⅲ组、Ⅳ组(P<0.05),且Ⅰ组显著高于Ⅱ组(P<0.05);36 d,Ⅰ、Ⅱ、Ⅲ组尿蛋白显著高于Ⅳ组(P<0.05)。Ⅰ组、Ⅱ组 22 d、36 d 尿蛋白含量显著高于 0 d(P<0.05),Ⅲ组 36 d 尿蛋白显著高于 0、22 d(P<0.05),Ⅳ组无变化(P>0.05)。Ⅰ组尿蛋白升高迅速,之后稍有下降,而Ⅱ组、Ⅲ组随时间持续稳定上升(见表5)。
表3 三聚氰胺与三聚氰酸致猫CRF 模型血清肾功能指标比较(±SD)Table 3 Comparison of serum renal function indexes of cat CRF model induced by melamine and cyanuric acid(±SD)
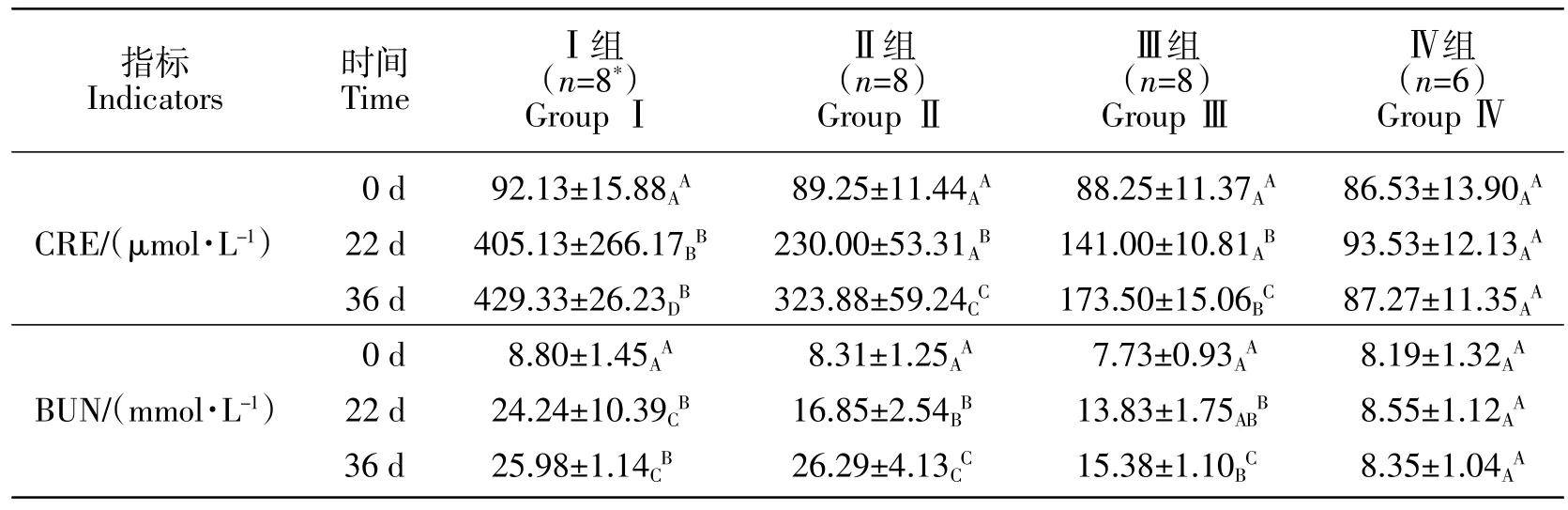
表3 三聚氰胺与三聚氰酸致猫CRF 模型血清肾功能指标比较(±SD)Table 3 Comparison of serum renal function indexes of cat CRF model induced by melamine and cyanuric acid(±SD)
指标Indicators时间TimeⅠ组(n=8*)Group ⅠⅡ组(n=8)Group ⅡⅢ组(n=8)Group ⅢⅣ组(n=6)Group ⅣCRE/(μmol·L-1)BUN/(mmol·L-1)0 d 22 d 36 d 0 d 22 d 36 d 92.13±15.88AA 405.13±266.17BB 429.33±26.23DB 8.80±1.45AA 24.24±10.39CB 25.98±1.14CB 89.25±11.44AA 230.00±53.31AB 323.88±59.24CC 8.31±1.25AA 16.85±2.54BB 26.29±4.13CC 88.25±11.37AA 141.00±10.81AB 173.50±15.06BC 7.73±0.93AA 13.83±1.75ABB 15.38±1.10BC 86.53±13.90AA 93.53±12.13AA 87.27±11.35AA 8.19±1.32AA 8.55±1.12AA 8.35±1.04AA
表4 三聚氰胺与三聚氰酸致猫CRF 模型血生理指标比较(±SD)Table 4 Comparison of blood physiological indexes of cat CRF model induced by melamine and cyanuric acid(±SD)

表4 三聚氰胺与三聚氰酸致猫CRF 模型血生理指标比较(±SD)Table 4 Comparison of blood physiological indexes of cat CRF model induced by melamine and cyanuric acid(±SD)
指标Indicators时间TimeⅠ组(n=8*)Group ⅠⅡ组(n=8)Group ⅡⅢ组(n=8)Group ⅢⅣ组(n=6)Group ⅣRBC/(1012 个·L-1)HCT/%0 d 22 d 36 d 0 d 22 d 36 d 5.92±0.73AB 5.03±1.48ABB 3.80±0.46AA 32.9±4.5AA 46.0±13.7BB 54.8±7.2BB 5.62±0.64AB 4.80±0.40AA 4.26±0.54AA 31.3±2.6AA 32.1±10.5AA 51.1±6.9BB 5.54±0.46AA 5.42±0.77ABA 5.88±1.15BA 31.7±2.6AA 30.2±5.8AA 31.9±6.3AA 6.00±0.76AA 6.03±0.66BA 6.21±0.80BA 32.5±2.7AA 33.7±1.8AA 34.5±1.6AA
表5 三聚氰胺与三聚氰酸致猫CRF 模型尿生化指标比较(±SD)Table 5 Comparison of urinary biochemical indices of cat CRF model induced by melamine and cyanuric acid(±SD)

表5 三聚氰胺与三聚氰酸致猫CRF 模型尿生化指标比较(±SD)Table 5 Comparison of urinary biochemical indices of cat CRF model induced by melamine and cyanuric acid(±SD)
指标Indicators时间TimeⅠ组(n=8*)Group ⅠⅡ组(n=8)Group ⅡⅢ组(n=8)Group ⅢⅣ组(n=6)Group Ⅳ尿比重尿蛋白/(mg·dL-1)0 d 22 d 36 d 0 d 22 d 36 d 1.040±0.005BB 1.019±0.009AA 1.024±0.004BA 0.0±0.0AA 26.3±6.9CB 20.0±7.7BB 1.037±0.003ABB 1.018±0.006AA 1.017±0.004AA 0.0±0.0AA 15.0±11.3BB 16.9±12.5BB 1.035±0.003AC 1.031±0.003BB 1.022±0.004BA 0.0±0.0AA 5.6±7.8AA 18.8±6.9BB 1.037±0.002ABA 1.036±0.001BA 1.037±0.003CA 0.0±0.0AA 0.0±0.0AA 0.0±0.0AA
由此可见,三聚氰胺与三聚氰酸可引起猫尿比重下降、产生尿蛋白,且剂量越高其尿比重下降、尿蛋白升高越显著。
2.6 三聚氰胺与三聚氰酸建立猫慢性肾衰模型成功情况
试验结束时,参考国际肾脏权益组织(IRIS)猫慢性肾衰分级标准,判定Ⅰ组猫中度肾衰4 只(50%)、重度肾衰 2 只(25%)、死亡 2 只(25%),成功率 75%。Ⅱ组猫轻度肾衰1 只(12.5%)、中度肾衰7 只(87.5%),成功率100%。Ⅲ组猫轻度肾衰8 只(100%),成功率100%。Ⅳ组猫全为健康(100%)(见表6)。据表统计所知,三聚氰胺与三聚氰酸用量越大,对猫肾脏造成的损伤越严重,且易致死亡。

表6 三聚氰胺与三聚氰酸建立猫CRF 模型成功率Table 6 Success rate of establishing cat CRF model with melamine and cyanuric acid %

图1 高剂量组死亡猫肾脏病理学观察Figure 1 Histopathological observation of kidney of dead cats in high dose group
2.7 死亡猫病理组织学检查结果
高剂量组死亡猫剖检可见肾脏呈白色,稍肿大。组织病理学观察可见(图1A,B),肾脏组织被膜完整,略有增厚;肾脏结构呈弥漫凝固性坏死,肾小球肿大变性、球内血管袢结构破坏、系膜细胞以及足细胞溶解脱落、肾小囊内可见脱落的一些碎片组织和絮状或颗粒样物质。肾小管上皮细胞空泡变性、坏死,细胞脱落在管腔中央形成肾小管上皮细胞管型,管腔内可见蛋白样物质沉积,坏死周围部分管腔不规则弯曲变性,肾小管中未见晶体出现。
3 讨论与结论
猫慢性肾衰的发病率为9.6%,其中12 岁以上猫CRF 发病率为28%,15 岁以上猫发病率为30%[14]。猫慢性肾功能衰竭是指肾小球损伤,肾小球滤过率下降,肾代谢紊乱的综合征[15]。随着生活水平的提高,临床病例中老龄猫的比例显著升高,而肾衰竭是老龄猫临床多发的主要代谢疾病。在我国,10 岁以上患慢性肾衰的犬约有20%,而10 岁以上患病的猫则约有45%[16],其原因主要与猫的身体结构以及饮食习惯有关。猫单侧肾脏的肾单位是20 万,数量仅为犬的一半[17],当动物双侧肾单位功能丧失约75%时就会发生肾衰竭;且猫作为肉食性动物其日常所需蛋白含量是其他杂食性动物的4~5 倍,高蛋白饮食可增加肾功能负担,加重慢性肾衰的进程[18]。另有资料显示,2007年3月至今,已有4 000 多起猫、狗等宠物因三聚氰胺中毒而肾衰死亡的案例,对宠物行业造成巨大损失[19]。由于CRF 发病机制复杂,临床对于该病的治疗仅能通过保守疗法延缓肾衰的发展进程。因此建立猫慢性肾衰模型,对研究猫CRF 发病机理,筛选有效药物,阐明疗效机制有重要作用。
目前,肾大部切除法和0.75%腺嘌呤饮食是建立慢性肾衰模型常用的两种方法。肾大部切除法普遍需要较强的技术性,并且周期长,手术标准化不高,模型动物易出现应激、厌食和死亡率高等缺点[20];0.75%腺嘌呤饮食受药物剂量、用药周期和动物类别差异影响较大,导致对肾脏损害程度不好把握,同时又会对其他组织器官产生较强毒性[21]。故本研究采用三聚氰胺与三聚氰酸混合饲喂的方式建立猫慢性肾衰模型。据报道,猫大量或长期摄入一定剂量的三聚氰胺会产生肾结石,引起肾功能衰竭,且三聚氰胺主要对泌尿系统尤其是肾脏造成损害,而对其他组织器官毒害作用小[11,22]。如R.E.Cianciolo等对2007年死于三聚氰胺污染的猫剖检发现,三聚氰胺主要对肾造成损害,肾组织病理检查见肾小管坏死伴增生,管内有大量结晶以及肾间质纤维化和炎性细胞浸润[23]。在本试验中,死亡猫组织病理学观察可见肾小球肿大变性,肾小管形成上皮细胞管型,管内蛋白质沉积,管腔不规则弯曲变性,而肾小管内未见有结晶出现,与李翠枝等[24]的结果较一致,分析其原因可能是肾脏中三聚氰胺浓度尚不足以形成可见晶体沉积于肾小管。
本研究采用高(20 mg/kg)、中(10 mg/kg)、低(5 mg/kg)剂量的三聚氰胺与三聚氰酸混合物饲喂猫5 周后,造模组猫血肌酐、尿素氮升高,红细胞下降、红细胞压积升高,尿比重下降、尿蛋白升高;临床表现为被毛粗乱、多饮多尿、后少尿、精神食欲下降、逐渐消瘦、贫血脱水、口臭等症状,与临床猫CRF 相关研究表现一致[1]。目前建立慢性肾衰动物模型的关键是损伤肾脏并持续发展恶化,同时保证较低的死亡率[25]。本研究中,高剂量组猫在试验中期便出现明显肾衰表现,并在后期死亡2 只,其发展进程较快,死亡率较高,未能建立稳定的慢性肾衰模型;而中、低剂量组猫肾衰表现是于试验后期呈进行性出现的,且未有猫死亡,其血、尿生理生化指标较高剂量组指标进展更为稳定,故中、低剂量组为成功建立的稳定的猫CRF 模型。采用此方法建立的猫CRF 动物模型不仅试验周期短、操作简单、可重复性高,且克服了药物法对试验动物其他组织产生较强毒性,死亡率高等缺点。此外,选用猫作为试验动物具备良好的临床相似性。不过该法也存在不足之处,如猫作为试验动物成本较高以及雄猫较雌猫更易发生肾结石而致试验结果受到影响。
综上,本研究通过三聚氰胺与三聚氰酸混合饲喂的方式成功建立了稳定的猫慢性肾衰竭模型,为研究猫慢性肾功能衰竭致病机理及临床治疗药物的筛选奠定基础。

