维药洋甘菊化学成分及DPPH自由基清除活性研究
叶 琦,汪 洋,李思婵,梅 艳
华中科技大学同济医学院附属武汉儿童医院,武汉430000
洋甘菊(MatricariachamomillaL.)为菊科(Compositae)母菊属(Matricaria)一年生草本植物[1],又名德国洋甘菊或母菊,维吾尔医药又称巴布那儿、巴木乃[2],其味微苦、甘香,具有明目、退肝火、祛痰止咳的作用,可有效缓解支气管炎及气喘、抑制真菌、消炎解痉[3,4],为《国家药品标准维吾尔药分册》所收藏。原产于地中海东部流域和亚洲西北部地区,古埃及和希腊人常用它作药物,是一种重要的药用植物和香料资源,它的干燥头状花序已成为一种重要的出口物资。作为一种民族常用药,洋甘菊在此前的研究中已发现其化学成分主要包括挥发油类、黄酮类、香豆素类、有机酸类等[5,6]。为更好地开发利用我国的洋甘菊资源,我们对新疆产洋甘菊头状花序的化学成分进行了研究,从其75%醇提取物中分离得到11个化合物,通过波谱方法分别鉴定为分别为山萘酚-3-O-β-D-葡萄糖苷(1)、木犀草素-3′-O-β-D-葡萄糖苷(2)、6-羟基木犀草素-7-O-β-D-葡萄糖苷(3)、异槲皮苷(4)、5-羟基-4′,7-二甲基-6,8-二甲氧基黄酮(5)、槲皮素-3′-O-β-D-葡萄糖苷(6)、3-羟基苯甲醇(7)、1-(4-羟基苯基)乙烷-1,2-二醇(8)、2-(3-甲氧基-4-羟基苯基)-丙烷 -1,3-二醇(9)、2-(4-羟基乙基)-乙醇(10)、丁香酸(11)。其中化合物1~3,5,7~11为首次从该植物中分离得到,体外活性测试结果显示化合物1、2、3、5、6具有较好的清除自由基作用。
1 材料与方法
1.1 药品与试剂
柱色谱硅胶(200~300目、300~400目)及薄层色谱硅胶G、H(青岛海洋化工厂);Sephadex LH-20(瑞典Pharmacia公司);ODS(40~60 μm)(美国Sepax Technologies);甲醇、乙腈(均为色谱纯)(美国Honeywell公司);DPPH试剂(美国Sigma公司);Vitamin E、二甲基亚砜等化学试剂(国药集团化学试剂有限公司),实验用水为超纯水。
1.2 仪器
AVANCEIII-600型核磁共振仪(德国Bruker公司);Agilent 1200高效液相色谱仪(美国Agilent公司);戴安U-3000型半制备液相色谱仪(美国戴安公司);半制备色谱柱RP18(250 mm×20 mm,5 μm)(日本YMC公司);EYELAN 1000型旋转蒸发仪(日本东京理化器械株式会);KQ-100DA型数超声波清洗器(昆山市超声仪器有限公司); WD-9405B 型水平摇床(沃德生物医学仪器公司);Melab-U/4C501H 型生物信号采集系统(南京美易科技有限公司)。
1.3 药材
洋甘菊购自于九州通中药材有限公司,由武汉市第一医院余南才主任药师鉴定为菊科(Compositae)母菊属(Matricaria)植物洋甘菊(MatricariachamomillaL.)。
2 实验方法
2.1 提取分离实验
将洋甘菊5 kg加10倍体积的75%乙醇回流提取,每次1小时,将提取液过滤浓缩,得浸膏约1 L,用水分散后,用乙酸乙酯萃取,萃取液浓缩,得到乙酸乙酯浸膏330 g,水层部分浓缩后经大孔树脂D101,水洗至无色后用75%乙醇洗,收集洗脱液回收有机溶剂,得到浸膏120 g。取部分浸膏(100 g)进行硅胶柱色谱分离,二氯甲烷-甲醇-水梯度洗脱(10∶1∶0→70∶30∶5),收集流份,采用TLC检测,10%硫酸-乙醇喷雾加热显色,合并相同组分,经ODS、LH20柱色谱及半制备HPLC等方法进行分离纯化,得到化合物1(13 mg)、2(15 mg)、3(17 mg)、4(130 mg)、5(21 mg)、6(28 mg)、7(11 mg)、8(36 mg)、9(24 mg)、10(17 mg)、11(19 mg)。
2.2 DPPH自由基清除实验
将化合物1~11分别配制浓度为 6.25、12.5、25、50、100、200 μmol/L甲醇溶液,作为实验组。同时配制200 μmol/L的维生素E(Vitamin E)作为对照组。将不同浓度的样品溶液100 μL 和DPPH(1 mmol/L)溶液 100 μL于96孔酶标板中,加入样品后振荡 30 s,在 37 ℃、 517 nm 波长下测定其吸光度值(Ap);同时测定不加 DPPH 的样品空白吸光度值(Ac)和加 DPPH 但不加样品(以 100 μL甲醇代替样品)的吸光度值(Amax)[7],实验重复3次,并按公式和回归方程分别计算自由基清除率和半数清除率(IC50)。实验结果见表1。
DPPH清除率=1-(Ap-Ac)/Amax
3 实验结果与讨论
化合物1黄色结晶性粉末(MeOH);可溶于甲醇、乙醇等溶剂;1H NMR(DMSO-d6,600 MHz)δ:12.68(1H,brs,5-OH),6.28(1H,d,J=2.0 Hz,H-6),6.53(1H,d,J=2.0 Hz,H-8),8.04(2H,d,J=8.4 Hz,H-2′,6′),6.89(2H,d,J=8.4 Hz,H-3′,5′),5.40(1H,d,J=6.6 Hz,H-1″);13C NMR(DMSO-d6,150 MHz)δ:177.4(C-4),164.1(C-7),161.1(C-5),160.0(C-4′),156.3(C-2),156.2(C-9),133.4(C-3),130.9(C-2′,6′),120.8(C-1′),115.1(C-5′),115.0(C-3′),104.0(C-10),100.8(C-1″),98.7(C-6),93.6(C-8),77.4(C-5″),76.4(C-3″),74.1(C-2″),69.8(C-4″),60.8(C-6″)。以上数据与文献[8]报道一致,故鉴定化合物1为山萘酚-3-O-β-D-葡萄糖苷。
化合物2淡黄色粉末(MeOH);1H NMR(DMSO-d6,600 MHz)δ:7.84(1H,d,J=2.0 Hz,H-2′),7.61(1H,dd,J=9.0,2.4 Hz,H-6′),7.01(1H,d,J=9.0 Hz,H-5′),6.55(1H,d,J=2.4 Hz,H-8),6.20(1H,d,J=2.4 Hz,H-6),4.94(1H,d,J=7.6 Hz,H-1″);13C NMR(DMSO-d6,150 MHz)δ:181.9(C-4),164.3(C-2),163.8(C-7),161.4(C-5),157.3(C-9),150.6(C-4′),145.7(C-3′),121.9(C-6′),121.8(C-1′),116.4(C-5′),114.3(C-2′),103.7(C-10),103.4(C-3),101.8(C-1″),98.9(C-6),93.9(C-8),77.4(C-5″),76.1(C-3″),73.1(C-2″),70.1(C-4″),60.9(C-6″)。以上数据与文献[9]报道一致,故鉴定化合物2为木犀草素-3′-O-β-D-葡萄糖苷。
化合物3淡黄色粉末(MeOH);1H NMR(DMSO-d6,600 MHz)δ:12.88(1H,s,5-OH),7.81(1H,d,J=7.2 Hz,H-6′),7.36(1H,s,H-2′),6.98(1H,s,H-8),6.88(1H,d,J=6.6 Hz,H-5′),6.67(1H,s,H-3),5.03(1H,d,J=5.4 Hz,H-1″),3.82(2H,d,J=10.2 Hz,H-6″),3.49~3.30(4H,m,sugar-H);13C NMR(DMSO-d6,150 MHz)δ:155.8(C-2),114.5(C-3),183.1(C-4),146.7(C-5),130.6(C-6),151.2(C-7),94.3(C-8),149.8(C-9),106.5(C-10),122.4(C-1′),113.8(C-2′),146.3(C-3′),150.1(C-4′),116.7(C-5′),120.0(C-6′),102.1(C-1″),73.7(C-2″),77.2(C-3″),70.6(C-4″),76.9(C-5″),61.7(C-6″)。以上数据与文献[10]报道一致,故鉴定化合物3为6-羟基木犀草素-7-O-β-D-葡萄糖苷。
化合物4黄绿色粉末(MeOH);1H NMR(CD3OD,600 MHz)δ:7.88(1H,d,J=2.4 Hz,H-2′),7.86(1H,d,J=8.4 Hz,H-6′),6.98(1H,d,J=8.4 Hz,H-5′),6.57(1H,d,J=1.8 Hz,H-8),6.32(1H,d,J=2.4 Hz,H-6),5.34(1H,d,J=7.8 Hz,H-1″),3.82(1H,dd,J=3.0,2.4 Hz,H-6″α),3.68(1H,dd,J=6.0,5.4 Hz,H-6″β),3.59~3.30(4H,m,sugar-H);13C NMR(CD3OD,150 MHz)δ:178.8(C-4),166.5(C-7),163.1(C-5),159.7(C-2),158.6(C-9),150.2(C-4′),146.3(C-3′),136.0(C-3),123.5(C-6′),123.4(C-1′),117.9(C-5′),116.3(C-2′),106.1(C-10),104.7(C-1″),100.0(C-6),95.1(C-8),78.7(C-5″),78.2(C-3″),71.6(C-2″),63.0(C-4″),60.9(C-6″)。以上数据与文献[11]报道一致,故鉴定化合物4为异槲皮苷。
化合物5黄色针状结晶(MeOH);1H NMR(DMSO-d6,600 MHz)δ:13.03(1H,s,5-OH),8.07(2H,s,H-2′,6′),7.15(2H,s,H-3′,5′),6.97(1H,s,H-3),3.86、3.76(3H,each,-OCH3),2.35、2.10(3H,each,-CH3);13C NMR(DMSO-d6,150 MHz)δ:182.8(C-4),163.8(C-7),162.5(C-4′),162.2(C-2),156.3(C-5),152.4(C-9),128.4(C-2′,6′),123.1(C-1′),114.8(C-3′,5′),113.3(C-6),108.9(C-8),106.7(C-10),103.3(C-3),60.5、55.7(4′,7-OCH3)。以上数据与文献[12]报道一致,确定化合物5为5-羟基-4′,7-二甲基-6,8-二甲氧基黄酮。
化合物6黄色针状结晶(MeOH);1H NMR(CD3OD,600 MHz)δ:7.83(1H,s,H-2′),7.74(1H,d,J=8.4 Hz,H-6′),6.98(1H,d,J=8.4 Hz,H-5′),6.50(1H,d,J=2.4 Hz,H-8),6.28(1H,s,H-6),3.83(2H,s,H-6′′),3.60~3.50(4H,m,H-2~5);13C NMR(CD3OD,150 MHz)δ:177.7(C-4),165.9(C-7),162.9(C-9),158.4(C-5),149.1(C-4′),148.4(C-3′),146.6(C-2),124.6(C-3),124.4(C-1′),122.1(C-6′),116.4(C-5′),116.3(C-2′),104.9(C-10),102.9(C-1′′),99.5(C-6),94.6(C-8),75.2(C-3′′),74.1(C-2′′),71.2(C-4′′),78.2(C-5′′),62.8(C-6′′)。以上数据与文献[13]报道一致,故鉴定化合物6为槲皮素-3′-O-β-D-葡萄糖苷。
化合物7无色针状结晶(MeOH);1H NMR(CD3OD,600 MHz)δ:7.29(1H,dd,J=7.8,7.2 Hz,H-5),7.06(1H,t,J=2.4 Hz,H-2),6.83(1H,t,J=2.4 Hz,H-6),6.76(1H,dd,J=7.8,2.4 Hz,H-4),4.60(2H,s,-CH2);13C NMR(CD3OD,150 MHz)δ:156.7(C-3),142.6(C-1),130.2(C-5),118.3(C-6),115.0(C-4),114.1(C-2),65.2(-CH2OH)。以上数据与文献[14]报道一致,故鉴定化合物7为3-羟基苯甲醇。
化合物8白色粉末(CHCl3);1H NMR(CD3OD,600 MHz)δ:7.21(2H,d,J=8.4 Hz,H-2′,6′),6.66(2H,d,J=7.8 Hz,H-3′,5′),4.59(1H,dd,J=6.6,6.0 Hz,H-1),3.70(2H,m,H-2);13C NMR(CD3OD,150 MHz)δ:157.7(C-4′),133.9(C-1′),128.2(C-2′,6′),116.0(C-3′,5′),74.9(C-1),68.4(C-2)。以上数据与文献[15]报道一致,故鉴定化合物8为1-(4-羟基苯基)乙烷-1,2-二醇。
化合物9无色油状(MeOH);1H NMR(CD3OD,600 MHz)δ:6.98(1H,s,H-2),6.79(1H,d,J=8.4 Hz,H-5),6.62(1H,d,J=8.4 Hz,H-6),3.89(3H,s,H-10),3.89~3.69(2H,m,H-8,9),2.84(1H,m,H-7);13C NMR(CD3OD,150 MHz)δ:147.9(C-3),146.0(C-1,4),120.2(C-6),115.2(C-5),112.0(C-2),64.9(C-8,9),56.2(C-10),49.7(C-7)。以上数据与文献[16]报道一致,故鉴定化合物9为2-(3-甲氧基-4-羟基苯基)-丙烷-1,3-二醇。
化合物10无色针晶(CHCl3);1H NMR(CD3OD,600 MHz)δ:7.14(2H,d,J=8.4 Hz,H-2,6),6.72(2H,d,J=8.4 Hz,H-3,5),3.79(2H,t,J=7.2 Hz,H-8),2.82(2H,t,J=7.2 Hz,H-7);13C NMR(CD3OD,150 MHz)δ:157.0(C-4),131.2(C-1),131.1(C-2,6),116.4(C-3,5),64.9(C-8),39.7(C-7)。以上数据与文献[17]报道一致,故鉴定化合物10为2-(4-羟基乙基)乙醇。
化合物11无色针晶(MeOH);1H NMR(CD3OD,600 MHz)δ:7.28(2H,s,H-2,6),3.77(6H,s,3,5-OCH3);13C NMR(CD3OD,150 MHz)δ:170.4(C-7),149.0(C-3 ,5),141.9(C-4),122.3(C-1),108.3(C-2,6),56.8(3,5-OCH3)。以上数据与文献[18]报道一致,故鉴定化合物11为丁香酸。
DPPH 自由基清除实验结果(表1)显示,化合物1~11均有不同程度的自由基清除能力,且全部具有浓度依赖性。其中化合物1~6为黄酮类化合物,浓度为 200 μmol/L 时,自由基清除率均大于80%,且化合物1、2、3、5、6的IC50值与阳性对照维生素E相当(表1),这主要由于结构中富含酚羟基而起到显著的DPPH清除作用,表现出较强的抗氧化活性。
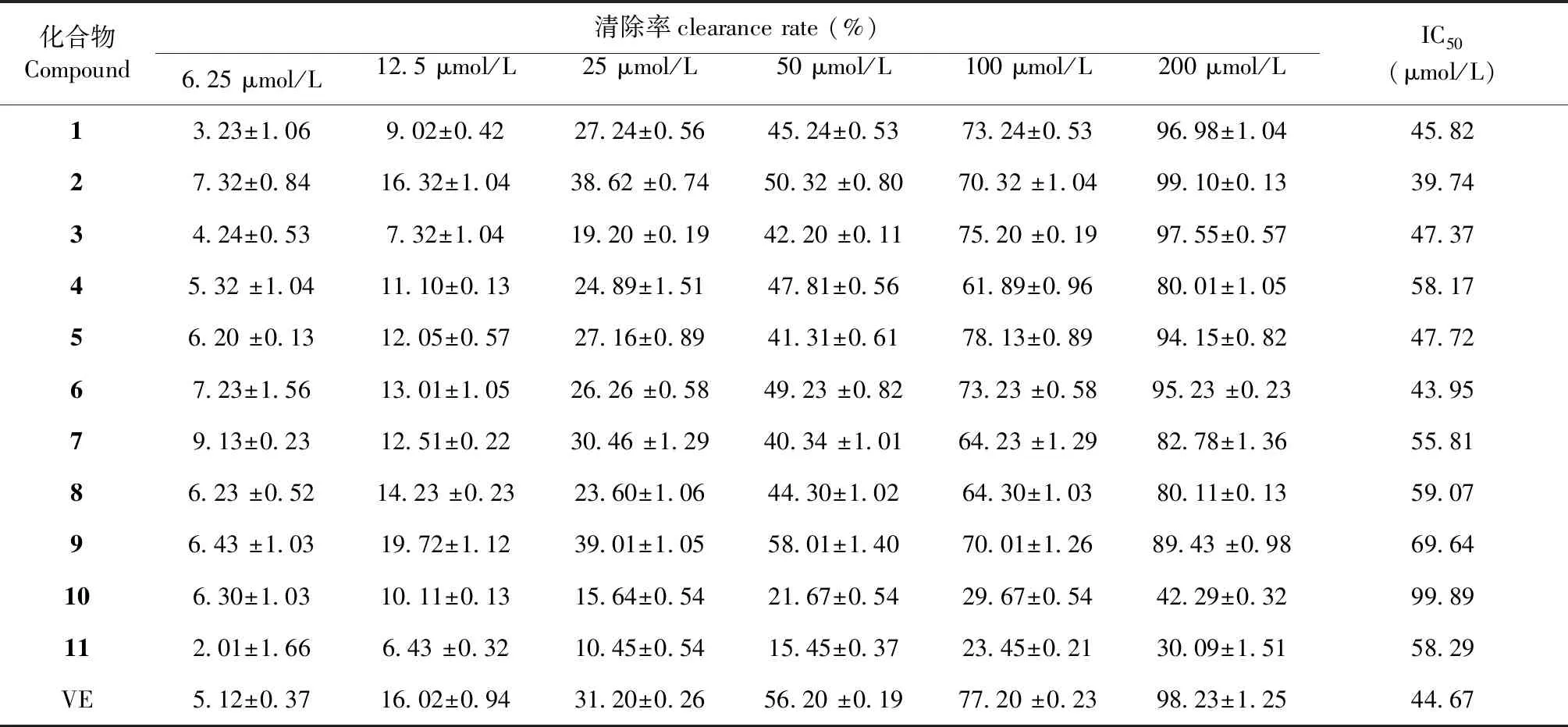
表1 化合物1~11的DPPH自由基清除率Table 1 DPPH free radical clearance of compounds 1-11
4 讨论
本文对洋甘菊的化学成分进行了系统的分离和鉴定,从中得到了11个化合物,主要为黄酮和芳香类物质,其中1~3、5、7~11为首次从该植物中分离得到。这为阐明洋甘菊药效物质基础提供了一定的依据。
前期有文献报道洋甘菊具有抗炎、抗氧化、降血压和降血脂的作用,尤其是从中分离得到的黄酮类成分有显著活性[19,20]。本次研究洋甘菊的主要化学成分为黄酮和小分子酚酸,而且所发现的化合物均表现出一定程度的DPPH自由基清除活性,尤其是黄酮类物质1~3、5、6表现出与对照组相当的活性,推测洋甘菊可以改善治疗多种疾病可能与其含有的抗氧化成分有关,当然,这需要进一步的实验证实。

