乙酰甲胺磷酸碱解离常数的测定
方倩囡,宋德安,孔凡玉
(中国农业科学院烟草研究所,山东青岛 266101)
1972年,美国雪佛龙公司研究开发了一种新型有机磷农药——乙酰甲胺磷(acephate),此后,乙酰甲胺磷在世界范围内进行大规模的工业化量产,现已成为世界上销售量最大的十种有机磷农药之一[1]。作为高毒农药甲胺磷的替代品,乙酰甲胺磷是一种高效、低毒、内吸性强的广谱型杀虫剂,能明显抑制蚜科(烟草蚜虫、小麦芽虫)、鳞翅目(番茄斜纹夜蛾、棉花棉铃虫、茶树茶尺蠖、玉米螟)、膜翅目(杜鹃三节叶蜂、黄连木种子小蜂)等害虫对农作物的危害[2-3]。乙酰甲胺磷纯品的大鼠急性经口半数致死量为823 mg/kg,工业品的大鼠急性经口半数致死量为945 mg/kg,其毒性仅为甲胺磷的1/50[4]。
酸碱解离常数(pKa)又称解离平衡常数,定义为在一定温度下弱电解质达到电离平衡状态时,已解离的离子浓度的乘积与未解离分子浓度的比值。酸碱解离常数是与农药溶解度和pH值密切相关的理化常数,也是探究农药酸碱性等理化性质的重要信息[5-6],在评价其对环境和人体健康的影响方面具有十分重要的意义。测定化学物质解离常数的方法目前主要有以下几种:①紫外分光光度法;②电泳法;③荧光法;④电导率法;⑤电位滴定法。紫外分光光度法操作简单、方便快捷,精密度高且重现性好,后期数据处理方便,特别适用于弱酸(碱)性物质解离常数的测定。
本实验根据紫外分光光度法测定解离常数(pKa)的原理,首次采用紫外分光光度法及A-pH曲线法结合Sigmoidal数理模型拟合分段测定了乙酰甲胺磷的pKa1和pKa2值,并从分子基团的角度解释其水解特性,对指导乙酰甲胺磷的合理使用,评价其环境安全性以及减少对环境的负面效应具有重要意义。
1 材料与方法
1.1 实验原理
水溶性农药在水溶液体系中可以发生电离,以弱酸类农药HZ为例,将HZ溶解到水中,形成HZ稳定水溶液,HZ在水中达到电离平衡状态HZ=H++Z-,因此HZ在水溶液中解离常数,此等式两边同时取负对数,得到酸碱解离常数计算公式。

式中:HZ为共轭酸,Z-为共轭碱。
紫外分光光度法测定农药的pKa具有一定条件要求:首先HZ和Z-均有紫外吸收,用紫外分光光度计可以测得具体数值;另外在同一酸碱条件下HZ和Z-的紫外吸收光谱呈现出明显的差异性。实际测定时,配置一系列浓度相等的农药水溶液,通过酸碱溶液KOH和HCl调节以上溶液体系的pH值:①将一部分农药溶液pH值调节到7左右,让溶液中的农药以HZ和Z-两种形式存在;②用HCl将另一部分农药溶液pH值调节至酸性条件,此时水溶液中的农药主要以HZ的形式存在;③用KOH将另一部分农药溶液pH值调节至碱性条件,此时水溶液中的农药主要以Z-的形式存在。设农药的浓度为C,溶液中HZ的浓度为CHZ,Z-的浓度为CZ-。Abase是碱性条件下的吸光度,Aacid是酸性条件下的吸光度,Aobs是中性条件下的吸光度。如果HZ与Z-的紫外吸收均符合吸收定律,那么:


根据式(2)即可计算出农药的pKa值[7]。
1.2 实验试剂与仪器
SPECORD200型紫外分光光度计,德国耶拿分析仪器股份公司;PHS-3C酸度计,上海雷磁仪器厂,使用前在pH值4.00、6.86和9.18处校准;乙酰甲胺磷(纯度99%);KOH、HCl和KCl均为分析纯,北京国药化学试剂有限公司;实验用水为蒸馏水。
1.3 实验方法
乙酰甲胺磷溶液的配制:称取乙酰甲胺磷原药0.018 3 g,置于100 mL容量瓶中,加入蒸馏水溶解并定容,即得到浓度为1 mmol/L的乙酰甲胺磷溶液。
缓冲溶液:0.1 mol/L HCl与0.1 mol/L NaOH溶液按不同的比例进行混合,制备成pH值为2.87~8.12的一系列溶液,加入乙酰甲胺磷溶液中,并加入2 mol/L KCl溶液0.25 mL控制离子强度。
分别将不同pH值的乙酰甲胺磷溶液置于1 cm吸收池中,以对应的pH值溶液做空白对照,在210~250 nm波长范围内扫描,得到不同pH值的乙酰甲胺磷溶液的紫外吸收光谱。选择合适波长处测定不同pH值的乙酰甲胺磷溶液的吸光度值,利用Origin 9.0软件拟合曲线求出乙酰甲胺磷的解离常数[8]。
2 结果与分析
2.1 测定波长的选定
图1为不同pH值条件下乙酰甲胺磷溶液的210~250 nm紫外吸收光谱图,可以看出pH值为2.21~4.98的溶液的紫外吸收光谱基本重合,可以认为pH值在4.98以下,乙酰甲胺磷基本上以分子形式存在;pH值为9.61~12.13的缓冲溶液的紫外吸收光谱基本重合,可以认为pH值在9.61以上,乙酰甲胺磷基本上以离子形式存在;pH值为4.98~9.61,乙酰甲胺磷一部分以分子状态存在,一部分以离子状态存在。

图1 乙酰甲胺磷在不同pH值的缓冲溶液中的紫外吸收光谱
乙酰甲胺磷在波长210 nm、217 nm和230 nm处随pH值的变化,曲线呈现规律性变化,因此可以选择这3个波长作为测定波长。
将210 nm、217 nm和230 nm波长处不同pH值下乙酰甲胺磷溶液的吸光度绘制成图2,于210 nm和217 nm处可以观测曲线有3个拐点,所以乙酰甲胺磷有2个pKa值。

图2 3个波长下不同pH值的乙酰甲胺磷溶液的吸光度
2.2 乙酰甲胺磷一级解离常数(pKa1)的测定
由图2可知,乙酰甲胺磷有2个pKa值。根据3个波长下不同pH值的乙酰甲胺磷溶液的吸光度,利用Origin 9.0软件以pH值为横坐标,以不同pH值对应的吸光度值为纵坐标,以Sigmoidal数理模型拟合曲线方程,求得pKa。
对于pKa1,拟合曲线方程:

其中,Abase、Aacid、x都在图2中可知,将数据输入拟合曲线方程中,利用Origin 9.0分析可得乙酰甲胺磷的解离常数pKa1。根据图2,选择3个波长处的pH值为2~12的吸光度值进行Sigmoidal数理模型拟合,得到图3、图4和图5。
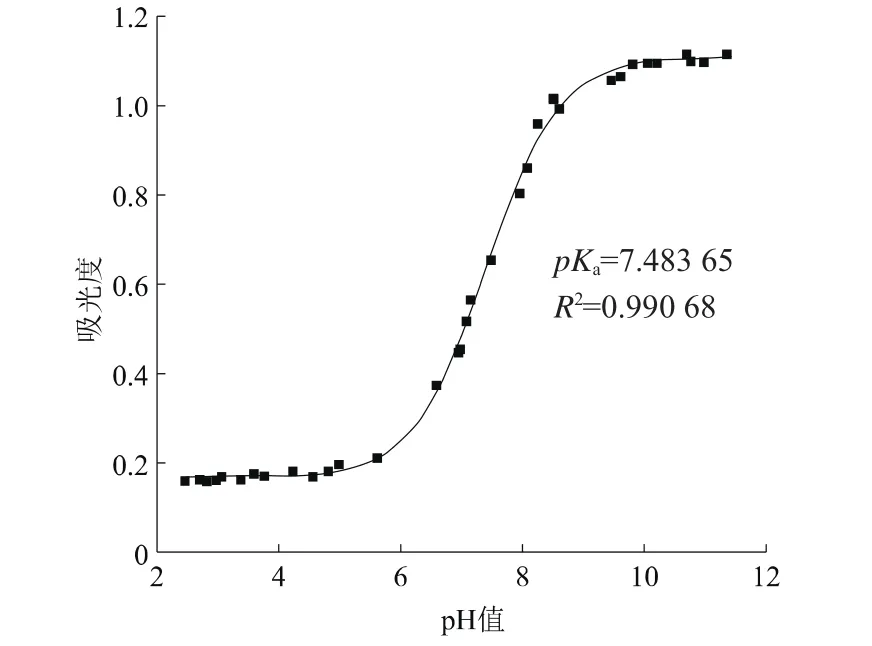
图3 波长210 nm处Sigmoidal数理模型拟合A-pH曲线

图4 波长217 nm处Sigmoidal数理模型拟合A-pH曲线

图5 波长230 nm处Sigmoidal数理模型拟合A-pH曲线
由图3、图4和图5模拟分析结果可得,当波长为210 nm时,pKa1值为7.483 65,相关系数为0.990 68;当波长为217 nm时,pKa1值为7.422 60,相关系数为0.992 07;波长为230 nm时,pKa1值为7.497 55,相关系数为0.973 93;所得的pKa1值比较可靠。求得乙酰甲胺磷解离常数的平均值pKa1为7.467 93。
2.3 乙酰甲胺磷二级解离常数(pKa2)的测定
对于pKa2,由于pH值大于12.5的数值难以在实验条件下测得,所以曲线采用赋值测试的方法进行拟合。选取210 nm处pH值大于9.4的数据进行赋值拟合,设初始值Aacid=1,Abase=3,曲线拟合结果见图6。

图6 波长210nm处Sigmoidal数理模型拟合A-pH曲线
由图6模拟分析结果可得,在pH值为9.5~12.5时,波长为210 nm时,pKa2值为12.778 3,相关系数为0.998 71。
2.4 理论分析乙酰甲胺磷解离常数的合理性
乙酰甲胺磷的水解位点见图7。乙酰甲胺磷的分子结构中存在3个可能的水解位点,包括磷酸基、仲氨基、羰基。其中对于仲氨基来说,其具有较多的取代基,在诱导效应与位阻效应的双重作用下,较难发生水解。因此,仲氨基的水解常数一般在10以上。这与本实验中pKa2值为12.778 3的结果基本吻合,故可以推测乙酰甲胺磷的第2个水解常数应发生在仲氨基。比较而言,磷酸基较易发生水解反应,且一般在中性pH值附近,因此可将乙酰甲胺磷的第1个水解常数(pKa1值为7.467 93)归因于磷酸基的水解过程[9]。而对于羰基,其孤对电子难以与质子发生结合,因此可以认为在本实验的pH值范围内不发生水解反应[10-11]。

图7 乙酰甲胺磷的水解位点
3 结论
本研究采用紫外分光光度法及A-pH曲线法结合Sigmoidal数理模型拟合分段测定了乙酰甲胺磷的解离常数,测得乙酰甲胺磷的一级(pKa1)、二级(pKa2)解离常数分别为7.467 93、12.778 3。
本实验选取了3个测定波长210 nm、217 nm和230 nm,分别计算在这3个波长下乙酰甲胺磷的解离常数。这3个波长下经绘图软件拟合的曲线相关系数均大于0.95,测定结果可靠。
乙酰甲胺磷的分子结构中存在3个可能的水解位点:磷酸基、仲氨基和羰基。仲氨基的水解常数在10以上,这与本实验中的pKa2值为12.778 3的结果基本吻合,磷酸基较易在中性pH值附近发生水解反应,因此可与乙酰甲胺磷的一级解离常数(pKa1值为7.467 93)相对应。

