Myomaker和Myomerger调控成肌细胞融合的分子机制
朱艳,张进威,齐婧,李学伟,陈磊,李明洲,马继登
Myomaker和Myomerger调控成肌细胞融合的分子机制
朱艳1,张进威1,齐婧1,李学伟1,陈磊2,李明洲1,马继登1
1. 四川农业大学动物科技学院,畜禽遗传资源发掘与创新利用四川省重点实验室,成都 611130 2. 重庆市畜牧科学院,重庆 402460
骨骼肌形成是一个复杂的生理过程,主要涉及肌源性干细胞增殖形成成肌细胞,进而分化、融合形成多核肌管。研究发现,有多种蛋白参与成肌细胞融合过程,但它们均不具有肌肉特异性。近年来,两种肌肉特异性膜蛋白Myomaker和Myomerger先后被发现和鉴定,它们能协调促进成肌细胞融合,从而参与骨骼肌形成过程。本文对成肌过程中和的表达模式、功能域等研究现状及其参与成肌细胞的融合机制进行了综述,旨在为深入研究骨骼肌形成过程及治疗肌细胞融合相关疾病提供参考信息。
骨骼肌形成;;;细胞融合
骨骼肌形成(myogenesis)是一个复杂的生理过程,包括胚胎和幼年的肌肉发育以及成年肌肉损伤后再生过程[1]。成肌调控因子(myogenic regulatory factors, MRFs)的时序性表达促进了肌肉结构和功能的完善,对成肌命运决定和肌管分化至关重要[2]。单核成肌细胞或肌原性祖细胞被激活进而融合形成多核肌管是成肌的关键步骤[3,4],研究表明这一过程受多种蛋白的协作调控,但很少涉及肌肉特异性的调控蛋白。直到2013年,美国德克萨斯大学达拉斯西南医学中心的Millay团队[5]发现TMEM8c(并命名为Myomaker)是一种能直接调控成肌细胞融合的肌肉特异性膜蛋白。Myomaker含有7个跨膜域[6]且在骨骼肌生成和损伤修复过程中瞬时高丰度表达,能有效促进成肌细胞融合[5,7]。2017年,另一种肌肉特异性融合蛋白GM7325被发现和鉴定,并命名为Myomerger (也称Minion或Myomixer)。能促进融合性细胞 (如成肌细胞) 间发生融合,当与共同表达时,也能诱导非融合性细胞间(如成纤维细胞)发生融合[1,8,9]。然而目前和协同调控细胞融合的机制还有待深入研究。本文综述了和在成肌细胞融合方面的最新进展,为研究骨骼肌形成的分子机制提供理论依据,同时也为治疗细胞融合相关疾病提供一定思路。
1 骨骼肌形成过程
1.1 骨骼肌形成
骨骼肌是机体的重要组成部分[10],由多核肌纤维彼此紧密排列构成。骨骼肌形成包括前体细胞招募、成肌细胞分化、单核肌细胞融合等。在胚胎骨骼肉发育过程中,PAX7+前体细胞 (肌源性干细胞) 被招募为成肌细胞,然后增殖和分化,最后彼此融合或与现存肌纤维融合形成多核成熟肌管[11];同样,当骨骼肌受到外源损伤后,依附于肌纤维基部的静息肌卫星细胞会被激活进而增殖、分化,最终融合形成新肌管以修复肌肉创伤[12],因此成肌细胞融合是骨骼肌形成的关键步骤。
1.2 成肌细胞融合
成肌细胞融合是一个受到高度调控的动态过程,主要涉及细胞骨架重排以及在细胞膜上形成融合孔并交换细胞质成分,最终完成细胞融合[13]。Yafe等[14]研究表明,许多调控因子参与了细胞融合的调控过程,如MRFs家族(主要包括、、和),该家族可以与E-box元件结合,调控大多数成肌相关基因的转录。和被认为是肌形成的决定因子,而和在分化后期高度表达,触发成肌细胞融合最终形成肌管[15]。目前研究表明,部分细胞粘附蛋白参与了成肌细胞融合过程[16~18],如Myoferlin是一种在融合细胞膜上高表达的跨膜蛋白,由6个C2结构域(8个β链形成的折叠结构)和一个羧基端跨膜域构成[19,20],依赖于钙离子与磷脂结合[21]。氨基末端的C2结构域(C2 domain of the amino terminus, C2A)突变可以破坏这种结合,从而降低肌管的融合效率[22]。然而,上述蛋白均是非肌肉特异性蛋白,并且许多蛋白在成肌细胞融合过程中并未发挥直接调控作用。因此,研究和揭示直接参与成肌细胞融合的肌特异性膜蛋白成为当前研究热点。近年来,随着对和的研究,肌细胞融合过程的调控机制逐渐清晰(图1)。
2 成肌过程中Myomaker和Myomerger表达模式
2013年以前,对基因的研究几乎是空白,直到Millay团队[5]首次发现的融合功能并命名为。该团队通过对小鼠()胚胎进行原位杂交,发现主要在肌肉组织中特异性表达,提示对骨骼肌发育的重要性。同时,Zhang等[23]和Landemaine等[24]研究发现在斑马鱼()快肌(融合能力较强)中高表达,在慢肌(融合能力较弱)中表达量显著降低;另外,通过qPCR发现的表达模式类似于和,即在胚胎骨骼肌形成过程中的表达水平明显高于骨骼肌发育完成后。2017年,Takei等[25]发现了另一种膜蛋白GM7325的表达量在激活的肌卫星细胞中显著上调,暗示对骨骼肌形成的重要作用。同年,Quinn等[9]将命名为,发现也在肌肉组织中特异性表达,并且在小鼠胚胎发育过程中和的表达模式类似[5]。骨骼肌生长通常发生在胚胎期和成年肌肉再生期两个阶段。对此,Millay等[7]为了研究在骨骼肌再生过程中的表达情况,向成年小鼠骨骼肌注射心脏毒素(cardiotoxin, CTX)使之损伤再生,结果显示当骨骼肌受到损伤刺激时,处于静息期的肌卫星细胞被迅速激活,同时的表达量显著上升进而促进细胞融合、修复损伤;在C2C12细胞水平,和在细胞分化和融合过程中的表达量逐渐上升,在分化末期则迅速降低。另外,He等[26]通过免疫印迹分析,发现Myomaker和Myomerger蛋白表达模式与其mRNA相似,该结果在斑马鱼[23,24]和鸡()[27]中再次得到了验证。虽然和的功能性表达在小鼠、斑马鱼和鸡中相似,但是其物种保守性仍有待在更多物种中研究确定。
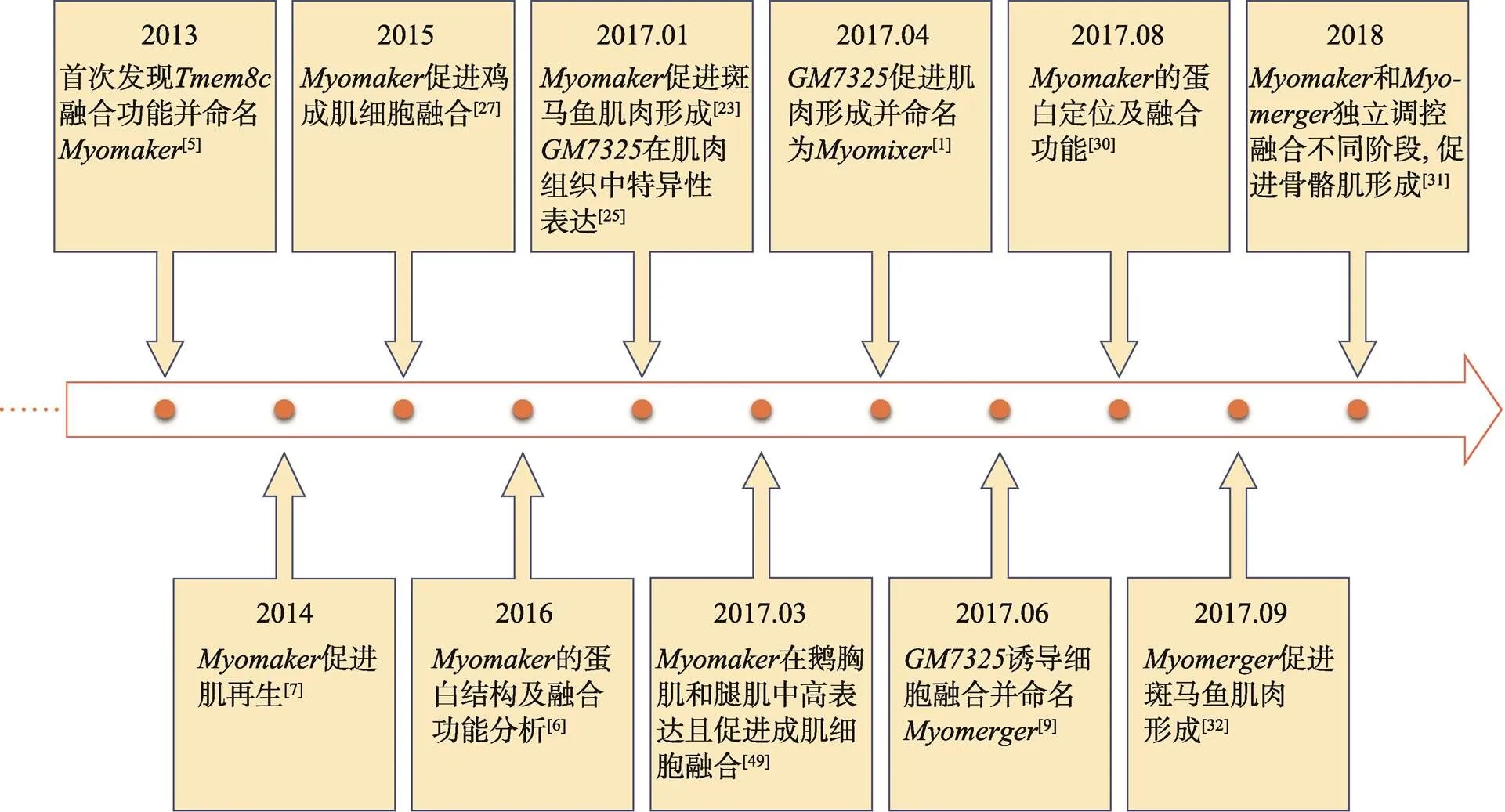
图1 Myomaker和Myomerger研究进展
3 Myomaker和Myomerger的功能域
3.1 Myomaker蛋白定位及结构
随着基因注释研究的不断完善,目前一些常见物种,包括人()[28]、小鼠[5-9,25,29]、斑马鱼[23]、鸡[27]的和基因结构已经得到解析(表1),但对于蛋白功能研究还相对滞后。Gamage等[30]通过设计两种不同定位的Myomaker抗体,发现Myomaker不仅定位于细胞膜,也存在于高尔基体和囊泡,这揭示Myomaker在细胞中的精确定位及其潜在的细胞间转运功能。另外,Millay等[6]通过免疫荧光染色(immunofluorescence, IF)发现Myomaker具有7个跨膜结构域 (含胞外N端和胞内C端),且Myomaker最后7个氨基酸(氨基酸215~221)的缺失会抑制细胞融合;Gamage等[30]通过对Myomaker C端分析,发现Myomaker蛋白含有3个保守的棕榈酰化半胱氨酸,其可能参与调控高尔基体转运(图2A)。综上所述,这些研究将有利于进一步解析和阐释成肌细胞的融合机制。

表1 常见物种Myomaker和Myomerger基因结构

图2 常见物种Myomaker和Myomerger蛋白序列对比
A:常见物种Myomaker蛋白序列对比。TM1-7:7个跨膜区域;红色序列:具有促进细胞融合功能;红色下划线序列:棕榈酰化半胱氨酸;小鼠、人、斑马鱼和鸡在UNIPROT中的ID号分别为:Q9D1N4、A6NI61、Q6IQ69和G3RFK8。B:常见物种Myomerger蛋白序列对比。小鼠、大鼠、人、斑马鱼和鸡在UNIPROT中的ID号分别为Q2Q5T5、D4A557、A0A1B0GTQ4、P0DP88和G3RUY6。
3.2 Myomerger蛋白结构
相比于Myomaker,目前对Myomerger的结构研究还较少。研究发现,Myomerger含有多重螺旋区 (图2B),其中N端疏水区域(氨基酸5~25)可能具有跨膜结构。Bi等[1]通过免疫共沉淀(Co-immunoprecipitation, Co-IP)分析表明,Myomerger N端第一个α-螺旋域内带正电的精氨酸能显著影响细胞融合能力。同时,Leikina等[31]通过免疫印迹(Western blot)证实Myomerger在细胞表面表达,且通过异源融合实验表明能显著促进成肌细胞与成纤维细胞完全融合,但具体作用仍需进一步研究。
4 Myomaker和Myomerger对细胞融合的影响
4.1 Myomaker和Myomerger促进细胞完全融合
在成肌细胞分化过程中,和的表达量逐渐增加,在分化末期,其表达量显著降低,这种峰值表达模式暗示和可能在细胞分化过程中发挥着重要作用。对此,Millay等[6]和Quinn等[9]利用CRISPR/Cas9基因编辑技术分别将小鼠和敲除后,发现这两种蛋白的缺失能显著抑制成肌细胞融合,该结果同样在鸡[27]和斑马鱼[32]中也得到了验证。然而,和敲除后均检测到(分化标志基因)的表达,说明和并不直接影响细胞分化,而是调控细胞融合。一直以来,被认为能有效促进肌源性细胞融合。能赋予非融合细胞融合能力,即也能促进非融合细胞如成纤维细胞与成肌细胞融合。但不能促进非肌细胞间的融合,即使过表达后,成纤维细胞间不能发生融合,由此暗示其他因子可能参与非肌细胞间发生融合。近来研究发现,共表达和的成纤维细胞在数小时内开始融合,最终形成巨大的合胞体[1,8],表明和能协同作用促进非肌细胞完全融合。
4.2 Myomaker和Myomerger独立调控成肌细胞融合的不同阶段
近年来,和协同促进细胞融合的机制逐渐得到解析。Bi[1]和Millay等[5]研究发现,和敲除的小鼠胚胎表现出相似表型,但这些表型却存在细微差异,例如在胚胎17.5天,敲除小鼠的肌细胞排列更紧密,暗示和在融合过程中可能发挥着不同功能。Leikina等[31]发现和调控成肌细胞融合和骨骼肌形成,但其结构却与传统的融合蛋白不同;免疫印迹结果证明主要在细胞表面表达,并作用于胞外应力膜;异源融合实验表明能独立于促进融合完成,并且和间的物理交互作用并不是其功能所必需的;通过双标记探针发现主要参与膜半融合 (即双层膜中仅一层发生融合),而主要促进融合孔形成 (即双层膜均发生融合,为胞质交换提供有利条件)。总之,成肌细胞融合是一个逐步完成的过程,其中和独立调控成肌细胞融合的两个不同阶段[31]:第一阶段,促进半融合形成,而并未发挥调控作用;第二阶段,作用于细胞膜,产生膜应力,以独立于的方式促进完全融合,最后形成多核的合胞体。另外,该研究还发现一些因子(如:Octyl glucopyranoside和magainin 2)能弥补的缺失进而促进细胞融合[31],这将为治疗肌肉相关疾病提供一定参考,但和是如何驱动半融合向完全融合转变仍有待进一步研究。
5 Myomaker、Myomerger及其相关因子对成肌细胞融合过程的调控机制
5.1 参与成肌细胞融合的调控因子
成肌细胞融合主要涉及3个关键步骤:首先成肌细胞彼此识别并粘附在一起,其次细胞膜的脂质双层发生重排形成融合孔,最后融合孔扩张形成合胞体并出现多核肌管。在这些复杂的过程中,除了Myomaker和Myomerger这两种肌肉特异性蛋白参与调控外,还有许多其他因子参与其中(图3)。例如一些免疫球蛋白超家族(immunoglobulin superfamily, Ig superfamily)被证实参与了成肌细胞融合过程[33]。Srinivas等[34]利用吗啉代(morpholino)介导的敲除实验,发现斑马鱼胚胎中和基因缺失会导致更短的肌管形成,暗示它们在成肌细胞融合过程发挥着重要作用。Powell等[35]研究表明,细胞黏附分子Jamb和Jamc突变会抑制斑马鱼胚胎中成肌细胞融合,从而形成单核的胚胎肌纤维。同样,另一种蛋白Cadherins被认为在细胞融合中发挥着黏附分子的作用[36,37],但具体的重要作用还有待进一步研究。在C2C12细胞分化过程中,Zhang等[8]对Myomerger进行免疫沉淀质谱分析(IP-mass spectrometry)发现了许多具有注释功能的蛋白。例如Ferlin家族成员,该基因突变会导致遗传性肌营养不良。Cárdenas等[38]发现在与细胞融合相关的过程中(如膜修复、囊泡转运和胞吐)具有调控作用。De等[39]研究表明基因缺失能明显抑制成肌细胞融合,但具体的调控机制仍有待深入研究。
近年来还发现了另一个调控成肌细胞融合的潜在途径,即磷脂酰丝氨酸(phosphatidylserine, PS)与其受体BAI1[40]或Stability-2[41]结合,BAI1或Stability-2通过ELMO/Dock1通路激活Rac1,进而调控细胞膜重排。Kim等[42]和Jeong等[43]研究发现,PS可转移到胞外且可以作为直接促进细胞融合的信号。BAI1和Stability-2作为一种膜蛋白,其作用机制与Myomaker和Myomerger类似,但敲除和具有胚胎致死性,而或缺失对肌肉损伤则相对温和[40,41],但具体机制还需进一步研究。
5.2 Myomaker和Myomerger对成肌细胞融合的转录调控机制
研究表明,参与调控成肌细胞融合的和主要受MRFs和一些非编码RNA调控。Luo等[27]对鸟类成肌细胞研究发现,在分化过程中,和可直接与启动子结合,从而调控转录。研究表明,miRNAs在骨骼肌分化中发挥着关键作用[44~46],例如:miR-1能促进骨骼肌成肌细胞分化[47];miR-133促进细胞增殖但抑制肌源性基因的表达[47];miR-206在骨骼肌中高表达,但其作用还有待研究[48]。Luo等[27]研究表明,miR-140-3p与3′-UTR靶向结合从而抑制鸟类表达及成肌细胞融合,暗示可能是miRNAs调节骨骼肌分化的关键因子。另外,He等[26]对小鼠的研究发现,miR-491能与3′-UTR特异性结合使表达下调。过表达miR-491能显著抑制肌肉细胞分化和成年肌肉损伤后再生,而抑制miR-491表达则能促进肌管分化,因此,miR-491可作为一种新的肌源性分化负调控因子通过靶向影响成肌过程。Ke等[49]研究发现,在鹅()的胸肌和腿肌中与表达具有负相关的miRNAs有4个,包括miR-125b-5p、miR-15a、miR-16-1和miR-23。双荧光素酶报告基因检测(dual-Luciferase Reporter Gene Assay)发现只有miR-16-1能直接靶向,表明miR-16-1可能是影响的潜在因素,但进一步的功能研究有待进一步被验证。总之,Myomaker和Myomerger是控制肌细胞融合的重要蛋白,同样受到MRFs和一些非编码RNA调控,因此,进一步完善和的上下游调控网络有利于深入解析肌细胞融合过程及潜在机制。
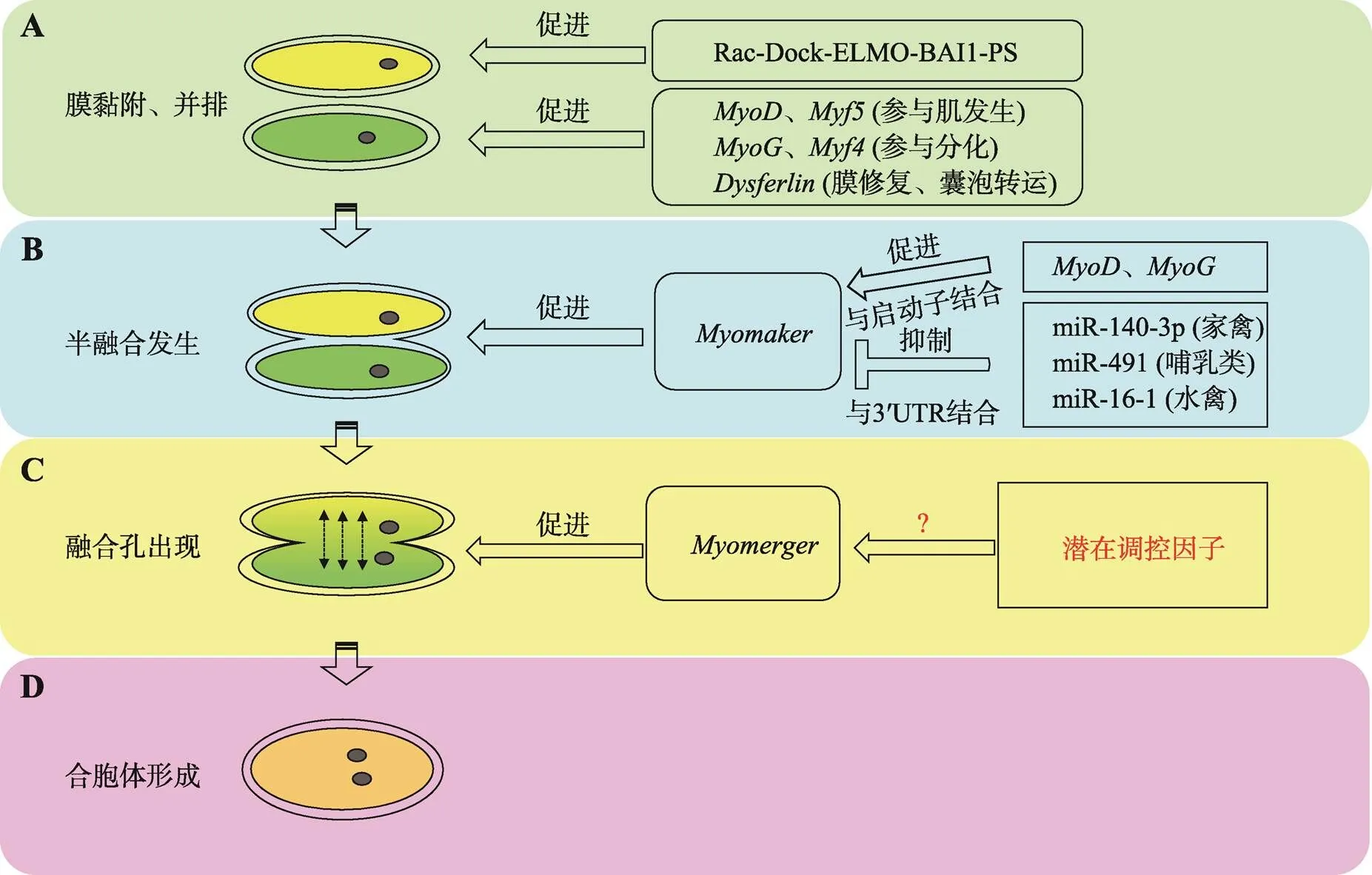
图3 Myomaker、Myomerger及其相关因子对成肌细胞融合过程的调控机制
A:多种调控因子参与细胞膜的黏附及并排过程;B:促进半融合发生;C:促进融合孔形成;D:细胞融合形成多核的合胞体。?:代表潜在调控机制。
6 结语与展望
近年来,和已成为研究成肌细胞融合的“明星分子”。Fineman-Ziter综合征[28]和(Duchenne muscular dystrophy, DMD) 是两种由成肌细胞融合受阻导致的遗传性肌肉疾病。和能使受损肌纤维的成肌细胞再次发生融合从而修复骨骼肌损伤,这不仅为研究骨骼肌再生的分子机制提供理论依据,也可为临床上治疗骨骼肌萎缩等相关疾病提供思路。虽然治疗肌营养不良症可通过外源细胞融合来促进新肌纤维形成[50,51],但这种方法所形成的肌纤维融合率极低,恢复肌肉功能也是难以实现。近年来和的发现为提高肌纤维融合率提供了新思路。和在细胞水平上能显著提高融合能力,从而诱导多核肌纤维形成。另外,过表达可以促进一些非肌源性细胞(如成纤维细胞)与骨骼肌在体内发生融合[52],由此为治疗骨骼肌损伤相关疾病提供新策略。对于肉用动物,其肌肉的良好生长发育关系到其本身健康和经济价值。由于肌纤维的组织学特征是决定肉质性状指标的关键因素[53],因此和促进多核肌纤维形成的潜能也有助于改善畜禽肉用性能。目前已发现在鸡、鹅等农业动物骨骼肌发育中发挥着重要作用,对此通过研究和对成肌细胞融合的影响机制,可为研究肌肉品质提供一定程度的理论依据,从而推动畜禽肉用品质的改善。
[1] Bi P, Ramirez-Martinez A, Li H, Cannavino J, McAnally JR, Shelton JM, Sánchez-Ortiz E, Bassel-Duby R, Olson EN. Control of muscle formation by the fusogenic micropeptide myomixer., 2017, 356(6335): 323–327.
[2] Bentzinger CF, Wang YX, Rudnicki MA. Building muscle: molecular regulation of myogenesis., 2012, 4(2): 441–441.
[3] Rochlin K, Yu S, Roy S, Baylies MK. Myoblast fusion: when it takes more to make one., 2010, 341(1): 66–83.
[4] Doles JD, Olwin BB. Muscle stem cells on the edge., 2015, 34: 24–28.
[5] Millay DP, O'Rourke JR, Sutherland LB, Bezprozvannaya S, Shelton JM, Bassel-Duby R, Olson EN. Myomaker is a membrane activator of myoblast fusion and muscle formation., 2013, 499(7458): 301–305.
[6] Millay DP, Gamage DG, Quinn ME, Min YL, Mitani Y, Bassel-Duby R, Olson EN. Structure-function analysis of myomaker domains required for myoblast fusion., 2016, 113(8): 2116–2121.
[7] Millay DP, Sutherland LB, Bassel-Duby R, Olson EN. Myomaker is essential for muscle regeneration., 2014, 28(15):1641–1646.
[8] Zhang Q, Vashisht AA, O’Rourke J, Corbel SY, Moran R, Romero A, Miraglia L, Zhang J, Durrant E, Schmedt C, Sampath SC. The microprotein Minion controls cell fusion and muscle formation., 2017, 8: 15664.
[9] Quinn ME, Goh Q, Kurosaka M, Gamage DG, Petrany MJ, Prasad V, Millay DP. Myomerger induces fusion of non- fusogenic cells and is required for skeletal muscle development., 2017, 8(8): 15665.
[10] Pavlath GK, Horsley V. Cell fusion in skeletal muscle: central role of NFATC2 in regulating muscle cell size., 2003, 2(5): 419–422.
[11] Borello U, Berarducci B, Murphy P, Bajard L, Buffa V, Piccolo S, Buckingham M, Cossu G. The Wnt/beta-catenin pathway regulates Gli-mediated Myf5 expression during somitogenesis., 2006, 133(18): 3723.
[12] Chargé SB, Rudnicki MA. Cellular and molecular regulation of muscle regeneration., 2004, 84(1): 209–238.
[13] Si YF, Wen HS, Du SJ. Genetic mutations in jamb, jamc, and myomaker revealed different roles on myoblast fusion and muscle growth., 2019, 21(1): 111–123.
[14] Yafe A, Shklover J, Weisman-Shomer P, Bengal E, Fry M. Differential binding of quadruplex structures of muscle- specific genes regulatory sequences by MyoD, MRF4 and myogenin., 2008, 36(12): 3916.
[15] Berkes CA, Tapscott SJ. MyoD and the transcriptional control of myogenesis., 2005, 16(4): 585–595.
[16] Charrasse S, Comunale F, Fortier M, Portales-Casamar E, Debant A, Gauthier-Rouvière C. M-cadherin activates Rac1 GTPase through the Rho-GEF trio during myoblast fusion., 2007, 18(5): 1734–1743.
[17] Charrasse S, Meriane M, Comunale F, Blangy A, Gauthier-Rouvière C. N-Cadherin-Dependent cell-cell contact regulates Rho GTPases and β-Catenin localization in mouse C2C12 myoblasts., 2002, 158(5): 953–965.
[18] Schwander M, Leu M, Stumm M, Dorchies OM, Ruegg UT, Schittny J, Müller U. β1 integrins regulate myoblast fusion and sarcomere assembly., 2003, 4(5): 673–685.
[19] Shao X, Davletov BA, Sutton RB, Südhof TC, Rizo J. Bipartite Ca2+-binding motif in C2 domains of synaptotagmin and protein kinase C., 1996, 273(5272): 248–251.
[20] Sutton RB, Davletov BA, Berghuis AM, Südhof TC, Sprang SR. Structure of the first C2 domain of synaptotagmin I: a novel Ca2+/phospholipid-binding fold., 1995, 80(6): 929–938.
[21] Davis BD, Doherty KR, Delmonte AJ, Mcnally EM. Calcium-sensitive phospholipid binding properties of normal and mutant ferlin C2 domains., 2002, 277(25): 22883–22888.
[22] Doherty KR, Cave A, Davis DB, Delmonte AJ, Posey A, Earley JU, Hadhazy M, McNally EM. Normal myoblast fusion requires myoferlin., 2005, 132(24): 5565–5575.
[23] Zhang W, Roy S. Myomaker is required for the fusion of fast-twitch myocytes in the zebrafish embryo., 2017, 423(1): 24–33.
[24] Landemaine A, Rescan PY, Gabillard JC. Myomakermediates fusion of fast myocytes in zebrafish embryos., 2014, 451(4): 480–484.
[25] Takei D, Nishi M, Fukada S, Doi M, Okamura H, Uezumi A, Zhang LD, Yoshida M, Miyazato M, Ichimura A, Takeshima H. Gm7325 is MyoD-dependently expressed in activated muscle satellite cells., 2017, 38(3): 215–219.
[26] He J, Wang F, Zhang P, Li WJ, Wang J, Li JL, Liu HG, Chen XP. MiR-491 inhibits skeletal muscle differentiation through targeting myomaker., 2017, 625–626: 30–38.
[27] Luo W, Li E, Nie QH, Zhang XQ. Myomaker, regulated by MYOD, MYOG and miR-140-3p, promotes chicken myoblast fusion., 2015, 16(11): 26186– 26201.
[28] Di GS, Connors S, Matsunami N, Cannavino J, Rose MF, Gilette NM, Artoni P, de Macena Sobreira NL, Chan WM, Webb BD, Robson CD, Cheng L, Van Ryzin C, Ramirez- Martinez A, Mohassel P, Leppert M, Scholand MB, Grunseich C, Ferreira CR, Hartman T, Hayes IM, Morgan T, Markie DM, Fagiolini M, Swift A, Chines PS, Speck-Martins CE, Collins FS, Jabs EW, Bönnemann CG, Olson EN, Carey JC, Robertson SP, Manoli I, Engle EC. A defect in myoblast fusion underlies Carey-Fineman-Ziter syndrome., 2017, 8: 16077.
[29] Parsons SA, Millay DP, Sargent MA, Naya FJ, Mcnally EM, Sweeney HL, Molkentin JD. Genetic disruption of calcineurin improves skeletal muscle pathology and cardiac disease in a mouse model of limb-girdle muscular dystrophy., 2007, 282(13): 10068–10078.
[30] Gamage DG, Leikina E, Quinn ME, Ratinov A, Chernomordik LV, Millay DP. Insights into the localization and function of myomaker during myoblast fusion., 2017, 292(42): 17272–17289.
[31] Leikina E, Gamage DG, Prasad V, Goykhberg J, Crowe M, Diao J, Kozlov MM, Chernomordik LV, Millay DP. Myomaker and Myomerger work independently to control distinct steps of membrane remodeling during myoblast fusion., 2018, 46(6): 767–780.e7.
[32] Shi J, Bi P, Pei JM, Li H, Grishin NV, Bassel-Duby R, Chen EH, Olson EN. Requirement of the fusogenic micropeptide myomixer for muscle formation in zebrafish., 2017, 114(45): 11950–11955.
[33] Krauss RS, Joseph GA, Goel AJ. Keep your friends close: cell-cell contact and skeletal myogenesis., 2017, 9(2): a029298.
[34] Srinivas BP, Woo J, Leong WY, Roy S. A conserved molecular pathway mediates myoblast fusion in insects and vertebrates., 2007, 39(6): 781–786.
[35] Powell GT, Wright GJ. Jamb and jamc are essential for vertebrate myocyte fusion., 2011, 9(12): e1001216.
[36] Hollnagel A, Grund C, Franke WW, Arnold HH. The cell adhesion molecule M-cadherin is not essential for muscle development and regeneration., 2002, 22(13): 4760–4770.
[37] Charlton CA, Mohler WA, Radice GL, Hynes RO, Blau HM. Fusion competence of myoblasts rendered genetically null for N-cadherin in culture., 1997, 138(2): 331–336.
[38] Cárdenas AM, González-Jamett AM, Cea LA, Bevilacqua JA, Caviedes P. Dysferlin function in skeletal muscle: Possible pathological mechanisms and therapeutical targets in dysferlinopathies., 2016, 283: 246–254.
[39] De Luna N, Gallardo E, Soriano M, Dominguez-Perles R, de la Torre C, Rojas-García R, García-Verdugo JM, Illa I. Absence of dysferlin alters myogenin expression and delays human muscle differentiation ""., 2006, 281(25): 17092–17098.
[40] Hochreiter-Hufford AE, Lee CS, Kinchen JM, Sokolowski JD, Arandjelovic S, Call JA, Klibanov AL, Yan Z, Mandell JW, Ravichandran KS. Phosphatidylserine receptor BAI1 and apoptotic cells as new promoters of myoblast fusion., 2013, 497(7448): 263–267.
[41] Park SY, Yun Y, Lim JS, Kim MJ, Kim SY, Kim JE, Kim IS. Stabilin-2 modulates the efficiency of myoblast fusion during myogenic differentiation and muscle regeneration., 2016, 7: 10871.
[42] Kim GW, Nam GH, Kim IS, Park SY. Xk-related protein 8 regulates myoblast differentiation and survival., 2017, 284(21): 3575–3586.
[43] Jeong J, Conboy IM. Phosphatidylserine directly and positively regulates fusion of myoblasts into myotubes., 2011, 414(1): 9–13.
[44] Williams AH, Liu N, van Rooij E, Olson EN. MicroRNA control of muscle development and disease., 2009, 21(3): 461–469.
[45] Goljanek-Whysall K, Sweetman D, Münsterberg AE. MicroRNAs in skeletal muscle differentiation and disease., 2012, 123(11): 611–625.
[46] Li XY, Fu LL, Cheng HJ, Zhao SH. Advances on microRNA in regulating mammalian skeletal muscle development., 2017, 39(11): 1046–1053.李新云, 付亮亮, 程会军, 赵书红. MicroRNA调控哺乳动物骨骼肌发育. 遗传, 2017, 39(11): 1046–1053.
[47] Chen JF, Mandel EM, Thomson JM, Wu QL, Callis TE, Hammond SM, Conlon FL, Wang DZ. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation., 2006, 38(2): 228–233.
[48] van Rooij E, Sutherland LB, Qi XX, Richardson JA, Hill J, Olson EN. Control of stress-dependent cardiac growth and gene expression by a microRNA., 2007, 316(5824): 575–579.
[49] Ke HE, Ren T, Zhu SH, Liang SR, Zhao AY. Transiently expressed pattern during myogenesis and candidate miRNAs of Tmem8C in goose., 2017, 96(1): 39–46.
[50] Gibson AJ, Karasinski J, Relvas J, Moss J, Sherratt TG, Strong PN, Watt DJ. Dermal fibroblasts convert to a myogenic lineage in mdx mouse muscle., 1995, 108(1): 207–214.
[51] Gussoni E, Soneoka Y, Strickland CD, Buzney EA, Khan MK, Flint AF, Kunkel LM, Mulligan RC. Dystrophin expression in the mdx mouse restored by stem cell transplantation., 1999, 401(6751): 390–394.
[52] Mitani Y, Vagnozzi RJ, Millay DP.myomaker- mediated heterologous fusion and nuclear reprogramming., 2017, 31(1): 400–411.
[53] Shen LY, Zhang SH, Wu ZH, Zheng MY, Li XW, Zhu L. The influence of satellite cells on meat quality and its differential regulation., 2013, 35(9): 1081–1086.沈林園, 张顺华, 吴泽辉, 郑梦月, 李学伟, 朱砺. 骨骼肌卫星细胞对肉品质的影响及其分化调控. 遗传, 2013, 35(9): 1081–1086.
Molecular regulation mechanism ofandin myoblast fusion
Yan Zhu1, Jinwei Zhang1, Jing Qi1, Xuewei Li1, Lei Chen2, Mingzhou Li1, Jideng Ma1
Myogenesis is a complex physiological process that is mainly involved in the proliferation of myogenic stem cells to form myoblasts, which then differentiated and fused to form multinucleated myotubes. Many proteins have been found to be involved in myoblast fusion, but none of them are muscle-specific fusion proteins. In recent years, two muscle-specific transmembrane proteins, i.e. Myomaker and Myomerger, have been discovered and identified, which can coordinate and promote the fusion of myoblasts and thus participate in the process of myogenesis. In this review, we summarize the research progress ofandin myogenesis, including their expression patterns and functional domains, as well as their participation in myoblast fusion mechanisms, aiming to provide relevant ideas for in-depth study of the myogenesis process and treatment of diseases related to myoblast fusion.
myogenesis;;; myoblast fusion
2019-08-08;
2019-10-25
四川省省院省校科技合作研发项目(编号:2017JZ0025),四川省科技支持计划项目(编号:2016NYZ0042,2017NZDZX0002),重庆市农业发展基金会项目(编号:12404,17430)和四川省科技厅重点研发项目(编号:2019YFN0035)资助[Supported by Research and Development Project of Scientific and Technological Cooperation between Sichuan Provincial Colleges and Universities (No. 2017JZ0025), the Science and Technology Support Program of Sichuan (Nos. 2016NYZ0042, 2017NZDZX0002), Chongqing Agricultural Development Foundation (Nos. 12404, 17430) and the Key Research and Development Projects of Sichuan Science and Technology Department (No. 2019YFN0035)]
朱艳,硕士研究生,专业方向:动物遗传育种与繁殖。E-mail: zhuyan_494062079@163.com
马继登,博士,副教授,研究方向:动物遗传育种与繁殖。E-mail: jideng.ma@sicau.edu.cn
10.16288/j.yczz.19-232
2019/11/28 13:30:00
URI: http://kns.cnki.net/kcms/detail/11.1913.r.20191127.1143.002.html
(责任编委: 赵要风)

