DHP及其核受体诱导斑马鱼促性腺激素释放激素mRNA表达
方敏敏 王翠丽
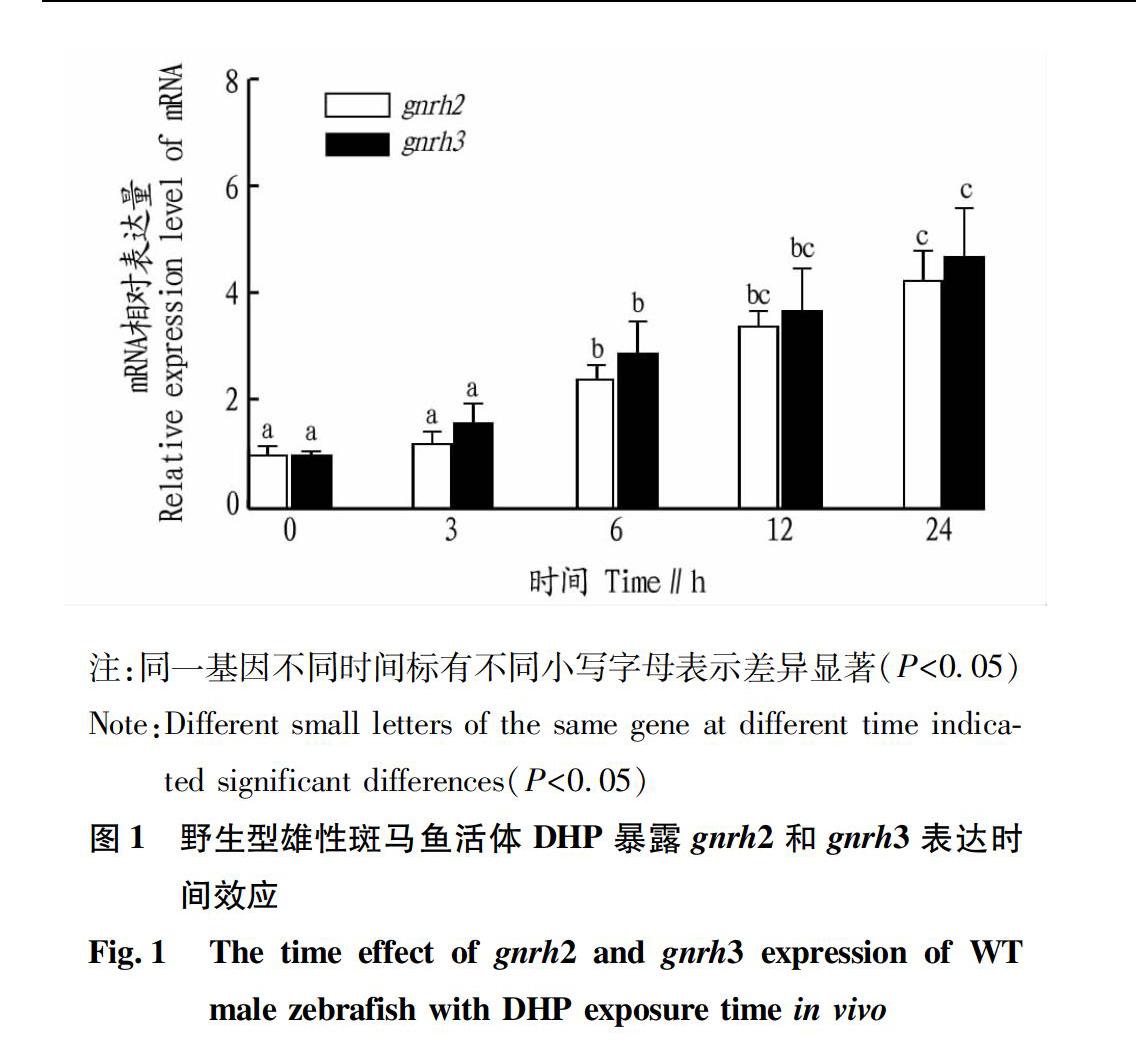
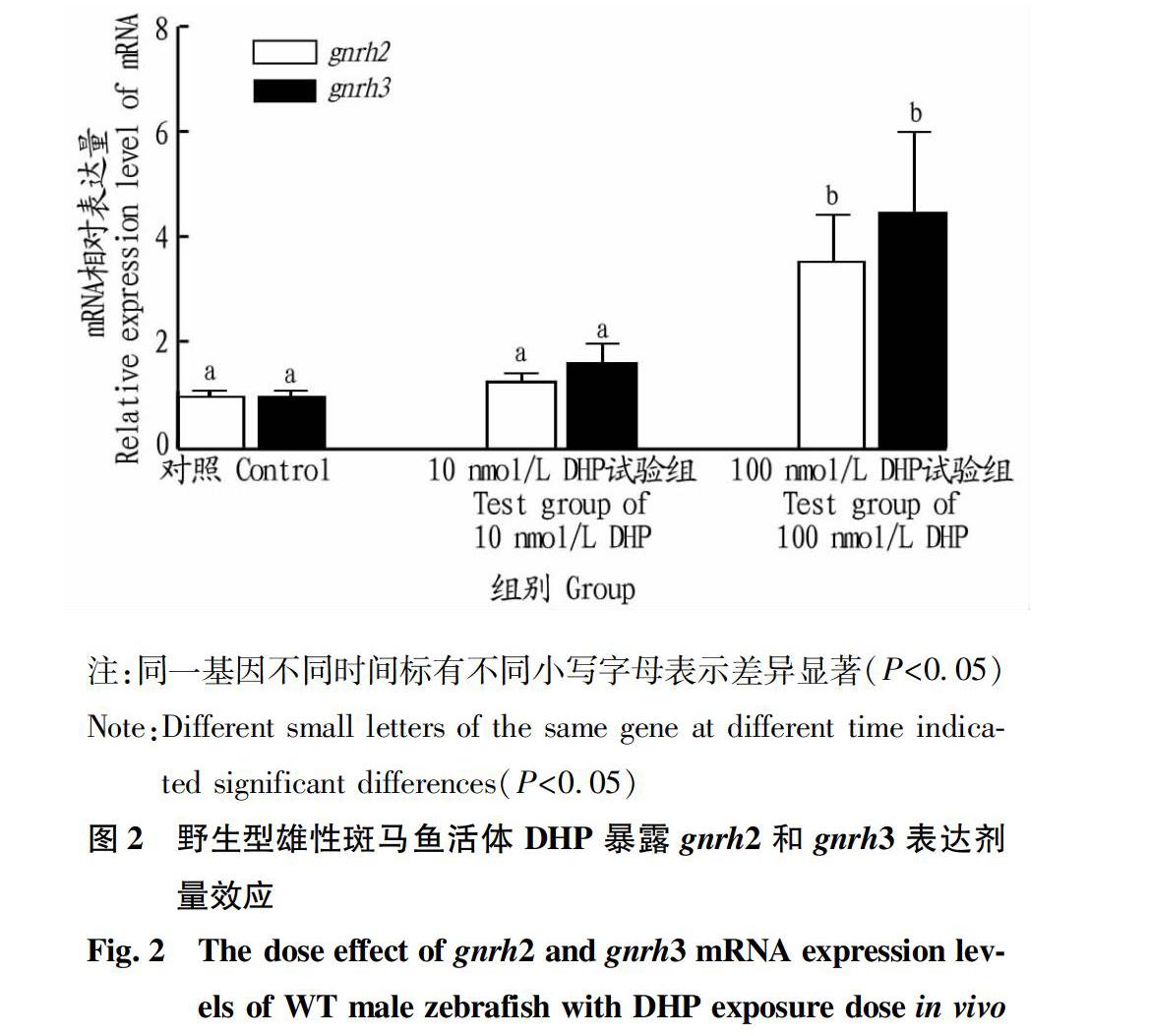
摘要 為了明确17α,20β双羟孕酮(DHP)及其核受体调控促性腺激素释放激素mRNA在雄性斑马鱼脑组织中的表达机制,采用实时荧光定量PCR方法、类固醇激素活体和离体暴露方法进行试验。结果表明,野生型雄性斑马鱼活体暴露于100 nmol/L DHP水溶液,伴随暴露时间的延长,gnrh2和gnrh3 mRNA表达量呈逐渐升高趋势,24 h出现表达最高峰;野生型雄性斑马鱼活体分别暴露于10和100 nmol/L DHP水溶液24 h。与对照组相比,100 nmol/L DHP试验组gnrh2和gnrh3 mRNA表达量升高,差异显著(P<0.05),而10 nmol/L DHP试验组无显著变化(P>0.05);野生型雄性斑马鱼活体暴露于100 nmol/L DHP与100 nmol/L RU486混合水溶液24 h,试验组gnrh2和gnrh3 mRNA表达量与对照组相比无显著变化(P>0.05);野生型和孕酮核受体敲除型(pgr-/-)雄性斑马鱼活体分别暴露于100 nmol/L DHP水溶液24 h,与野生型试验组相比pgr-/-型试验组gnrh2和gnrh3 mRNA表达量显著降低(P<0.05);野生型和pgr-/-型雄性斑马鱼脑组织离体暴露于含100 nmol/L DHP的L-15培养液24 h,与野生型试验组相比pgr-/-型试验组gnrh2和gnrh3 mRNA表达量显著降低(P<0.05)。由此可见,DHP与核受体结合可直接调控雄性斑马鱼脑组织中促性腺激素释放激素gnrh2和gnrh3 mRNA表达。
关键词 斑马鱼;17α,20β双羟孕酮;孕酮核受体;促性腺激素释放激素
中图分类号 S 917文献标识码 A
文章编号 0517-6611(2019)23-0099-04
doi:10.3969/j.issn.0517-6611.2019.23.029
开放科学(资源服务)标识码(OSID):
mRNA Expression of Gonadotropin releasing Hormone in Zebrafish Induced by DHP and Its Nuclear Receptor
FANG Min min1,2, WANG Cui li1,2
(1.Institute of Geography and Oceanography, Nanning Normal University, Nanning,Guangxi530000;2. Key Laboratory of Environment Change and Resources Use in Beibu Gulf, Nanning Normal University, Nanning,Guangxi530000)
Abstract In order to clarify that 17α,20β dihydroxyproterone (DHP) and its nuclear receptorregulated expression mechanism of gonadotropin releasing hormone (GnRH) mRNA in male zebrafish,real time PCR, steroid hormone exposure in vivo and in vitro were used in this test. The results showed that it took 24 h for gnrh2 and 24 h for gnrh3 to respond significantly (P<0.05). 24 h 100 nmol/LDHP exposure significantly increased the expression of gnrh2 and gnrh3 mRNA (P<0.05).
With and without DHP in vivo treatment, compared with wild type zebrafish treatment group, mRNA expressions of gnrh2 and gnrh3 were significantly decreased in pgr-/- zebrafish treatment group (P < 0.05), while that in wild type zebrafish and pgr-/- zebrafish brain tissue were all exposed to L 15 culture medium containing 100 nmol/L DHP for 24 h, compared with wild type zebrafish treatment group, mRNA expressions of gnrh2 and gnrh3 were significantly decreased in pgr-/- zebrafish treatment group (P < 0.05). DHP and its nuclear receptors could regulate mRNA expressions of gonadotropin releasing hormone in male zebrafish.
Key words Zebrafish;17α,20β dihydroxy 4 pregnen 3 one;Nuclear progesterone receptor;Gonadotropin releasing hormone
17α,20β双羟孕酮(DHP)是鱼类精巢所特有的调控生殖系统的暂时性孕激素[1],在雄鱼精原细胞增殖分化期,血清中DHP的水平会出现一个短暂和显著的升高过程[2-3],这不仅对诱导B型精原细胞分化为初级精母细胞起决定作用[4],而且对精子成熟、排精并获能也起到重要的作用[5-6]。Wang等[7]研究表明DHP、孕酮核受体和促性腺激素释放激素(gonadotropin releasing hormone,GnRH)共同参与调控促性腺激素(gonadotropins hormone,GTH)mRNA表达,进而调控雄鱼生殖周期。
哺乳动物下丘脑分泌的促性腺激素释放激素可通过脉冲形式进入垂体门脉系统,并与垂体中的受体结合促使垂体产生促性腺激素并对生殖起到重要的调控作用[8-12]。鱼类的相关研究已表明,鱼类虽缺少垂体门脉系统,但脑组织中促性腺激素释放激素在调控垂体促性腺激素产生、性腺组织发育和性成熟中仍起至关重要的作用[13]。笔者以雄性斑马鱼为研究对象,研究雄性斑马鱼在DHP及其核受体的调控作用下下丘脑组织中促性腺激素释放激素2(gonadotropin releasing hormone 2,GnRH2)和促性腺激素释放激素3(gonadotropin releasing hormone 3,GnRH3)mRNA表达的变化规律,探索其在脑组织中的信号调控通路,以期丰富DHP及其核受体在雄鱼生殖内分泌中的作用机理。
1 材料与方法
1.1 材料
1.1.1 试验动物。
共用72尾野生型(WT)图宾根家系(Tüebingen)成年(3~4月龄)雄性斑马鱼、6尾孕酮核受体敲除型(pgr-/-)成年(3~4月龄)雄性斑马鱼,孕酮核受体基因敲除方法详见参考文献[14]。试验动物饲养条件如下:室内恒温28 ℃;光照14 h(08:00—22:00),非光照10 h(22:00—次日08:00);水体为紫外灭菌处理的去离子循环水,pH 7.2~7.6;成年斑马鱼每天早上(08:30—09:00)、中午(12:00—12:30)和傍晚(18:30—19:00)各投喂热带鱼食3次,饲养条件详见参考文献[15]。
1.1.2 药品。
间氨基苯甲酸乙酯甲磺酸盐(MS-222)、17α,20β雙羟孕酮(DHP)、米服司酮(RU486)购自Sigma公司。
1.1.3 主要试剂。
RNAzol试剂,购自MRC公司;SYBR Select Master Mix试剂盒,购自ABI公司;QIAquick Gel Extraction 试剂盒,购自QIAGEN公司;rTaq酶、10×PCR Buffer、2.5 mmol/L dNTP、DNA Marker、PMD19-T克隆载体,均购自TaKaRa公司;DH5α感受态细胞、X-gal,购自北京全式金公司;L-15粉末,购自GIBCO公司;琼脂糖、DEPC、Hepes、D-Hank缓冲液、青霉素、链霉素,均购自Solarbio公司;引物由上海英骏生物技术有限公司合成。
1.1.4 主要仪器。
电泳仪(型号为Powerpac HV 164-5056),购自Bio-Rad公司;超微量紫外分光光度计(型号为NanoDrop-1000),购自NanoDrop公司;全自动凝胶成像系统(型号为Syngene Genius),购自Syngene公司;低温恒温槽(型号为DC-1006),购自无锡沃信仪器有限公司;梯度热循环仪(型号为T100),购自Bio-Rad公司;荧光定量PCR仪(型号为7500FAST),购自ABI公司;高速离心机(型号为5810R),购自Eppendorf公司;体视显微镜(型号为CX22),购自Olympus公司;多功能显微镜(型号为BX51),购自Olympus公司;离心机(型号为MiniSpin plus),购自Eppendorf公司。
1.2 方法
1.2.1 野生型雄性斑马鱼DHP活体暴露时间效应。
13:00随机取30尾活体野生型雄性斑马鱼放入暴露鱼缸(4 L)中,加入DHP,使水体中DHP终浓度为100 nmol/L,每次取样6尾,暴露0、3、6、12和24 h取样,用MS-222溶液麻醉,解剖取脑组织置于液氮中速冻,-80 ℃下保存,用于gnrh2和gnrh3基因mRNA相对表达分析。
1.2.2 野生型雄性斑马鱼DHP活体暴露剂量效应。
13:00随机取18尾活体野生型雄性斑马鱼放入3个暴露鱼缸(4 L)中,加入DHP,使水体中DHP终浓度分别为0、10和100 nmol/L,连续暴露24 h后,用MS-222溶液麻醉,解剖取脑组织置于液氮中速冻,-80 ℃下保存,用于gnrh2和gnrh3基因mRNA相对表达分析。
1.2.3 野生型雄性斑马鱼活体DHP和RU486暴露。
13:00随机取12尾活体野生型雄性斑马鱼放入2个暴露鱼缸(4 L)中,加入DHP和RU486,使水体中类固醇终浓度分别为0 nmol/L(DHP)+0 nmol/L(RU486)、100 nmol/L(DHP)+100 nmol/L(RU486),连续暴露24 h,用MS-222溶液麻醉,解剖取脑组织置于液氮中速冻,-80 ℃下保存,用于gnrh2和gnrh3基因mRNA相对表达分析。
1.2.4 野生型和孕酮核受体敲除型雄性斑马鱼DHP活体暴露。
13:00随机取6尾活体野生型和6尾活体孕酮核受体敲除型(pgr-/-)雄性斑马鱼放入2个暴露鱼缸(4 L)中,分别加入DHP,使水体中DHP终浓度为100 nmol/L,连续暴露24 h,用MS-222溶液麻醉,解剖取脑组织置于液氮中速冻,-80 ℃保存,用于gnrh2和gnrh3基因mRNA相对表达分析。
参考文献
[1] CHEN S X,BOGERD J,GARCA LPEZ ,et al.Molecular cloning and functional characterization of a zebrafish nuclear progesterone receptor[J].Biol Reprod,2010,82:171-181.
[2] SCOTT A P,SUMPTER J P.Seasonal variations in testicular germ cell stages and in plasma concentrations of sex steroids in male rainbow trout(Salmo gairdneri)maturing at 2 years old[J].Gen Comp Endocr,1989,73(1):46-58.
[3] AMER M A,MIURA T,MIURA C,et a1.Involvement of sex steroid hormones in the early stages of spermatogenesis in Japanese huchen(Hucho perryi)[J].Biol Reprod,2001,65(4):1057-1066.
[4] MIURA T,HIGUCHI M,OZAKI Y,et al.Progestin is an essential factor for the initiation of the meiosis in spermatogenetic cells of the eel[J].PNAS,2006,103(19):7333-7338.
[5] SCHMIDT P J,IDIER D R.Steroid hormones in the plasma of salmon at various stages of maturation[J].Gen Comp Endocr,1962,2(2):201-214.
[6] 舒琥,劉晓春,赵会宏,等.注射LHRHa、17-P及其它药物组合诱导赤点石斑鱼排精研究[J].中山大学学报(自然科学版),2004,43(6):41-44.
[7] WANG C L,LIU D T,CHEN W T,et al.Progestin increases the expression of gonadotropins in pituitaries of male zebrafish[J].Journal of endocrinology,2016,230:143-156.
[8] GOODMAN R L,KARSCH F J.Pulsatile secretion of luteinizing hormone:Differential suppression by ovarian steroids[J].Endocrinology,1980,107(5):1286-1290.
[9] LEVINE J E,PAU K Y,RAMIREZ V D,et al.Simultaneous measurement of luteinizing hormone releasing hormone and luteinizing hormone release in unanesthetized,ovariectomized sheep[J].Endocrinology,1982,111(5):1449-1455.
[10] GROSS K M,MATSUMOTO A M.BREMNER W J.Differential control of luteinizing hormone and follicle stimulating hormone secretion by luteinizing hormone releasing hormone pulse frequency in man[J].J Clin Endocr Metab,1987,64(4):675-680.
[11] MARSHALL J C,KELCH R P.Gonadotropin releasing hormone:Role of pulsatile secretion in the regulation of reproduction[J].N Engl J Med,1986,315:1459-1468.
[12] WILDT L,HUSLER A,MARSHALL G,et al.Frequency and amplitude of gonadotropin releasing hormone stimulation and gonadotropin secretion in the rhesus monkey[J].Endocrinology,1981,109(2):376-385.
[13] 林浩然.鱼类生理学[M].北京:科学出版社,2011.
[14] HUANG P,XIAO A,ZHOU M G,et al.Heritable gene targeting in zebrafish using customized TALENs[J].Nat Biotechnol,2011,29(8):699-700.
[15] WESTERFIELD M.The zebrafish book:A guide for the laboratory use of zebrafish(Danio rerio)[M].Eugene:University of Oregon Press,2000.
[16] 谢保胜,段瑞君,藤原滋树.斑马鱼促性腺激素释放激素基因的克隆与表达[J].青海医学院学报,2009,30(1):9-13.
[17] 黎双飞,胡炜,胡章立,等.脊椎动物GnRH肽的分子多态性和功能[J].深圳大学学报(理工版),2006,23(1):57-63.
[18] THOMAS P.Characteristics of membrane progestin receptor alpha(mPRα)and progesterone membrane receptor component 1(PGMRC1)and their roles in mediating rapid progestin actions[J].Front Neuroendocrin,2008,29(2):292-312.
[19] ZHU Y,HANNA R N,SCHAAF M J M,et al.Candidates for membrane progestin receptors—Past approaches and future challenges[J].Comp BiochemPhysiol C:Toxicol Pharmacol,2008,148(4):381-389.
[20] DULKA J G,STACEY N E,SORENSEN P W,et al.A steroid sex pheromone synchronizes male female spawning readiness in goldfish[J].Nature,1987,325:251-253.
[21] CHEN S X,BOGERD J,GARCA LPEZ ,et al.Molecular cloning and functional characterization of a zebrafish nuclear progesterone receptor[J].Biol Reprod,2010,82(1):171-181.

