牛乳中高产共轭亚油酸乳酸杆菌的研究
马青雯,杨子彪,钱白萍,吉佳佳,张卜文,黄艾祥,*
(1.云南农业大学食品科学技术学院,云南昆明650201;2.云南大理农林职业技术学院,云南大理671002;3.云南省产品质量监督检验研究院,云南昆明650223)
共轭亚油酸(conjugated linoleic acid,CLA)被称为“二十一世纪的新型营养素”[1],主要存在于乳及乳制品和反刍动物的肉中[2]。随着人民生活水平的提高和对优质不饱和脂肪酸需求的增加,CLA 因其具有抗癌[3]、降脂[4]、抗氧化[5]等众多生理功能,逐渐成为研究热点[6],CLA 在药物研发、营养保健等行业都有巨大的研究价值。
目前国内外的CLA 保健品均为化学合成,由于化学合成过程中得到较多的副产物,这为CLA 的纯化增加了成本[7]。由于微生物合成CLA 可得到更纯的CLA异构体,且反应条件较为温和,许多研究者将CLA 合成途径的研究转向微生物合成CLA[6]。Lee 等[8]和刘春晓[9]的结果表明许多乳酸菌具有产CLA 的能力。本研究通过筛选云南7 个地区的牛乳、水牛乳样品中分离的40 株乳酸杆菌,得到产CLA 乳酸杆菌,并分析影响菌株产生CLA 的因素。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
分离自云南省7 个地区的水牛乳、牛乳样品中的40 株乳酸杆菌由云南省皇氏来思尔乳业有限公司提供,具体来源如表1 所示。

表1 乳酸杆菌来源及采样地点Table 1 Lactobacillus collection site
1.1.2 试剂
油酸(97 %)、共轭亚油酸(98 %)、MRS(de man rogosa sharpe)培养基:Sigma 公司;吐温-80、正己烷:天津市风船化学试剂科技有限公司。
1.2 仪器与设备
主要仪器设备如表2 所示。

表2 主要仪器及设备Table 2 Equipments and instruments in the experiment
1.3 方法
1.3.1 产CLA 乳酸菌的筛选
1.3.1.1 亚油酸和CLA 紫外吸收峰的确定
用正己烷将亚油酸(linoleic acid,LA)和CLA 标准品稀释至10 μg/mL。以正己烷为参比,利用紫外分光光度法在190 nm~1 100 nm 的波长范围内,波长间隔2 nm 的条件下分别对LA,CLA 标准品和LA、CLA 混合样品进行全波长扫描确定LA 和CLA 吸收峰[10],探究两种物质在一定波长范围内是否存在干扰。
1.3.1.2 CLA 标准曲线的绘制
调整文献[11]的方法,准确称取2.50 mgCLA 标准品于25 mL 容量瓶中,用正己烷定容后,分别从中吸取0.25、0.50、0.75、1.25、2.50、3.75、5.00、6.25 mL 溶液于25 mL 容量瓶中,用正己烷定容,即得1、2、3、5、10、15、20、25 μg/mL 的CLA 溶液。以正己烷为参比,在全波长扫描结果得到的CLA 最大吸收波长下测定不同浓度CLA 溶液的吸光度。以CLA 浓度为横坐标、吸光度为纵坐标,绘制CLA 标准曲线。
1.3.1.3 乳化液的制备
调整文献[12-13]的方法,将0.10%(吐温-80/液体培养基)吐温-80 和0.20%[14](LA/液体培养基)LA 混合后,加入少量蒸馏水再次混合后在冰水浴下进行超声乳化:超声功率60 W,超声工作时间10 s,间歇时间15 s,总超声工作时间10 min。
1.3.1.4 发酵
将菌种活化至第三代,镜检后按5%[15]的接种量接种于35 mL 添加了0.20%LA 乳化液的MRS 液体培养基中,37 ℃下培养48 h。
1.3.1.5 脂肪酸的萃取
发酵培养结束后离心(4 000 r/min,30 min),在文献[16-17]的基础上略作调整:取30 mL 发酵培养液和30 mL 正己烷加入250 mL 分液漏斗中振荡萃取,静置20 min 后再加入30 mL 正己烷进行第二次萃取,其他步骤同上,3 次萃取结束后,待液体静置分层,弃去下层液体,收集上层有机相并用少量蒸馏水洗分液漏斗3 次,所得上层正己烷层即为脂肪酸萃取液。加入少量无水硫酸钠吸水干燥脂肪酸萃取液,将干燥后的脂肪酸萃取液用0.22 μm 滤膜过滤后移至50 mL 的容量瓶,并用正己烷定容后进行紫外检测。以未接种的发酵液为参比,于CLA 最大吸收波长下测定萃取液吸光度。
1.3.2 高产菌株中CLA 主要异构体的检测
1.3.2.1 脂肪酸的甲酯化
将1.3.1.5 中得到的脂肪酸萃取液蒸馏,将蒸馏后得到的脂肪采用文献[18]中的方法进行甲酯化[6]。甲酯化结束后加入300 μL 正己烷,振荡5 min 后加入无水硫酸钠干燥,干燥结束后用0.22 μm 滤膜过滤后移至10 mL 容量瓶,用正己烷定容后将样品于4 ℃下保存,备检。
1.3.2.2 CLA 异构体的测定
以未接种CLA 最高产菌株的发酵液为对照组(a),接种CLA 最高产菌株的发酵液为试验组(b)。调整GB 5009.168-2016《食品安全国家标准食品中脂肪酸的测定》和文献[19-20]的方法,利用气相色谱法分析高产菌株中CLA 的主要异构体。色谱柱为熔融石英毛细管柱(110 mm×0.25 mm×0.2 μm),进样量为1 μL,载气为氦气(流速:2.0 mL/min)。将初始温度调节至120 ℃,保持8 min 后以6 ℃/min 的速率升至200 ℃,保持15 min;以4/min 的速率升高温度,保持10 min,直到温度升至220 ℃;最后以4 ℃/min 的速度升高温度并保持5 min,直至温度升至240 ℃。分流比为50 ∶1。利用面积归一化法计算各组分所占比例。
2 结果与分析
2.1 LA 和CLA 最大吸收峰
LA 和CLA 标准品全波长扫描图如图1、图2 所示;图3 为LA 和CLA 标准品混合后全波长扫描图。
由图1 可知LA 标准品在208 nm 处有最大收峰,由图2 可知CLA 标准品在233 nm 处有最大吸收峰,由图3 可知LA 和CLA 两种物质的最大吸峰不在同一波长下。由此可知:在233 nm 处LA 不会对CLA 的吸收峰造成干扰,后续试验可采用紫外分光光度法于233 nm 处测定发酵液中CLA 的吸光度。
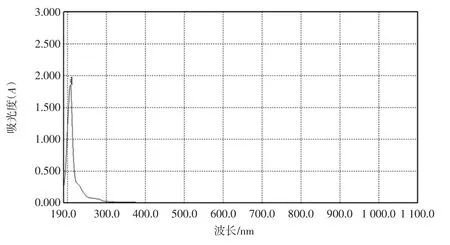
图1 LA 全波长扫描图Fig.1 LA full wavelength scan

图2 CLA 全波长扫描图Fig.2 CLA full wavelength scan

图3 混合标品全波长扫描图Fig.3 Mixed standard full wavelength scan
2.2 CLA 标准曲线
CLA 在233 nm 处标准曲线图如图4 所示。
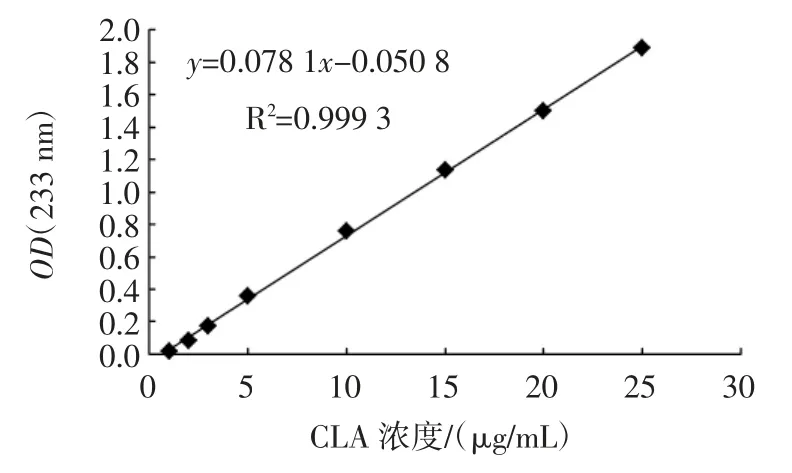
图4 CLA 的标准曲线Fig.4 Conjugated linoleic acid standard curve
由图4 可知,在波长233 nm 处CLA 标准曲线R2为0.999 3,线性关系良好;线性回归方程为y=0.078 1x-0.050 8,式中:x 为CLA 标准品浓度,μg/mL;y 为吸光度。在后续试验中可使用该方程计算发酵液中CLA 的吸光度,从而推算发酵液中CLA 的含量。
2.3 产CLA 菌株
CLA 产生菌及产量如图5 所示。
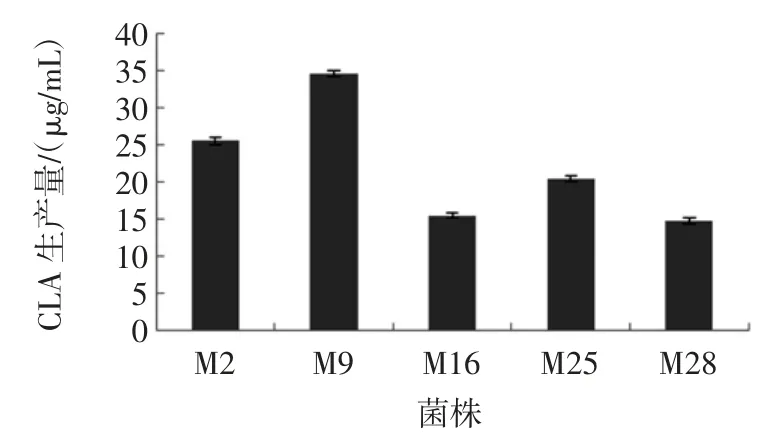
图5 CLA 产生菌株及产量Fig.5 Transformation generated by the strain
由图5 可知,分离自牛乳的40 株乳酸菌中有5 株乳酸菌产CLA。M2、M9、M16、M25、M28 产量分别为:25.54、34.56、15.48、20.46、14.79 μg/mL,其中M9 为高产菌株。结合表1 可知,M2 为植物乳杆菌,M9、M6、M25、M28 为发酵乳杆菌,故部分植物乳杆菌和发酵乳杆菌均有产生CLA 的能力。M25、M28 均为发酵乳杆菌,且分离自同一地区同种样品,但CLA 产量不同;而与M25、M28 分离自同一地区同种样品的其余发酵乳杆菌和植物乳杆菌均不产CLA,由此可得:不是所有的植物乳杆菌和发酵乳杆菌均具有产CLA 的能力,且分离自同种样品的同种菌产CLA 的能力也不同。分离自不同地区牛乳中的M9(发酵乳杆菌)、M16(发酵乳杆菌)CLA 产量也不同,Hosseini 等[21]、Liu 等[22]在研究中指出CLA 产量的差异与菌种的来源、生长环境有关;此外CLA 产量差异还与菌种基因结构有关,因为基因结构的差异影响菌种代谢[23-24]。5 株CLA 产生菌来自4 个不同的地区,各地区海拔、温度、湿度等[25]均存在差异,而相同的菌种自身的基因结构等也存在差异,一些菌株可能因基因片段插入[26]、环境诱变[27]等因素的影响进而导致CLA 异构酶[28]编码基因产生差异,从而造成菌株代谢差异。
2.4 高产菌株中CLA 主要异构体
标准品气相谱图如图6 所示,对照组(a)色谱图如图7 所示,试验组(b)色谱图如图8 所示,试验组和对照组的各组分占比如表3 所示。
由图6 可得,C18 ∶1(油酸)保留时间为32.04 min、C18 ∶2(亚油酸)保留时间为34.31 min,C18 ∶2 9c,11t(CLA 异构体)保留时间为39.00 min。由图7 可得未接种的发酵液中主要含有油酸和亚油酸两种物质,其中油酸和亚油酸所占比例分别为:6.17 %、93.83 %(表3)。由M9 的色谱图(图8)可知:发酵产物主要含有:油酸,亚油酸和C18 ∶2 9c,11t,三者所占比例分别为:4.85 %、93.43%、1.71%。M9 发酵液与空白相比,M9发酵液中亚油酸和油酸的占比均降低,而有9c,11t-CLA 产生,这验证了Dipasquale 等[29]提出的:油酸和亚油酸可能是菌株产生CLA 的底物,因为亚油酸、油酸和9c,11t-CLA 均为18 碳酸,在菌株内的共轭亚油酸异构酶的作用下,可将碳元素含量相同的亚油酸、油酸异构为9c,11t-CLA。值得注意的是9c,11t-CLA 是CLA 主要的活性成分之一[30],利用此菌株作为媒介进而发酵产生CLA 有很高的应用价值。

图6 标准品色谱图Fig.6 Standard chromatograms
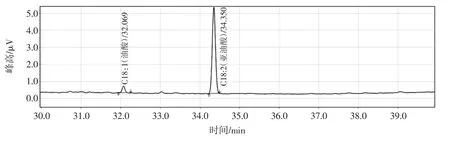
图7 对照组色谱图Fig.7 Control group chromatogram

图8 试验组色谱图Fig.8 Experimental group chromatogram

表3 试验组和对照组的各组分占比表Table 3 Comparison of the components of the experimental group and the control group
3 结论
从奶牛中分离鉴定得到的部分乳酸杆菌具有产CLA 的能力,不同的菌产CLA 的能力不同。高产菌株M9 中CLA 的异构体主要为9c,11t-CLA,与对照组相比,油酸、亚油酸和C18:2 9c,11t 的含量变化证明油酸、亚油酸是M9 生成C18:2 9c,11t 的底物。由于C18:2 9c,11t 是CLA 的主要功能活性物质之一,在今后的研究中可通过优化培养条件提高M9 中CLA 产量,从而得到含量更高、更纯的C18:2 9c,11t。

