L-赖氨酸发酵培养基的响应面优化
李学朋1,白红兵,韩 杨
(1.内蒙古阜丰生物科技有限公司,内蒙古自治区 呼和浩特 010030;2.齐齐哈尔龙江阜丰生物科技有限公司,黑龙江 齐齐哈尔 161031)
L-赖氨酸作为人体第一氨基酸,具有重要生理功能,且应用广泛。我国赖氨酸年产量达193万吨,产品90%用于饲料养殖业[1-2]。目前工业生产L-赖氨酸的主要方法是发酵法,通过此方法生产赖氨酸的微生物主要有三种,分别是谷氨酸棒状杆菌、黄色短杆菌、大肠杆菌[3]。国内工业生产中L-赖氨酸产酸率已经达到220~240 g/L,转化率在69%以上,提取收率在92%以上,生产技术已经达到国际领先水平,赖氨酸产量居世界第一。但是培养基的成本直接影响着企业的发展,培养基原料成本升高,可直接导致企业利润降低。由于玉米浆价格低,来源途径广,可利用其发酵氨基酸,可以提高生物价值,实现降低生产成本、增加生产利润的目标。玉米浆中含有丰富的糖类、多肽、可溶性蛋白质、游离氨基酸等有机物,是利用微生物发酵氨基酸的优质原料[4-7]。
响应面法是发酵培养基优化常用的设计方法[8-11],是降低研发成本、改良加工条件、提高产品质量、解决工业生产问题的一种高效方法,这种方法已经被广泛地应用于生物、食品、化学等多种领域[12]。本单因素试验运用Design experts 8.0.6软件进行实验数据回归分析,并通过响应面方法利用Box-Behnken设计实验研究L-赖氨酸发酵培养基成分,为提高L-赖氨酸产量优化培养基,最终降低工业生产成本提高效益。
1 材料与方法
1.1 材 料
1.1.1 菌 种
大肠杆菌FF210,由本研究室保存。
1.1.2 试验试剂
K2SO4、磷酸、FeSO4·7H2O、CuSO4·5H2O 、(NH4)2SO4、VB1、生物素,购自天津市北辰方正试剂厂;葡萄糖、玉米浆,由齐齐哈尔龙江阜丰生物科技有限公司提供。
1.1.3 试验仪器
紫外分光光度计L9型,日本岛津株式会社;恒温摇床SL-5000,中国上海跃进医疗器械厂;生物传感器分析仪SBA-40X,山东省科学院研究所。
1.1.4 培养基
种子培养基:蔗糖50 g/L,玉米浆30 g/L,(NH4)2SO44 g/L,磷酸 1.86 g/L,质量分数为0.06%的硫酸钾,MgSO4·7H2O 0.4 g/L,CuSO4·5H2O 0.000 5 g/L,VB1 0.01 g/L,生物素0.002 g/L,pH 7.2,121 ℃灭菌20 min。
发酵基础培养基:葡萄糖30 g/L,玉米浆10 g/L,磷酸 1.26 g/L,(NH4)2SO420 g/L,MgSO4·7H2O 1 g/L,CuSO4·5H2O 0.001 g/L,pH 7.0,121 ℃灭菌20 min。
1.2 培养方法
取一环活化后的菌株接入到装有30 mL种子培养基的250 mL三角瓶中,在30 ℃,200 r/min条件下,振荡培养24 h。第一次培养完成后取5 mL培养液接种到装有100 mL发酵培养基的500 mL三角瓶中,在30 ℃,200 r/min条件下,继续振荡培养48 h。上步骤完成后将发酵液在8 000 r/min条件下离心10 min,离心完成后利用分析仪测定上清液中L-赖氨酸含量。每组相同发酵培养基设置3个重复,测定含量取平均值[13]。
1.3 L-赖氨酸含量测定
采用生物传感器分析仪。原理:采用特殊设计的赖氨酸氧化酶膜电化学传感器对赖氨酸浓度进行检测。仪器自动采集样本并导入至测试区域。样本中所含的赖氨酸在固化的氧化酶的催化下发生酶解反应,反应产物为酸和过氧化氢。通过电极检测过氧化氢的含量从而计算出赖氨酸含量。仪器通过对已知浓度的标准品进行定标,标准品的电压值是衡量样本赖氨酸浓度的尺度。未知浓度可与标准品的电压信号相比较而获得。每次测定完毕后,系统缓冲液会自动清洗传感器电极,清洗完成后即可进行下一次测试。
1.4 试验设计
1.4.1 单因素试验
1) 碳源种类。在发酵基础培养基中分别加入30 g/L的供试碳源:葡萄糖、蔗糖、麦芽糖、果糖、可溶性淀粉和玉米粉,进行碳源种类的筛选。
2) 碳源浓度。将筛选得到的最适碳源,设置20,30,40,50,60,70 g/L 共6个质量浓度梯度进行筛选试验。
3)氮源种类。在发酵基础培养基中分别加入20 g/L 的麸皮、豆饼粉、玉米浆、酵母浸膏、蛋白胨、牛肉膏、氯化铵和硫酸铵,进行氮源种类的筛选。
4)有机氮源浓度。将筛选得到的最佳氮源,设置10,20,30,40,50 g/L共5个质量浓度梯度进行筛选试验。
5)无机氮源浓度。将筛选得到的最佳氮源,设置10,20,25,30,35,40 g/L共6个质量浓度梯度进行筛选试验。
1.4.2 响应面分析方法
采用响应面中的Box-Behnken设计分析方法。
1.4.3 数据分析
采用Design Expert 8.0.6软件进行回归分析,得到最优组合。
2 结果与分析
2.1 碳源的选择
不同碳源发酵产L-赖氨酸结果统计如图1所示。

1—蔗糖;2—麦芽糖;3—葡萄糖;4—果糖;5—可溶性淀粉;6—玉米粉。图1 不同碳源对L-赖氨酸产量的影响Fig.1 The effects of different carbon sources on the concentration of L-Lysine
由图1可知:当碳源为葡萄糖时,L-赖氨酸产酸水平最高,为69.22 g/L,显著高于其他种类的碳源。这说明以葡萄糖作为碳源,最有利于L-赖氨酸的积累。因此选用葡萄糖作为最适碳源。
2.2 碳源浓度的选择
不同葡萄糖浓度发酵产L-赖氨酸结果如图2所示。
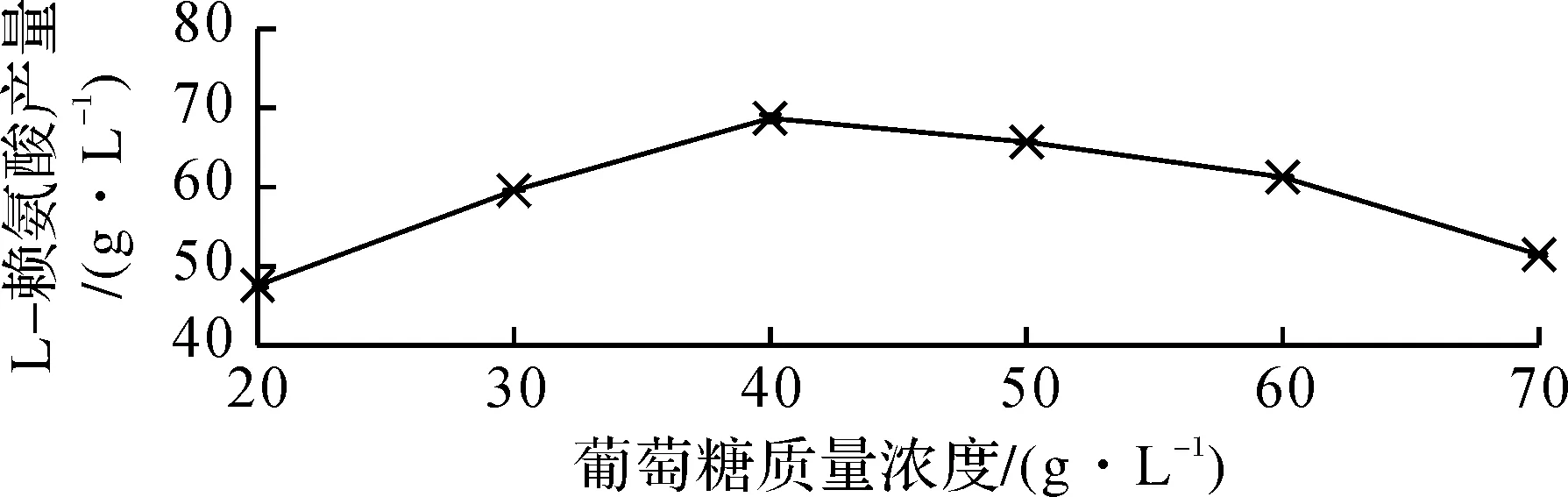
图2 葡萄糖质量浓度对L-赖氨酸产量的影响Fig.2 The effects of glucose concentration on the concentration of L-Lysine
由图2可知:在一定葡萄糖质量浓度范围内(20~70 g/L),L-赖氨酸产酸水平随着添加量的增加而增加。当葡萄糖添加量为40 g/L 时,其L-赖氨酸产量达到最大值,为73.68 g/L;继续加大培养基中葡萄糖用量,其产酸水平没有增加,高浓度的葡萄糖用量降低了L-赖氨酸产酸水平,可能是葡萄糖的粘度大,影响了发酵液的流动性,从而导致生物量的减少。考虑到响应面法的浓度范围筛选需要,选用20~50 g/L的葡萄糖用量作为发酵的适合质量浓度。
2.3 氮源的选择
不同氮源发酵产L-赖氨酸结果统计如图3,4所示。

1—麸皮;2—豆粕粉;3—玉米浆;4—蛋白胨;5—酵母浸膏;6—牛肉膏。图3 不同有机氮源对L-赖氨酸产量的影响Fig.3 The effects of different organic nitrogen sources on the concentration of L-Lysine
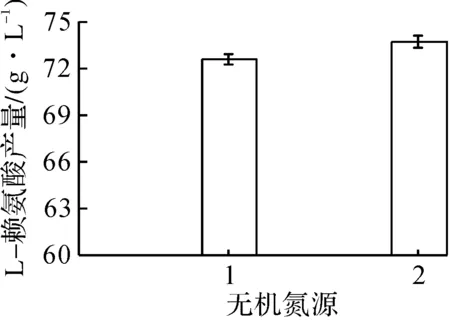
1—氯化铵;2—硫酸铵。图4 不同无机氮源对L-赖氨酸产量的影响Fig.4 The effects of different inorganic nitrogen sources on the concentration of L-Lysine
由图3,4可知:经过筛选,在有机氮源中,玉米浆的L-赖氨酸产酸水平最高,L-赖氨酸产量为71.60 g/L,其次是麸皮、豆饼粉、蛋白胨、牛肉膏;在无机氮源中,硫酸铵的L-赖氨酸产酸水平高于氯化铵,L-赖氨酸产量为73.73 g/L。因此选用玉米浆作为本实验的有机氮源,硫酸铵作为无机氮源。
2.4 氮源浓度的选择
2.4.1 有机氮源用量的选择
玉米浆的筛选结果如图5所示。
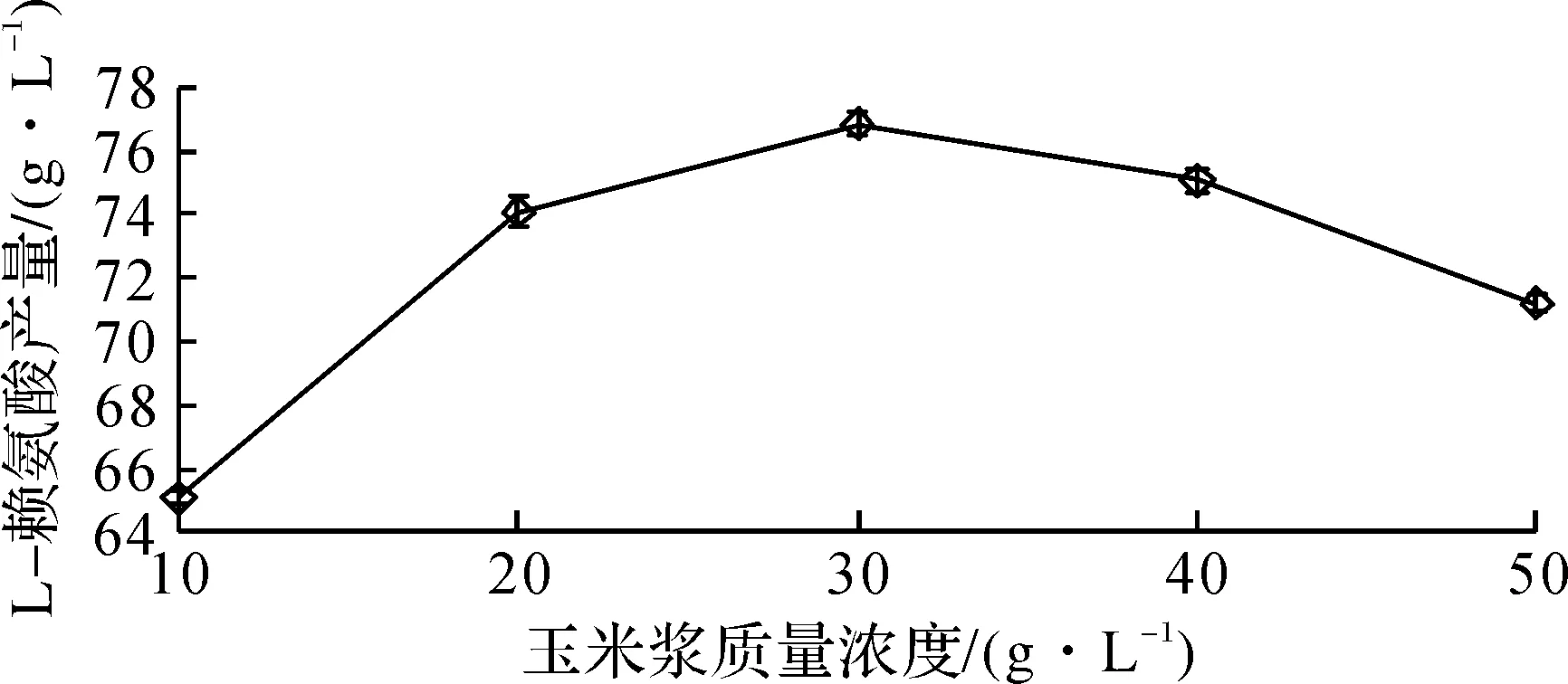
图5 玉米浆质量浓度对L-赖氨酸产量的影响Fig.5 The effects of corn steep liquor concentration on the concentration of L-Lysine
由图5可知:随着玉米浆的增加,L-赖氨酸的积累表现出先升高后下降的趋势。当玉米浆添加量达30 g/L时,L-赖氨酸产酸水平达到最大值,为76.85 g/L;当玉米浆添加量超过30 g/L后,L-赖氨酸产酸水平开始急剧下降。考虑到响应面法的浓度范围筛选需要,选择添加20~40 g/L的玉米浆作为最优质量浓度。
2.4.2 无机氮源用量的选择
硫酸铵质量浓度对L-赖氨酸产量的影响如图6所示。

图6 硫酸铵质量浓度对L-赖氨酸产量的影响Fig.6 The effects of (NH4)2SO4 concentration on the concentration of L-Lysine
由图6可知:随着硫酸铵浓度的增加,L-赖氨酸产量也会持续加大,当硫酸铵用量达25 g/L后,L-赖氨酸产酸水平达到最大值,为78.24 g/L,继续增加其用量将不会对L-赖氨酸的数值产生明显的差异。为节约成本,同时考虑到响应面法的浓度范围筛选需要,建议选用15~40 g/L的硫酸铵质量浓度为发酵所用。
2.5 Box-Behnken试验设计与模型可行性分析
Box-Behnken设计影响因素水平取值如表1所示。

表1 Box-Behnken设计因素水平表Table 1 Factors and levels of Box-Behnken design
通过Design Expert 8.0.6软件对表2中的数据进行处理。回归方程式为
R=78.07+3.9A+5.29B+2.69C-0.93AB-
3.85AC+3.21BC-0.36A2-6.84B2-3.29C2
设计出的模型试验值与预测值的差异很小可应用于指导试验,对模型进行方差分析,如表3所示。

表2 Box-Behnken设计及结果Table 2 The Box-Behnken design and results
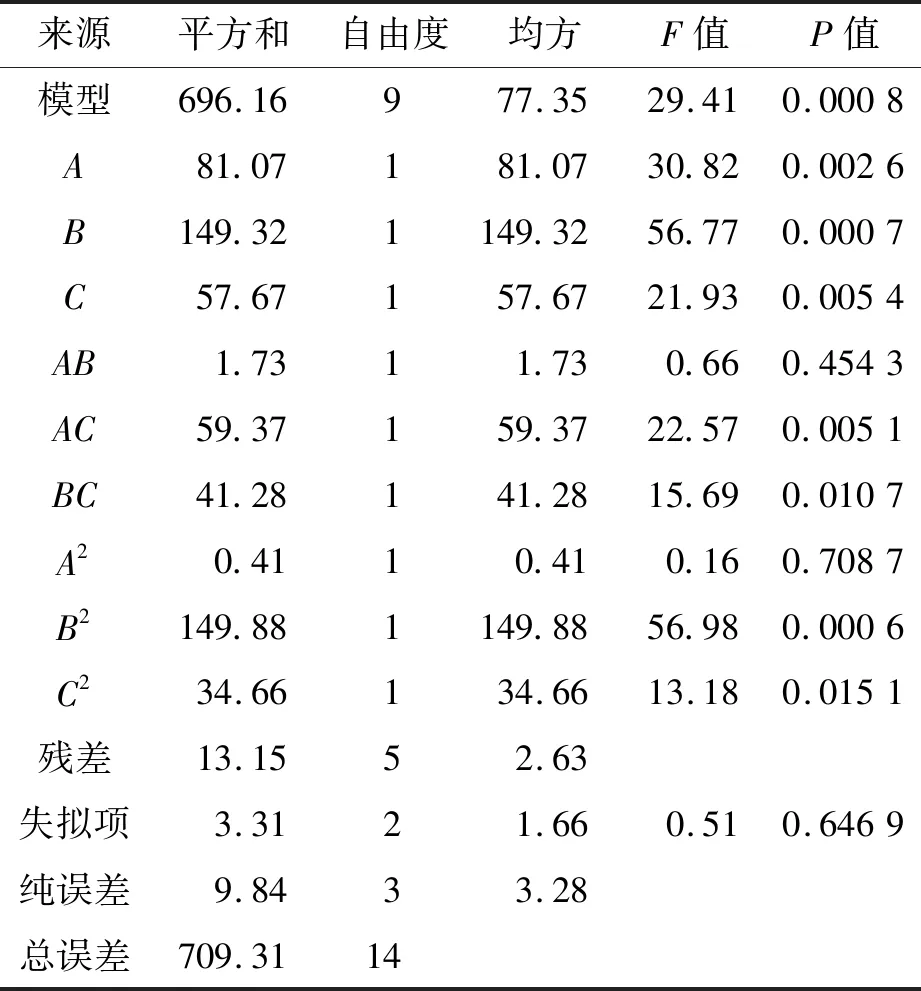
表3 回归模型的方差分析Table 3 Variance analysis of regresssion model
注:P<0.05,表示差异显著;P<0.01,表示差异极显著;P>0.05,表示差异不显著。
由表3可知:在此模型中A,B,C,AC,BC,B2,C2均显著,AB,A2不显著,3 种成分对赖氨酸产率影响程度依次为葡萄糖>玉米浆>硫酸铵。
玉米浆、葡萄糖、硫酸铵三者之间的交互影响L-赖氨酸得率的响应面图和等高线图如图7~9所示。

图7 玉米浆与葡萄糖交互影响L-赖氨酸得率的响应面图和等高线图Fig.7 Response surface plot and contour plot of effect of corn starch and glucose on L-lysine yield

图8 玉米浆与硫酸铵交互影响L-赖氨酸得率的响应面图和等高线图Fig.8 Response surface plot and contour plot of effect of corn starch and (NH4)2SO4 on L-lysine yield

图9 葡萄糖与硫酸铵交互影响L-赖氨酸得率的响应面图和等高线图Fig.9 Response surface plot and contour plot of effect of glucose and (NH4)2SO4 on L-lysine yield
由图7~9可知:葡萄糖与硫酸铵的交互作用显著。当玉米浆的质量浓度一定时,随着培养基中葡萄糖与硫酸铵质量浓度的增加,L-赖氨酸的得率先增加后降低,在葡萄糖与硫酸铵质量浓度分别为42.95 g/L,35.72 g/L时达到最大值,此时L-赖氨酸得率为80.42 g/L;当葡萄糖质量浓度一定时,玉米浆与硫酸铵的交互作用亦显著。随着培养基中玉米浆与硫酸铵质量浓度的增加,L-赖氨酸的得率先逐渐增加后逐渐降低,在玉米浆与硫酸铵质量浓度分别为39.85 g/L,27.30 g/L时达到最大值,此时L-赖氨酸得率为81.58 g/L;当硫酸铵的质量浓度一定时,玉米浆与葡萄糖的交互作用不显著。
通过软件分析优化得出培养基成分最佳质量浓度为玉米浆36.47 g/L,葡萄糖39.76 g/L,硫酸铵30.10 g/L,在此体系下,L-赖氨酸的理想产率为81.35 g/L。通过3次实验重复验证,得到数据分别为81.38,81.67,81.91 g/L,平均值为81.65 g/L,与系统模拟值基本相符,说明该Box-Behnken试验设计与模型可行。
3 结 论
本试验运用Design Expert 8.0.6分析软件,通过Box-Behnken设计方法,确定3个主要因素物质的添加量分别为玉米浆36.47 g/L,葡萄糖39.76 g/L,硫酸铵30.10 g/L,摇瓶实验理论L-赖氨酸得率为81.35 g/L。通过3次重复实验验证,测得L-赖氨酸质量浓度平均值为81.65 g/L,与系统模拟值基本相符。此实验值与优化前数值69.22 g/L相比,质量浓度提高了17.96%。因此,采用响应面分析法中的Box-Behnken设计优化大肠杆菌生产L-赖氨酸的方法是可以应用的,通过降低培养基中葡萄糖的质量浓度,使玉米浆中所含的营养物质得到充分利用,为实现工业化生产,降低生产成本,提高生产效益奠定基础。

