水杨醛亚胺钴(Ⅱ)配合物的合成及载氧性能
姜翠玉, 邵 雪, 刘 蕾, 梁书源, 张龙力
(中国石油大学(华东) 理学院,山东 青岛 266580)
0 引 言
Schiff[1]在1864年首次合成了Schiff碱,它是由含有氨基及活泼羰基的两种化合物通过脱水缩合形成的含有亚氨基或烷亚氨基的一类有机物[2],2个相同的醛分子和1个二胺分子反应得到的Schiff碱一般简称Salen。Schiff碱可以作为过渡金属离子配合物的配体,其结构接近于生物体系的真实情况,适宜于进行生命体系的模拟研究,近年来受到人们的普遍重视[3-4]。其络合得到的希夫碱类金属配合物是一类能可逆氧合氧分子的化合物,在特定条件下,它能发生吸氧反应,形成氧合配合物。当体系的条件改变时(如加热、加酸或氧分压改变),氧合配合物又可以分解为未氧合配合物及氧气,这一过程可重复进行[5]。
此类氧载体在催化研究、生物化学、分子识别研究等领域得到了广泛关注[6],它作为一种非常有用的催化剂[7]被广泛应用于光化学合成及其他有机合成反应,如对映选择性环氧反应[8]、不对称催化反应[9]、环丙烷化反应[10]、氮丙啶化反应[11]、Sterecker反应[12]等。Salen配合物同样可用于催化氧化反应[13-16],如用于催化氧化取代甲苯制备取代苯甲酸等。近年来,发现利用Salen配合物的这一催化氧化特性,应用于原油及燃料油的氧化脱硫,将有机硫氧化生成砜类或亚砜类,达到脱硫的目的。可见,其应用范围越来越广泛。本文选择不同的原料合成5种Salen配体,然后与六水合硝酸钴反应合成Salen Co(Ⅱ)配合物,测试其吸氧量,并进一步分析电子效应与其吸氧量的关系,为今后设计、合成新配体奠定基础。本实验涉及席夫碱及其配合物合成、分离提纯、结构表征、性能测试等多个实验操作,充分体现“多学科综合、多环节综合、多技术综合”。同时还利用电子效应、空间效应等基本理论去解释构效关系,加强学生应用能力培养,是一个很好的本科教学综合实验或开放性试验。
1 实验部分
1.1 仪器与试剂
Ascend 400型核磁共振仪(BEUKER);Spectrumone型红外光谱仪(PerKin Elmer)。所用试剂:水杨醛、5-氯水杨醛、3-甲氧基水杨醛、3,5-二叔丁基水杨醛、乙二胺、邻苯二胺、硝酸钴、无水乙醇、N,N-二甲基甲酰胺均为分析纯,国药集团化学试剂有限公司。
1.2 Salen Co(Ⅱ)配合物的制备
1.2.1 Salen型配体的制备
以L1配体的合成为例,在三口烧瓶中加入3.13 mL(0.03 mol)水杨醛,一定量的无水乙醇,搅拌状态下水浴加热升温至80 ℃,然后滴入适量乙二胺,80 ℃下回流反应一定时间。反应完毕后,自然冷却至室温,过滤后得晶体,用无水乙醇洗涤2或3次、抽滤,将其放入真空干燥箱干燥12 h得到黄色晶体,备用。
L2~L5的合成步骤与上述类似。L2~L4的合成皆采用乙二胺,分别与同等摩尔量的3-甲氧基水杨醛、5-氯水杨醛、3,5-二叔丁基水杨醛反应;L5的合成采用水杨醛与邻苯二胺反应。产物统称为Salen型配体,反应式如下:


1.2.2 Salen Co(Ⅱ)配合物的制备
参照文献[20]进行席夫碱金属配合物的合成。C1具体合成步骤如下:N2保护下,在250 mL四口烧瓶中依次加入0.80 g(0.003 mol)配体L1、60 mL无水乙醇,室温搅拌5 min后将水浴温度调节至80 ℃,开始回流。缓慢滴加0.58 g Co(NO3)2·6H2O乙醇溶液,立即有沉淀生成。继续加热回流3 h后,冷至室温,抽滤,用氯仿对产物进行重结晶,真空干燥2 h,备用。C2~C5配合物的合成与C1类似,各配体与Co(NO3)2·6H2O以物质的量之比1.5∶1投料。反应式如下:

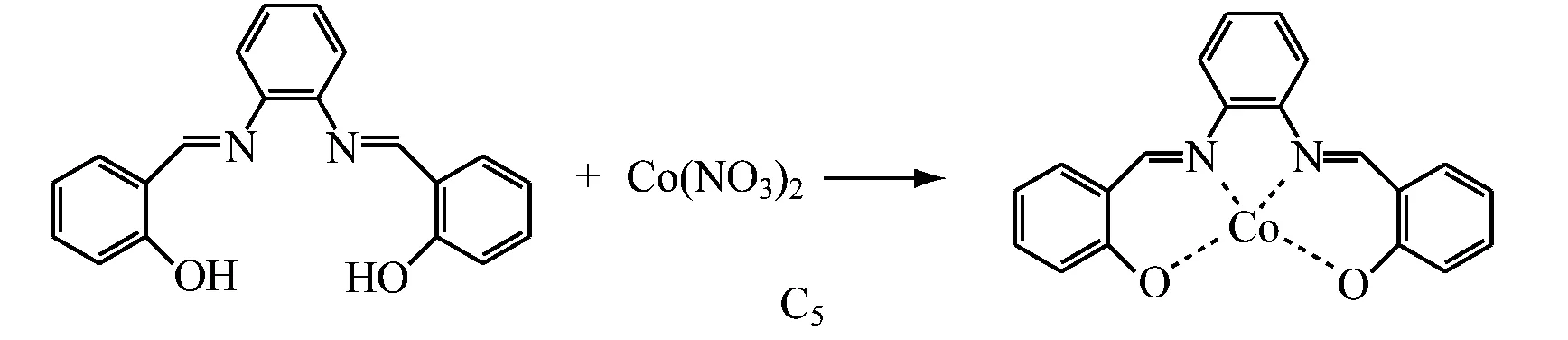
1.3 Salen Co(Ⅱ)配合物的结构表征
以氘代氯仿为溶剂,用Bruker AMX-400型核磁共振仪对5种Salen型配体L1~L5进行1H NMR表征。
利用Spectrumone型红外光谱仪,以KBr压片法对五个Salen Co(Ⅱ)配合物C1~C5进行IR表征。
1.4 Salen Co(Ⅱ)配合物的载氧性能测试
称取0.3 g配合物,迅速转移入烧瓶中,塞好瓶塞。如图1所示安装装置,保证量气管和漏斗垂直。分液漏斗中加入30 mL DMF做溶剂,塞好漏斗塞,利用通氧气后量气管的水位保持情况来判断装置的密封性。若10 min内水位不降低,则气密性良好;若水位变化,则需进一步检查装置的气密性,必要时使用真空泥涂在接口处。

1-圆底烧瓶;2-常压漏斗;3-旋塞;4-量气管;5-旋塞;6-玻璃管
图1 载氧测试装置图
检查好装置气密性后,通过橡胶管的铁夹调整量气管水位,使其与漏斗中的水位平齐;将分液漏斗中的溶剂加入烧瓶,打开磁力搅拌器,并开始计时。每隔2 min记录量气管内气体体积变化,直至体积恒定为止(5 min内液面不再变化),绘制出体积随时间变化的吸氧曲线,记录大气压、温度及体积下降值;由理想气体状态方程pV=nO2RT可以近似计算每摩尔配合物所吸收的氧气量。
按照以上方法分别对5种配合物的载氧量进行测试,并进行比较(为避免实验数据的偶然性,每种配合物的载氧量平行测试3次以上)。
2 结果与讨论
2.1 Salen型配体的合成条件
固定反应温度80 ℃、溶剂无水乙醇用量80 mL、反应时间2.5 h,考察水杨醛和乙二胺物质的量之比对L1产率的影响,结果如图2所示。

图2n(醛)/n(胺)对产率的影响
由图2可知,醛胺物质量之比在1~3范围内,反应产率随该比值增大而增大。这是因为反应物过量有利于反应正方向进行。但当醛胺比大于2时,产率增加幅度变小。因此水杨醛与乙二胺最适宜的物质的量之比为2∶1,此时产率达73.9%。
固定反应温度80 ℃,醛胺物质的量之比为2∶1、溶剂无水乙醇用量为80 mL,设计反应时间1.5、2、2.5、3、3.5 h 5组试验,考察反应时间对L1产率的影响,结果如图3所示。

图3 反应时间对产率的影响
由图3可知,L1产率与反应时间成正比,这是由于反应时间越长,反应中分子有效碰撞的概率越大且越充分,产率越高。当反应时间多于2.5 h时,曲线趋于平缓,产率提升较少,故最佳反应时间为2.5 h。
固定反应条件中的反应温度80 ℃,醛胺物质的量之比为2∶1(水杨醛为0.003 moL)、反应时间为2.5 h,设计无水乙醇用量分别为40、80、120 mL 3组试验,考察溶剂量对L1产率的影响,结果如表1所示。

表1 溶剂量对产率的影响
由表1可知,无水乙醇用量40 mL时,L1产率最高,达81.4%,这是因为有效浓度高,亦增加了底物分子碰撞的概率。若溶剂低于40 mL,反应中生成的产物会析出粘在容器壁上,易于导致传质不均,因此最适宜溶剂量为40 mL。由此可知,反应温度为80 ℃时,在一定范围内,醛胺比和反应时间均与产率成正比,溶剂量与产率成反比。合成L1的适宜条件为:醛胺物质量之比为2∶1、溶剂量40 mL、反应时间2.5 h,此条件下产率为81.4%。
2.2 Salen Co(Ⅱ)配合物的合成
本文重点探讨配合物C1的合成条件,当配体L1与硝酸钴的物质量之比为1.5、溶剂用量60.0 mL、反应温度80 ℃、反应时间3 h时,配合物C1产率为89.6%。在最佳条件下,以自制的5种配体为原料分别与Co(NO3)2·6H2O反应合成相应的配合物,所得配合物的性状见表2。

表2 Salen Co(Ⅱ)配合物的性状
由表2可知,C1~C33种配合物颜色相近,C4为橙红色粉末,C5为紫红色粉末。其中,C5颜色最深,这是由于Salen Co(Ⅱ)配合物的颜色与其苯环上的取代基和配合物的共轭程度有关。共轭程度越大,其颜色越深。
2.3 结构表征
2.3.1 Salen型配体的核磁共振氢谱
分析图4可知,L1的1H NMR谱图中:δ×106=13.20(s,2H)为苯环上羟基的氢原子峰;δ×106=8.33(s,2 H)为亚胺碳原子上的两个氢原子;δ×106=7.33~6.80(m,8H)的四簇峰是苯环上氢原子;δ×106=3.91(s,4H)为亚胺桥碳上的氢原子。
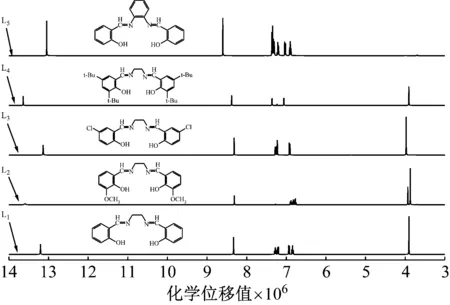
图4 配体L1~L5的1H NMR谱图
L2的1H NMR谱图中:δ×106=13.61(s,2H)为苯环上羟基的氢原子峰;δ×106=8.31(s,2H)为亚胺碳原子上的氢原子峰;δ×106=6.90-6.75(m,6H)为苯环氢原子;δ×106=3.92(s,4H)为亚胺桥碳上的氢原子;δ×106=3.87(s,6H)为甲氧基上的氢原子。
L3的1H NMR谱图中:δ×106=13.14(s,2H)为苯环上羟基的氢原子峰;δ×106=8.32(s,2H)处为亚胺的碳原子上的两个氢原子;δ×106=7.28-6.92(m,6H)的三簇峰归属于苯环上氢原子;δ×106=3.98(s,4H)为亚胺桥碳上的氢原子。
L4的1H NMR谱图中:δ×106=13.64(s,2H)为苯环上羟基的氢原子峰;δ×106=8.38(s,2H)处为亚胺的碳原子上的两个氢原子;δ×106=7.38和δ×106=7.06的两簇峰是苯环上氢原子;δ×106=3.91(s,4H)为连接亚胺桥碳上的氢原子;δ×106=1.43(s,18H)和δ×106=1.28(s,18H)处的峰属于叔丁基上的36个氢原子。
L5的1H NMR谱图中:δ×106=13.05(s,2H)为苯环上羟基的氢原子峰;δ×106=8.59(s,2H)处为亚胺的碳原子上的2个氢原子;δ×106=7.37~6.88(m,12H)的峰属于苯环未取代碳上氢原子。
2.3.2 Salen Co(Ⅱ)配合物的红外光谱
5种Salen Co(Ⅱ)配合物的红外光谱均有以下特征:3 435 cm-1左右的峰为苯环上的缔合羟基峰;2 920、2 875 cm-1左右的峰为C—H键的伸缩振动峰;1 625 cm-1左右的峰为C=N键振动峰。1 500~1 680 cm-1存在苯环上C=C吸收峰;600~630 cm-1处为Co—N键的伸缩振动峰;500~570 cm-1处为Co—O键的伸缩振动峰。
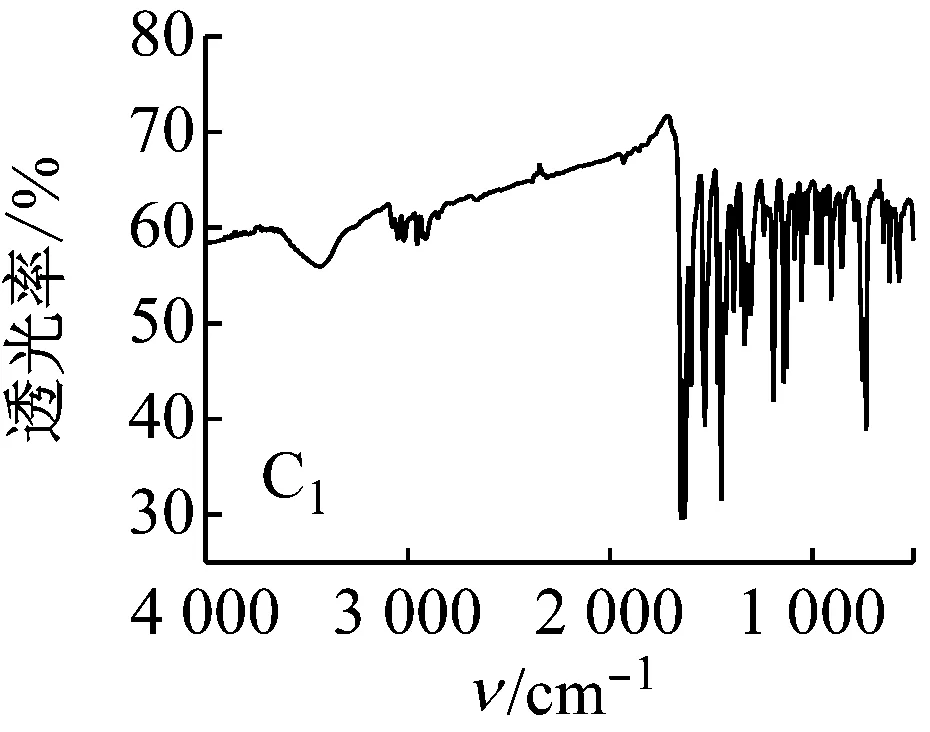

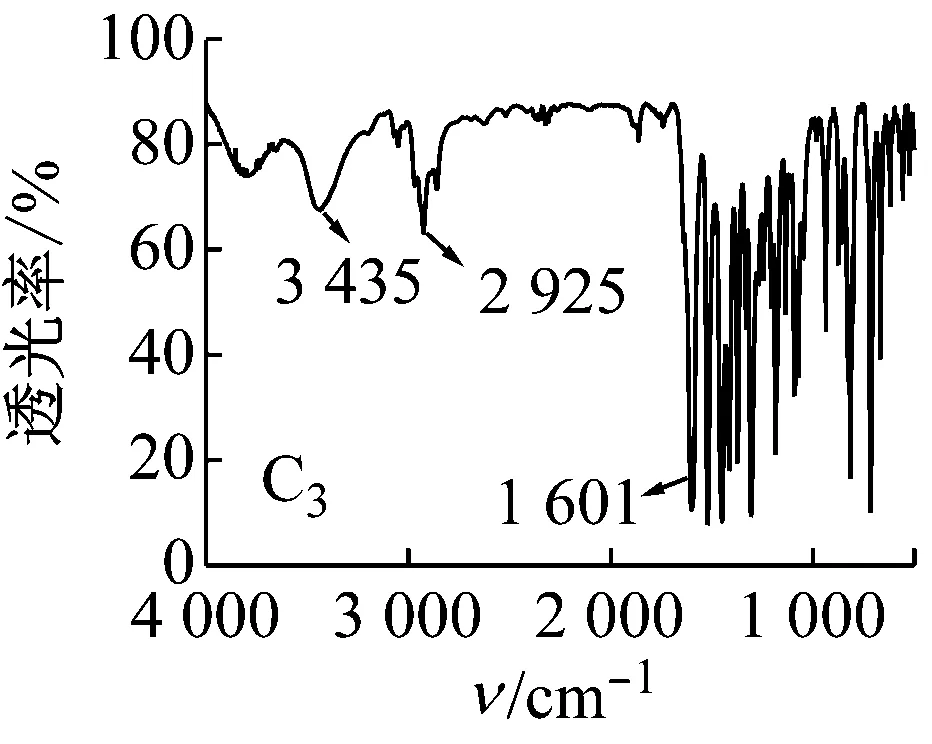

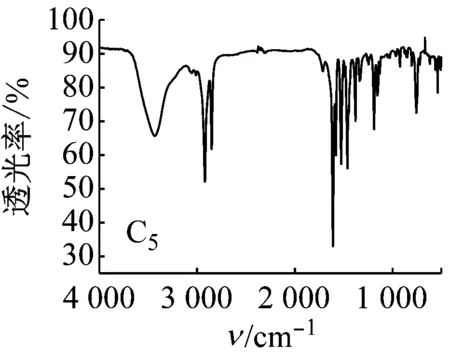
图5 配合物的红外光谱图
对比5种配合物的红外光谱图可知:C2中波数为1 000和1 200 cm-1处的两峰为甲氧基的C—O—C伸缩振动峰,波数为1 370 cm-1处有一甲基的C—H键弯曲振动峰,说明有CH3O—的存在;C3中在700~750 cm-1有C—Cl键的吸收峰;C4中在1 382和1 361 cm-1处有2个不等高的振动吸收峰,说明有(CH3)3C—的存在;与C1相比,C5中相应官能团的吸收峰向低波数方向移动,说明存在更大的共轭体系。
2.4 Salen Co(Ⅱ)配合物的吸氧性能及构效关系
2.4.1 Salen Co(Ⅱ)配合物的吸氧性能
取0.3 g配合物C1,测试其在不同时间下的吸氧量,实验结果见图6。

图6 配合物C1在不同时间下的吸氧量
由图6可看出,0.3 g(0.923 mmol)配合物C1最终吸氧体积为6.4 mL,根据气态方程pV=nO2RT可算出该配合物所吸氧的摩尔数:nO2=pV/RT=2.75×10-4mol。故C1的摩尔吸氧量为nO2∶nC1=2.75×10-4∶9.23×10-4=0.298。
利用上述方法分别计算5种配合物的摩尔吸氧量,为避免偶然性,每种配合物进行3次平行试验;并记录配合物达到最大吸氧量所用的时间,实验结果如表3所示。

表3 配合物的摩尔吸氧量
由表3可知,5种配合物的载氧能力由大到小的顺序为C5>C2>C1>C4>C3,C5的载氧量最多,摩尔吸氧量达0.376,C3的载氧量最低。此外,吸氧速度也有不同,C3达到最大吸氧量的时间最短。
2.4.2 Salen Co(Ⅱ)配合物的载氧性能与结构的关系
进一步分析表3可知,固定乙二胺,改变水杨醛苯环上的取代基,所得配合物的载氧量有明显不同,载氧量由大到小的顺序为C2>C1>C4>C3。这是由于不同的取代基具有不同的电子效应:C2中含有甲氧基,为推电子基,其推电子效应沿着苯环传递,最终使中心原子(Co原子)的电子云密度更高,其氧合能力增强,吸氧量多;与之相反,C3中含吸电子的取代基氯,其存在使苯环的电子云密度降低,从而降低中心原子的电子云密度,因此其载氧性能差。对于C4,苯环上有两个叔丁基,尽管是推电子基,但由于空间效应的存在,影响了与苯环的共平面,导致推电子能力降低,故其载氧量较C1小。
当固定水杨醛,胺类分别采用乙二胺(C1)和邻苯二胺(C5)时,所得配合物的载氧量大小为C5>C1。可见二胺的结构特征对配合物的载氧量也有影响,邻苯二胺分子中含有苯环,相应的配合物C5分子的共轭程度高,导致与氧结合的稳定性增大,故其载氧量大。
由此可知,配合物的载氧量与配体电子云密度、空间效应及体系的共轭程度有关。配体的电子云密度越大,配体的共轭程度越高,配合物的氧合能力越强,载氧量越多。
3 结 论
(1) 以水杨醛、5-氯水杨醛、3-甲氧基水杨醛、3,5-二叔丁基水杨醛、乙二胺、邻苯二胺为原料制备了5种配体L1-L5,在醛胺物质量之比2∶1,反应时间为2.5 h,溶剂无水乙醇的用量为40 mL时,L1的产率最高,可达81.4%。利用自制的五种配体与Co(NO3)2·6H2O反应,制得五种Salen Co(Ⅱ)配合物。分别通过1H NMR、IR对其结构进行表征。
(2) 不同的配合物的载氧能力不同,载氧能力大小顺序为C5>C2>C1>C4>C3。载氧量受原料的电子云密度及配体的共轭程度影响,原料苯环中含有较强的推电子基团(例如—OCH3)、配体分子的共轭程度高,都有利于配合物中心金属离子与氧气的结合,即配合物的载氧性能就更好。

