丹酚酸B通过抑制NLRP3炎症小体priming阶段减轻缺氧诱导大鼠心肌细胞损伤
胡 洋,潘韵铮,李庆菊,郑仕中,卞 勇,时 乐,范方田,蒋宝平,许 立
(南京中医药大学 1.药学院,江苏 南京 210023, 2.翰林学院,江苏 泰州 225300)
丹参是心血管疾病最常使用的中药之一,丹酚酸B(Sal B)是其主要的水溶性成分[1],具有广泛的生理活性,其可通过抗炎[2]、抗氧化、钙拮抗[3]、清除氧自由基等机制发挥心血管保护作用。心肌缺血作为心血管疾病的重要分型,在发生过程中往往伴随着剧烈的炎症反应。许多文献报道,抑制心肌缺血过程中的炎症反应能够有效减轻心肌缺血损伤[4]。TLR4/NF-κB信号通路与炎症反应的发生密切相关,已有研究表明,抑制TLR4/NF-κB信号通路的激活可以减少多种促炎因子的分泌,缓解心肌缺血损伤[5-6]。IRAK1作为TLR4/NF-κB信号通路上的重要一环,抑制其磷酸化能够有效阻断TLR4/NF-κB信号通路的激活。
NLRP3炎症小体是固有免疫的组成成分之一[7],在许多炎症性疾病的发生发展中扮演着中心角色。典型的NLRP3炎症小体激活需要priming阶段与激活阶段的共同参与。priming阶段刺激信号激活TLR4信号通路,然后促进核转录因子NF-κB激活,介导pro-IL-1β、pro-IL-18等炎症因子前体的产生,激活阶段刺激信号(如ROS、MSU、ATP等)可以促进NLRP3/ASC/pro-caspase-1蛋白复合物的组装,并活化caspase-1,之后活化的caspase-1将pro-IL-1β、pro-IL-18剪切活化为IL-1β和IL-18并释放到胞外,介导一系列的炎症反应[8]。本文旨在探究丹酚酸B能否通过调控NLRP3炎症小体激活的priming阶段,抑制NLRP3激活,从而达到减轻缺氧诱导的大鼠H9C2细胞损伤的目的。
1 材料与方法
1.1 细胞株与试剂大鼠H9C2细胞株购于南京凯基生物技术股份有限公司;丹酚酸B(纯度≥98%)由南京虹桥医药技术研究所惠赠,批号:181218;胎牛血清购自BI公司,批号:1906287;CCK-8购自广州赛国生物科技有限公司,批号:EZ2811A179;白介素1β(interleukin 1β,IL-1β)ELISA检测试剂盒购自于杭州联科生物技术股份有限公司,批号:2301B41114;心肌肌钙蛋白(cardiac troponin,cTn)ELISA检测试剂盒购自于南京翼飞雪生物科技有限公司,批号:201903;乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒购自于上海碧云天生物技术有限公司,批号:C0017;TLR4、Myd88、NF-κB、NLRP3、GAPDH引物合成于上海生工生物工程股份有限公司;TLR4(批号:00048459)、Myd88(批号:00056889)、IRAK1(批号:00022045)、NF-κB(批号:00057776)抗体购自于武汉三鹰生物技术有限公司;NLRP3抗体(批号:AB214185)购自于艾博抗生物公司;羊抗兔二抗(批号:10249)、凝胶试剂盒(批号:NO.072319190723)、0.25%EDTA-胰酶购自于上海碧云天生物技术有限公司;逆转录试剂盒(批号:2L8448)、SYBR荧光染料(批号:IL8353)购于镇江爱必梦生物科技有限公司;不完全高糖/低糖培养基(批号:20190702)购自于江苏凯基生物技术股份有限公司;PBS缓冲液购于武汉博士德生物公司(批号:BC20190620)购自于江苏凯基生物技术股份有限公司;IRAK1抑制剂(批号:05370)购自于MedChemExpress公司,;厌氧产气袋、缺氧盒以及氧气指示剂购自于日本三菱公司。
1.2 仪器Synergy2多功能酶标仪(美国Bioteck公司) ; Allegra 64R型超速冷冻离心机(美国Beckman公司) ; Bio-Rad电泳仪及凝胶成像仪(美国伯乐公司);7500型定量PCR仪(美国ABI公司),荧光倒置显微镜(德国ZEISS公司)。
1.3 方法
1.3.1大鼠H9C2心肌细胞培养以及药物配制 将H9C2细胞正常培养在含有10%FBS的DMEM不完全培养基中,放置于普通培养箱中常规培养(37 ℃、5% CO2、95%空气),观察细胞形态。将Sal B溶解在无菌PBS溶液中,配置成5 mmol·L-1母液,放置于-20 ℃冰箱待用,根据实验需要,再将其用完全培养基稀释至各浓度。使用完全培养基将IRAK1抑制剂依照说明稀释为50 μmol·L-1备用。
1.3.2CCK8法测定不同浓度Sal B对H9C2细胞状态的影响 H9C2细胞生长至大约80%左右消化,然后以104个/mL浓度种于96孔板中,待细胞贴壁后,吸弃培养液,PBS洗涤2遍,每孔加入不同浓度Sal B (1 、5、10 、15 、20、25、30、35 μmol·L-1)继续培养48 h,然后每孔加入10 μL CCK8溶液孵育1 h,之后450 nm处测定OD值,实验重复3次。
1.3.3实验分组以及模型构建 实验分组为:对照组:正常生长的细胞;模型组:缺氧处理的细胞;实验处理组:使用1、5、25 μmol·L-1Sal B预处理24 h后缺氧造模的细胞;IRAK1抑制剂组:使用IRAK1抑制剂预处理2 h后缺氧造模的细胞。缺氧模型构建:待H9C2细胞汇合度达到约80%时消化,然后以4×105个/mL浓度于6孔板中培养,待细胞贴壁后加入不同浓度的Sal B培养24 h或IRAK1抑制剂培养2 h,之后改用不含血清的DMEM低糖培养基,置于安宁包所致缺氧体系中培养6 h,同时使用氧气指示剂,实时监测体系内氧气浓度。根据厂商说明,安宁包会快速吸收密闭容器中的O2,并维持约95% N2,5% CO2体系6 h[9-10]。
1.3.4CCK-8法检测细胞活力 H9C2细胞生长至大约80%左右使用胰酶消化,然后将细胞以104个/mL密度接种于2块96孔板中,随机将2块96孔板分为正常组和缺氧组。正常组细胞常规培养,缺氧组细胞分为缺氧模型组以及Sal B预处理组。缺氧组细胞使用不同浓度Sal B预处理24 h后缺氧造模6 h,之后加入CCK-8培养1 h,测450 nm处OD值,根据公式计算细胞活性,即:
H9C2细胞活性/%=(各实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%,实验重复3次。
1.3.5微孔板法检测LDH 将稀释后的细胞接种到6孔板中,设置模型组、对照组、Sal B预处理低、中、高剂量组,IRAK1抑制剂组,待细胞贴壁后Sal B预处理组换用不同浓度Sal B处理24 h;细胞贴壁后22 h抑制剂组换用IRAK1抑制剂培养2 h。在缺氧造模前将培养液更换为不加血清的DMEM低糖培养基,之后缺氧造模6 h,取各组上清,微孔板法测定LDH表达水平。
1.3.6ELISA检测cTn和IL-1β 将稀释后的细胞接种到6孔板中,设置模型组,对照组,Sal B预处理低,中,高剂量组,待细胞贴壁后Sal B预处理组换用不同浓度Sal B处理24 h;细胞贴壁后22 h抑制剂组换用IRAK1抑制剂培养2 h。在缺氧造模前将培养液更换为不加血清的DMEM低糖培养基,之后缺氧造模6 h,取各组上清,ELISA法测定cTn以及IL-1β表达水平。
1.3.7实时荧光定量PCR检测基因表达水平 实验分组以及细胞处理方法同上,缺氧造模后使用Trizol提取各实验组细胞RNA,并根据试剂盒使用说明将RNA逆转录为cDNA,-20 ℃保存待用。之后取各实验组cDNA进行实时荧光定量PCR测定,反应体系为EvaGreen 5 μL,cDNA 1 μL,上下游引物各0.3 μL,无核酶水3.4 μL。引物序列见Tab 1。

Tab 1 Primer sequences of selected genes
1.3.8Western blot检测蛋白表达 实验分组以及处理方法同上,之后提取各实验组细胞总蛋白,并用nanodrop测定各组蛋白浓度,然后将各组蛋白浓度稀释到同一水平,以每孔30 μg上样量跑胶。条件为:预电泳浓缩胶60 V电泳30 min,待Marker完全跑开后改用90 V继续电泳下层胶,充分分离后改用350 mA电流转PVDF膜1.5 h,之后PVDF膜用5%脱脂奶粉(1× TBST溶液配制)在室温条件下封闭1 h, 4 ℃孵育一抗过夜,隔天使用1× TBST溶液将PVDF膜洗涤3次,每次15 min,然后室温孵育二抗1 h,再把膜用1× TBST溶液洗涤3次,每次15 min。曝光显影,实验重复三次,用软件进行半定量分析。
1.3.9统计学分析 使用SPSS 22.0软件进行统计学分析,多样本均数间比较采用单因素方差分析,两样本之间比较用t检验。
2 结果
2.1 不同浓度Sal B对H9C2细胞活力的影响如图所示,当Sal B浓度为30 μmol·L-1及以上时,与对照组相比,H9C2细胞存活率存在显著性差异。综合细胞存活率以及显微镜下细胞形态观察,本实验分别选用1、5、25 μmol·L-1作为Sal B预处理的低,中,高浓度。

Fig 1 Survival rate of H9C2 treated with different concentrations of Sal
*P<0.05,**P<0.01vsControl
2.2 Sal B对缺氧造模后H9C2细胞的影响如Fig 2所示,缺氧造模处理后,模型组H9C2细胞活力降低,高剂量Sal B预处理组H9C2细胞活性升高,且与模型组差异存在显著性。

Fig 2 Cell activity of each n=6)
##P<0.01vsControl;*P<0.05vsModel
2.3 Sal B降低缺氧造模后细胞上清中的LDH、cTn、IL-1β水平大量文献表明,在心肌缺血发生过程中LDH,cTn等心肌损伤标志物以及IL-1β等炎症因子的分泌量会增加。如Fig 3所示,与对照组相比,缺氧造模后,H9C2细胞LDH,cTn以及IL-1β分泌量升高。与模型组相比,中,高剂量组Sal B,IRAK1抑制剂预处理可以降低H9C2缺氧造模后的LDH分泌量,高剂量组Sal B,IRAK1抑制剂预处理可以降低H9C2缺氧造模后的cTn水平,提示Sal B对缺氧导致的H9C2心肌细胞损伤有一定的保护作用。且与模型组相比,高剂量组Sal B,IRAK1抑制剂预处理可以降低H9C2缺氧造模后的IL-1β分泌量,提示其作用机制可能与抑制心肌缺血过程中炎症因子的分泌有关。
2.4 Sal B降低缺氧造模后细胞TLR4、Myd88、IRAK1、NF-κB、NLRP3 mRNA表达水平如Fig 4所示,与对照组相比,缺氧造模组的TLR4、Myd88、IRAK1、NF-κB、NLRP3 mRNA表达水平明显升高;使用Sal B预处理后TLR4、Myd88、IRAK1、NF-κB、NLRP3 mRNA表达水平降低,与模型组差异有显著性。与模型组相比,IRAK1抑制剂组的TLR4、Myd88 mRNA表达水平差异未见显著性;IRAK1、NF-κB、NLRP3表达水平降低,且与Sal B预处理高剂量组比较差异未见显著性。
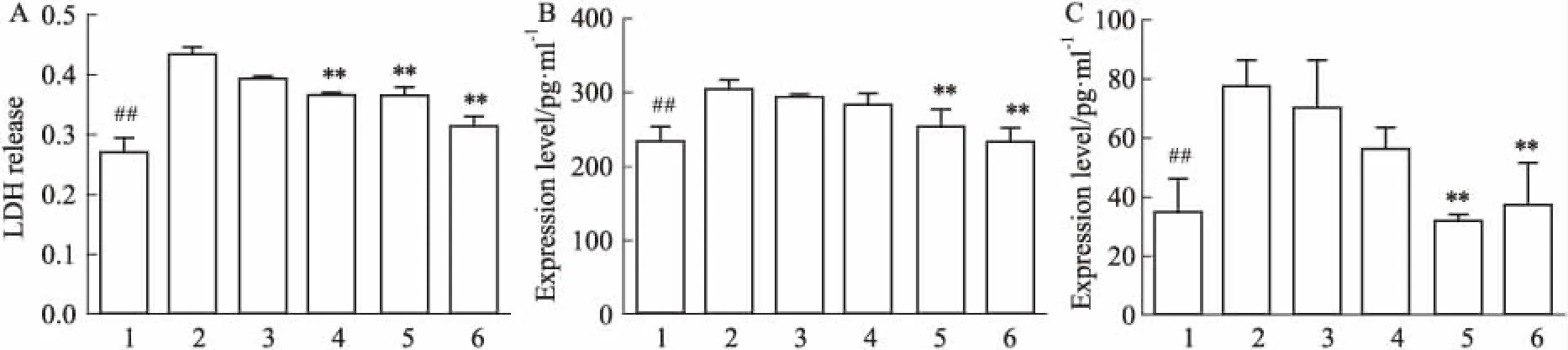
Fig 3 Effect of Sal B on levels of LDH,cTn and IL-1β in supernatant of H9C2 cells induced by
A:The expression level of LDH; B:The expression level of cTn; C:The expression level of IL-1 (1:Control; 2:Model;3: 1 μmol·L-1; 4:5 μmol·L-1; 5: 25 μmol·L-1; 6:IRAK1 inhibitor).##P<0.01vsControl;**P<0.01vsmodel group.

Fig 4 Effect of Sal B on relative mRNA levels in H9C2 cells induced by hypoxia(n=3)
A:mRNA expression levels of TLR4; B:mRNA expression levels of myd88; C:mRNA expression levels of IRAK1(1:Control; 2:Model;3: 1 μmol·L-1; 4:5 μmol·L-1; 5: 25 μmol·L-1; 6:IRAK1 inhibitor); D:mRNA expression levels of NF-κB(1:Control; 2:Model;3: 1 μmol·L-1; 4:5 μmol·L-1; 5: 25 μmol·L-1; 6:IRAK1 inhibitor); E:mRNA expression levels of NLRP3(1:Control; 2:Model;3: 1 μmol·L-1; 4:5 μmol·L-1; 5: 25 μmol·L-1; 6:IRAK1 inhibitor).#P<0.05,##P<0.01vsControl;**P<0.01vsModel.
2.5 Sal B降低缺氧造模后细胞TLR4、Myd88、IRAK1、NF-κB、NLRP3蛋白表达水平如Fig 5所示,缺氧造模处理后心肌细胞TLR4、Myd88、IRAK1、NF-κB、NLRP3蛋白表达水平升高;用Sal B预处理后蛋白表达水平降低。与模型组相比,IRAK1抑制剂组的TLR4、Myd88 蛋白表达水平差异显著性;IRAK1、NF-κB、NLRP3蛋白表达水平显著降低,且与Sal B预处理高剂量组比较差异未见显著性。
3 讨论
心肌缺血是一种血氧供需失衡的状态[11]。研究表明多种疾病都会导致心肌缺血的发生,如高血压、冠心病、动脉粥样硬化等。当机体受到外部环境或自身损伤因子等因素刺激时,TLR4/NF-κB信号通路首先被激活,并带来剧烈的炎症级联反应[12]。NLRP3炎症小体作为固有免疫的组成部分之一,在心肌缺血的炎症性损伤中扮演着重要的角色[13]。诸多研究显示,抑制心肌缺血过程中的NLRP3炎症小体的激活,能够有效减轻心肌缺血损伤[14]。
经典的NLRP3炎症小体激活需要启动阶段与激活阶段两个步骤,且在心肌细胞中必须两个阶段共同参与才能有效的诱导NLRP3炎症小体激活[15]。Priming阶段作为心肌细胞中NLRP3炎症小体激活的启动步骤,与心肌细胞中NLRP3炎症小体的激活密切相关。Sal B作为丹参中药理活性最强的水溶性成分之一,具有良好的抗炎活性。本实验结果表明,Sal B能够有效抑制缺氧诱导后心肌细胞中NLRP3炎症小体的priming阶段相关基因与蛋白表达,减少cTn等心肌损伤标志物和IL-1β等炎症因子的分泌,并减弱心肌细胞缺氧损伤,这为Sal B在临床上抗心肌缺血的应用提供了一定参考。但本实验仅在体外进行了验证,未能对相关信号通路进行更加充分的研究,后续将加入动物实验,更加明确Sal B抑制NLRP3炎症小体激活的机制。

Fig 5 Sal B inhibited protein expression of NLRP3 priming after hypoxia(n=3)*P<0.05,**P<0.01 vs Control
总之,Sal B能够有效抑制缺氧诱导的H9C2心肌细胞损伤,其作用机制可能与抑制NLRP3炎症小体priming阶段的激活有关。

