大豆苷元对人非小细胞肺癌A549、H1299细胞增殖、迁移能力的影响及机制
成 琼,李 真,陈锦辉,向 铮,张献伟,孔令非
(河南省人民医院病理科,郑州大学人民医院,河南 郑州 450003)
肺癌是最常见的恶性肿瘤,其新发病例和死亡病例均居世界第一,其中非小细胞肺癌约占全部肺癌患者的80%左右[1]。随着我国工业化进程加快、环境污染加重、人口老龄化加剧,肺癌已成为我国发病率和死亡率最高的恶性肿瘤,严重危害着大众的健康和生命。近年来,尽管肺癌的治疗手段已经取得了巨大进步,但是肺癌患者的5年生存率还是不到20%,究其原因就是肺癌的高侵袭力及高转移性[2]。因此,抑制肿瘤细胞增殖、降低其侵袭及转移是肿瘤患者治疗的基础。
我国中医中药用于治疗肿瘤历史悠久,因其具有多靶点、疗效好、毒性低,已成为肿瘤药物研发的重要来源之一[3]。大量实验结果表明,来源于大豆异黄酮、葛根、亚麻籽等天然植物所含的植物雌激素,也具有预防和抑制肿瘤发生的作用[4]。植物雌激素主要分为异黄酮、木酚素、黄豆素以及真菌雌激素等四大类[5]。有研究发现,豆类食物因其含有的异黄酮类物质能减弱乳腺癌细胞增生。适当增加豆类食物的摄入量可降低乳腺癌和其他肿瘤的发生[6]。染料木黄酮及其前体物质禅宁A是植物雌激素的一种,对前列腺癌、胃癌、食管癌及直肠癌肿瘤细胞也有显著抑制作用[7-8]。
大豆苷元(daidzein,Daid)属异黄酮中的一种,与染料木黄酮同属大豆异黄酮中活性最显著的两类[9]。目前,大量研究都集中在对染料木黄酮的研究,而大豆苷元的生物学作用研究鲜见报道。大豆苷元是否与大豆异黄酮类似,也有诱导癌细胞凋亡、抑制肿瘤迁移侵袭的作用?本实验旨在体外观察Daid对肺癌细胞株A549和H1299增殖及迁移的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人非小细胞肺癌细胞株H1299和A549均购自中国科学院上海细胞库。于37 ℃水浴复苏,移至培养皿中,加入适量含10%胎牛血清的培养基,置于37 ℃、5%CO2培养箱中培养备用。
1.1.2试剂 DMEM高糖培养基购自Hyclone公司(货号:SH30022.01,批号:AE25719272),新生牛血清购自美国Gibco公司(货号:10270106)。Daid购自Sigma公司(货号:D7802,批号:077M4015V),纯度≥98%,以DMSO溶解后备用。牛血清白蛋白(BSA)购自美国Amresco公司(货号:0332)。Cleaved Caspase-3抗体购自Cell Signaling Technology公司(货号:9665)。LC3Ⅱ/Ⅰ抗体购自美国Novus Biological公司(货号:NB100-2220)。Transwell小室购自美国Corning公司(货号:3422)。β-actin一抗(货号:AF0003)、细胞裂解液(货号:P0013B)、CCK-8试剂盒(货号:C0037)、ECL反应液(货号:P0018M)均购自碧云天生物科技有限公司,其他试剂为国产分析纯。
1.1.3仪器 细胞培养箱(Thermo Scientific公司);酶标仪(Thermo Scientific公司);倒置相差显微镜(Olympus公司);电泳仪、电泳槽及化学发光成像仪(Bio-Rad公司)。
1.2 方法
1.2.1CCK-8法检测Daid对肺癌细胞株A549和H1299增殖的影响 将对数生长期的A549和H1299细胞以0.5×105/孔的密度接种于96孔培养板。待细胞贴壁后,加入终浓度分别为0、5、10、25、50、100、200 μmol·L-1的Daid预处理后,置于37 ℃,5%CO2培养箱培养,每个浓度组设5个复孔。48 h后,每孔加入CCK-8溶液10 μL继续培养4 h。酶标仪检测各组A549和H1299细胞的吸光度值,计算细胞生长抑制率。
1.2.2细胞划痕实验检测肺癌细胞株A549和H1299迁移能力 将处于对数生长期的A549和H1299细胞接种到6孔板中,控制密度在80%左右。待细胞完全贴壁后,加入终浓度为100 μmol·L-1的Daid,换用无血清培养基37 ℃培养过夜。在6孔板内每孔用枪头划两条相互垂直的线,光学显微镜下观察,拍摄各孔细胞0、6、12、18和24 h时间点细胞的划痕状态,并计算24 h细胞迁移率。迁移率/%=(划痕面积0 h-划痕面积24 h)/划痕面积0 h×100%。
1.2.3Transwell小室实验检测肺癌细胞株A549和H1299迁移能力 A549和H1299细胞加入Daid预处理后,胰酶消化收集细胞,并用无血清培养基制成浓度为3×104个/mL的细胞悬液,取150 μL加入Transwell小室的上室,下室加入600 μL含有10% FBS的DMEM培养基,继续在孵育箱中培养24 h。取出Transwell小室,甲醇固定0.5 h,结晶紫染色数分钟,用湿棉签擦去上室底部膜表面未迁移的细胞。倒置显微镜下随机取5个视野拍照、计数及统计学分析。
1.2.4Transwell小室检测肺癌细胞株A549和H1299侵袭能力 步骤同上,经Daid预处理的A549和H1299细胞用无血清培养基制成3×104·mL-1的细胞悬液。Transwell小室表面铺50 μl Matrigel胶(DMEM培养基稀释),置于37 ℃培养箱中过夜以形成基质屏障膜。将Transwell小室放于24孔板中,Transwell小室下室中加入10% FBS的DMEM培养基。24 h后拍照、计数及统计学分析。
1.2.5Western blot检测Caspase-3和LC3Ⅱ/Ⅰ蛋白的表达 PBS冲洗细胞2次,加入细胞裂解液,用细胞刮轻轻挂下贴壁细胞,收集至EP管中,4 ℃、12 000 r·min-1离心10 min,吸上清获取细胞总蛋白,BCA法测蛋白浓度。蛋白样品用12% SDS-PAGE电泳跑胶后转膜至PVDF膜上。BSA室温封闭2 h后加入按1 ∶1 000稀释的β-actin、Cleaved Caspase-3和LC3Ⅱ/Ⅰ抗体中4 ℃过夜。充分洗膜后加入适当稀释比例的二抗,室温孵育1 h,ECL显影,化学发光成像分析仪中曝光。采用Image J图像分析软件分析条带灰度值,计算各组目的条带和内参条带的比值,比较各组间的差异。

2 结果
2.1 Daid对肺癌细胞株H1299和A549增殖活性的影响Daid作用于肺癌细胞株48 h后,CCK-8法检测不同剂量Daid对细胞增殖活性的影响。如Fig 1所示,与溶剂对照组(Daid 0 μmol·L-1)相比,Daid可明显抑制H1299及A549的增殖能力,且抑制作用呈浓度依赖性(P<0.05)。
2.2 Daid对细胞划痕愈合能力的影响Daid预处理48 h后,划痕愈合实验检测Daid对细胞划痕愈合速度的影响。实验结果显示,在0 h Control组和Daid组(100 μmol·L-1)细胞的迁移距离无明显差异,而48 h后Daid组(100 μmol·L-1)相对于溶剂对照组细胞迁移距离有所减慢,差异有统计学意义(P<0.05)。提示Daid可抑制肺癌细胞的迁移能力。

Fig 1 Effect of Daid on proliferation of lung cancer A549 and H1299 cells
*P<0.05,**P<0.01vsControl

Fig 2 Effect of Daid on wound healing ability of
*P<0.05vsH1299-Control;**P<0.01vsA549-Control
2.3 Daid抑制肺癌细胞的迁移能力如Fig 3所示,在Daid作用于H1299、A549两种肺癌细胞48 h后,Daid组迁移的细胞相对于Control组明显减少。以Control组迁移细胞为100%计算,Daid组迁移细胞的百分比分别下降至51.5 %和72.2%,差异有统计学意义(P<0.05)。提示Daid对肺癌细胞的迁移能力具有重要调节作用。

Fig 3 Effect of Daid on migration of *P<0.05, **P<0.01 vs Control
2.4 Daid抑制肺癌细胞的侵袭能力实验结果显示,在Daid作用于细胞48 h 后,Daid组发生侵袭的细胞数量相对于Control组明显减少,侵袭细胞的百分比下降至71.5 %和75.4%,差异有统计学意义(P<0.05)。提示Daid对肺癌细胞的侵袭能力也可能具有重要调节作用(Fig 4)。
2.5 Daid对肺癌细胞凋亡及自噬相关蛋白Cleaved Caspase-3、LC3 Ⅱ/Ⅰ表达的影响由Fig 5的Western blot结果表明,Daid(100 μmol·L-1)作用于H1299和A549两种细胞株48 h后,与Control组比较,细胞中Cleaved Caspase-3蛋白表达明显升高,LC3 Ⅱ/Ⅰ蛋白表达也明显升高(P<0.05)。
3 讨论
目前,关于抑制肿瘤早期转移方面的研究进展较为缓慢,究其原因是肿瘤的异质性及对肿瘤转移机制的认识不清。在人类进入21世纪的年代,肺癌的发病率和死亡率仍然居高不下,在相当长的一段时间内仍然是导致人类因癌症死亡的首要疾病。植物雌激素具有雌激素激动剂和阻断剂双重效应,对乳腺癌、前列腺癌、结肠癌等具有良好而深远的应用前景,潜力巨大。通过大量细胞、动物水平实验分析发现,以异黄酮为代表的植物雌激素能较好的抑制肿瘤生成,表现出抑制其转移、抵制侵袭、抗氧化,诱导肿瘤细胞凋亡[10-11]等多种生物活性作用,在预防和抑制肿瘤上前景远大。

Fig 4 Effect of Daid on invasion of
*P<0.05vsControl
化疗药物重要的作用机制之一是促进肿瘤细胞凋亡。凋亡是细胞维持体内环境稳定而采取的一种自杀式基因调控行为,到目前为止,引起细胞凋亡共有三种信号转导途径:死亡受体信号途径、线粒体途径和内质网应激途径[12]。Caspase-3即为内质网应激途径中的凋亡执行蛋白酶。本实验结果显示,不同剂量Daid作用于H1299及A549两种肺癌细胞48 h后,细胞的增殖活性被明显抑制,且随着Daid浓度的增加而呈浓度依赖性。而凋亡蛋白Cleaved Caspase-3表达的增加,也进一步证实Daid抑制肺癌细胞增殖的作用机制可能与诱导其凋亡有关。
自噬是真核细胞所特有的代谢途径,作为细胞内大分子物质的一种降解通路,近年来被广泛关注。机体内环境稳态失衡、受到氧化应激等刺激均可引起细胞自噬发生。细胞启动自我保护,将待降解的细胞器或胞质蛋白包装成自噬体,与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,藉此实现细胞本身的代谢需要和某些细胞器的更新[11]。在恶性肿瘤的发生、发展中,肿瘤细胞常常出现自噬功能的紊乱。控制肿瘤细胞的自噬有可能成为改善肿瘤治疗的方向之一[13]。微管相关蛋白轻链3(LC3 Ⅱ/Ⅰ)是自噬活性标志物,可反映自噬活性[14]。本研究结果显示,与对照组相比,Daid可上调A549和H1299细胞自噬相关蛋白LC3 Ⅱ/Ⅰ蛋白的表达,表明Daid有促进肺癌细胞自噬作用。
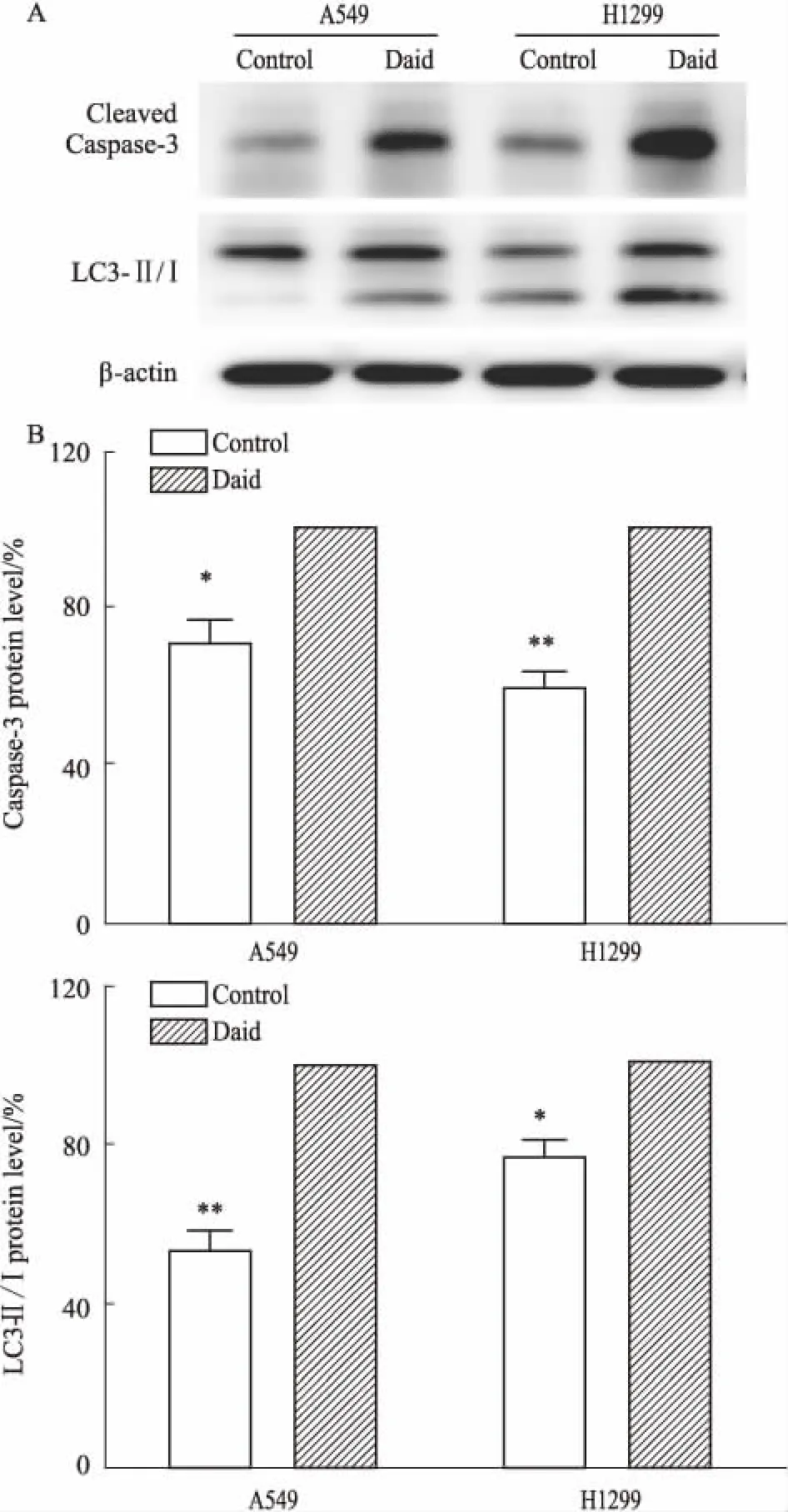
Fig 5 Effect of Daid on cleaved Caspase-3 and LC3 Ⅱ/Ⅰ protein expression in lung cancer n=3)
*P<0.05,**P<0.01vsControl
综上所述,本研究证实Daid可抑制人肺癌细胞株A549和H1299的增殖,促进其凋亡,并引起LC3 Ⅱ/Ⅰ等自噬蛋白表达的改变,提示凋亡及自噬可能参与Daid抑制肺癌细胞增殖的过程,但其具体作用机制及自噬是否为诱发细胞凋亡的直接因素等,有待进一步深入研究。

