土壤含水量对白芨与菌根真菌共生关系的影响
刁海欣 黄清俊 苗利媛 曾歆花 黄卫昌
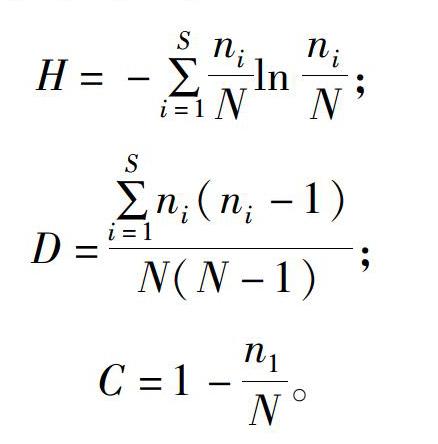
摘要:采用石蜡切片技术、DNA分子鉴定技术和稳定同位素技术相结合的手段,研究不同土壤碳氮含量对白芨菌根真菌多样性、菌根结构特征及碳氮稳定同位素特征和光合特性的影响。结果表明,不同土壤含水量条件下,白芨菌根真菌共鉴定出305个OTU,8门99属。菌根真菌总物种数和α多样性指数随着土壤含水量的减少而增加(土壤含水量为15%的真菌总数比土壤含水量为45%时多了18个OTU);同时随着土壤含水量的降低,优势菌根真菌逐渐转变为伞菌纲Agaricomycetes、Serendipita和肉座菌目Hypocreales真菌;基于门水平,子囊菌门Ascomycota真菌丰度随着土壤含水量减少而明显减少,而担子菌门Basidiomycota真菌丰度波动不大;菌根真菌侵入方式不受土壤含水量影响,均是通过通道細胞进入皮层组织,但菌丝团数量和侵染率随着土壤含水量的减少而降低;此外,白芨叶片的碳氮同位素丰度随着土壤含水量的减少而逐渐增加,净光合速率却随之明显下降,土壤含水量为45%时是白芨与菌根共生的最佳水平。研究结果明确了白芨与菌根真菌共生关系对土壤含水量变化的响应以及对土壤含水量的耐受范围,为白芨属植物野生种群恢复提供参考。
关键词:白芨;菌根真菌多样性;高通量测序;显微结构;碳氮稳定同位素;土壤含水率
中图分类号:S682.310.1文献标志码:A
文章编号:1002-1302(2020)22-0122-09
作者简介:刁海欣(1994—),女,河南商丘人,硕士研究生,主要从事兰科植物菌根生态学研究。E-mail:dhxtx1216@163.com。
通信作者:曾歆花,博士,助理研究员,主要从事兰科植物与菌根真菌共生关系研究,E-mail:zengxinhualuxi@163.com;黄卫昌,博士,教授级高级工程师,主要从事兰科植物保育研究,E-mail:hwc_zx@126.com。
大多数兰科植物都与菌根真菌形成密切的共生关系[1]。近年来大部分兰科植物的野生物种和生境生态都遭到严重破坏,已被列为濒危物种[2]。研究表明,土壤水分含量是影响兰科植物与菌根真菌共生关系的关键因素[3-5]。魏明等研究发现,在干旱胁迫下菌根真菌可以提高石斛的相对含水量和体内抗氧化酶活性,增强植株对干旱的耐受性[6]。Diez指出,兰科植物的种子萌发需要适宜的共生真菌,并且受土壤湿度、有机物和酸碱度的影响[7]。McCormick等研究发现,兰科植物与胶膜菌属真菌在正常环境条件下形成互惠共生体,但在干旱条件下,共生真菌会由胶膜菌属真菌转换为其他真菌物种[8]。DNA分子鉴定技术是当前研究菌根真菌多样性的有效手段,可以明确菌根真菌物种组成及丰度变化等情况,进而了解二者共生关系对干旱的响应机制,为兰科植物保育工作提供参考。
白芨(Bletillastriata)是地生兰,其药用和观赏价值很高[9]。当前菌根生态学逐步得到重视,但土壤因子对白芨与菌根真菌共生关系的影响研究不足。本研究对白芨进行分子鉴定、显微切片观察及碳氮稳定同位素和光合参数测定,比较不同土壤含水量条件下白芨菌根真菌多样性、真菌侵染过程和生态适应性的差异,探讨白芨与菌根真菌共生关系对土壤含水量变化的响应机制,明确适宜干旱逆境的优势菌根真菌及量化最佳的土壤湿度条件。
1材料与方法
1.1材料
白芨采自上海辰山植物园竹林的2年生人工栽培种,种源地为江西崇义。于2019年4月挖取60株无病虫害、长势较好且规格一致的幼苗,同时修剪干枯、有虫害的营养根。
火山泥与黄沙(体积比1.5∶1)混合基质,使用前在121℃的高压灭菌锅内灭菌30min,风干2d后备用。
1.2方法
1.2.1试验设计
设置4个土壤含水量水平,分别为15%(W1)、25%(W2)、35%(W3)、45%(W4),以W4(土壤最适含水量)为控制对照组,每个水平10个重复。每盆(口径高度为10.20.95cm)加入相同的混合基质505g,每盆种植1株幼苗。将所有盆栽放置于室外,并定期浇充足的雨水,保证幼苗健壮生长。白芨种植1个月后,水分胁迫处理3个月,每隔1d浇1次水。土壤含水量通过称质量法(HJ613—2011《土壤干物质和水分的测定重量法》)计算获得:首先在铝盒中放入20g风干土样并称质量,然后105℃烘干6h,直至恒质量,计算出土壤含水量,进而换算出每个土壤含水量水平下每盆需要的浇水量。
1.2.2DNA分子技术
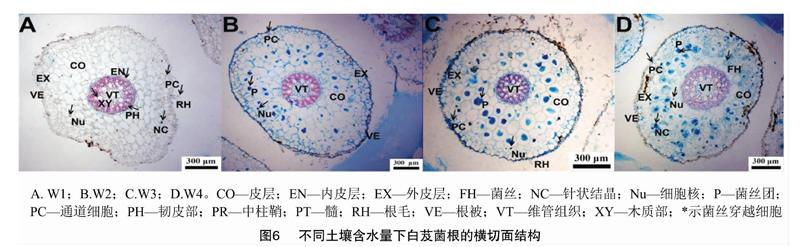
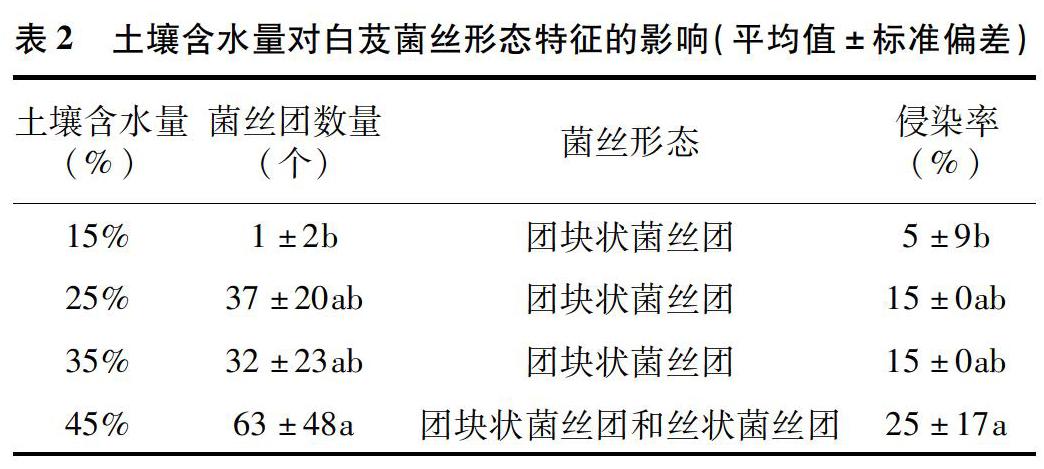
2019年7月采集白芨营养根,每个土壤含水量水平选择6个植株,2株为1个重复,共3个重复。每个植株取3~5个长势良好的营养根,将其放入已编号的塑封袋中,并立即装入冷藏保温袋中带回实验室处理。首先用流水冲洗根表面泥沙等杂质,然后依次按下面步骤消毒灭菌:无菌水30s,70%乙醇2min,2.5%次氯酸钠溶液5min,70%乙醇30s,无菌水冲洗3次。一部分根放入无菌塑封袋中于-80℃保存用于后续分子生物学鉴定;另一部分放入FAA固定液中(1d 利用FastDNASpinKitforSoil(MPBiomedicals,美国)提取菌根真菌总DNA,并用1%的琼脂糖凝胶电泳检测DNA质量,DNA浓度和纯度测定采用NanoDrop2000法。对白芨菌根真菌ITS序列进行PCR扩增(特异引物为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS4R:5′-TCCTCCGCTTATTGATATGC-3′),扩增流程:95℃预变性3min;95℃变性30s,55℃退30s,72℃延伸45s,37个循环;72℃稳定延伸10min,最终10℃保存。其中PCR反应体系(20μL)为:5×TransStartFastPfu缓冲液4μL,2.5mmol/LdNTPs2μL,5μmol/L上游引物0.8μL,5μmol/L下游引物0.8μL,TransStartFastPfuDNA聚合酶0.4μL,BSA0.2μL,模板DNA10ng,补足ddH2O。每个样本3个重复。在Illumina公司的MiseqPE300平台上测序(上海美吉生物医药科技有限公司),并将原始数据上传至NCBISRA数据库(SequenceReadArchive,http://www.ncbi.nlm.nih.gov/Traces/sra)(序列号:SRP256191)。 使用上海美吉生物医药科技有限公司云平台进行交互式生物信息云分析(http://www.i-sanger.com)。其中原始序列使用Trimmomatic软件进行质控,使用FLASH软件拼接序列,使用UPARSE软件(version7.1http://drive5.com/uparse/)OTU聚类分析序列(相似度:97%),利用RDPclassifier(http://rdp.cme.msu.edu/)以及比对Unite(Release6.0http://unite.ut.ee/index.php)真菌数据库(比对阈值:70%)注释序列;使用mothur(versionv.1.30.1http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)分析菌根真菌多样性指数,包括丰度(S)、香农指数(H)、辛普森指数(D)和覆盖率(C),同时可操作分类单元(OTU)相似水平为97%。计算公式如下: 1为仅有1条序列的OTU数量,个。 1.2.3石蜡切片技术 用无菌刀片把营养根切成2~3mm的根段。常规石蜡切片制作,即脱水、透明、浸蜡(石蜡熔点:56~60℃)、包埋、切片(厚度:8μm)、粘片、脱蜡、染色(番红固绿对染)、封片(中性树胶)。随机选取不同土壤含水量水平的切片于光学显微镜下观察。菌丝条条清晰、明显疏松的菌丝团是丝状菌丝团,而菌丝结构难辨的致密菌丝团是团块状菌丝团[3]。 参照Biermann等提出的根段侵染率加权法[10]计算真菌侵染率:每个水平随机选择300个视野,并将根段侵染程度划分为4个等级,即C0、C1、C2和C3,其中C0表示皮层细胞中无菌丝团,C1、C2和C3分别表示1%~30%、31%~60%和>60%的皮层细胞中有菌丝团。计算公式如下: 1.2.4稳定同位素技术 于2019年7月底采集白芨新鲜叶片,每个土壤含水量水平选择6株健壮植株,2株为1个重复,共3个重复。每株取3张长势良好的叶片。同时采集自养非兰科植物作为对照的叶片,即花叶滇苦菜、龙葵、小飞蓬、莲子草,每个物种3次重复,每次6张叶片。流水冲洗干净叶片,置于烘箱120℃杀青20min,65℃烘干48h至恒质量,最后粉碎烘干的叶片。用锡箔杯包裹2~4mg叶样后,在元素分析仪内燃烧并被还原为纯净的CO2和N2气体,CO2稀释后进入稳定同位素质谱仪检测。用相对丰度(δ值)表示稳定同位素的自然丰度变化,公式如下: 1.2.5叶绿素含量测量和光合参数测定 1.2.5.1叶绿素含量测定 于2019年7月底采用丙酮-乙醇(体积比1∶1)混合液法测量白芨叶片的叶绿素含量[11]。每个水平选择6株健壮植株,2株1个重复,共3个重复。用孔径R=6mm的打孔器在相同位置(避开主脉)的新鲜叶片上打孔4片,约1.13cm2;切成细丝放入5mL丙酮-乙醇混合液中,并用錫纸包裹试管,浸提24h,期间摇晃3~4次,使绿色尽可能褪完全;吸取1.5mL浸提液于比色皿中,用紫外可见分光光度计分别测量波长645nm和663nm处的吸光度。计算公式如下: 1.2.5.2光合参数测定 于2019年7月底,09:00—11:00(晴朗天气),使用Li-600XT光合仪测定白芨叶片的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率。每个水平选择6株长势良好的植株,2株为1个重复,共3个重复。测量上部完全开展的第1、第2张功能叶(从上往下数第2、第3张)的中部,同时光合仪设置为:LED2×3光源,光照度为500μmol/(m2·s),CO2浓度与环境浓度相近,流速设置为500μmol/s。 1.3数据处理 利用Excel2010和SPSS25.0软件进行数据分析,其中使用单因素方差分析(one-wayANOVA)比较白芨在不同土壤含水量条件下菌根真菌多样性指数、菌丝团数量、碳氮稳定同位素丰度值和净光合速率的差异,并用Duncans多重比较分析显著性(P<0.05);白芨叶片碳氮稳定同位素丰度与光合参数的相关分析采用Pearson相关性分析;利用OriginPro9.1软件作柱形图。 2结果与分析 2.1土壤含水量对菌根真菌多样性的影响 2.1.1白芨菌根真菌Alpha多样性分析 由表1可知,基于OTU水平,土壤含水量对白芨菌根真菌多样性产生一定的影响。白芨菌根真菌群落丰度随着土壤含水量的减少而增加,其中土壤含水量为15%时达到顶峰,为79;土壤含水量为25%时次之,为77;土壤含水量为45%和35%的真菌丰度较低,分别为45和41。不同土壤含水量水平的菌根真菌香农指数、辛普森指数和覆盖率无显著差异。 2.1.2白芨菌根真菌的Venn图分析 分别在OTU水平和属水平对白芨不同土壤含水量水平的菌根真菌多样性进行比较。由图1-A可知,4个土壤含水量水平的菌根真菌总物种数为305个OTU。在不同土壤含水量条件下,菌根真菌总数存在差异。土壤含水量为15%时最高(143个),其次是土壤含水量25%(140个)、土壤含水量45%(125个)、土壤含水量35%(91个)。白芨特有菌根真菌数随着土壤含水量的减少而发生一定变化,土壤含水量45%(62个)明显高于土壤含水量15%(54个)、25%(43个)和35%(20个)。此外,各土壤含水量水平之间都有数量不一的重叠真菌,其中4个水平的共有真菌有14个OTU。 图1-B呈现出在土壤含水量条件下菌根真菌共99属。白芨菌根真菌总属数在不同土壤含水量水平下存在差异,其中土壤含水量45%和15%的属总数较高,分别是55属和47属;土壤含水量35%次之,为39属;土壤含水量25%最少(36属)。在不同土壤含水量条件下,特有菌属数目情况与属总数有一定类似,土壤含水量45%(24属)>15%(15属)>25%(9属)>35%(7属)。除此之外,不同土壤含水量之间存在不同数量的重叠菌属。 2.1.3白芨菌根真菌群落组成 在不同土壤含水量条件下,白芨菌根真菌物种组成存在显著差异。从图2可以看出,子囊菌门丰度随着土壤含水量的减少而降低,土壤含水量为45%时最高(74.91%),土壤含水量为15%时仅为16.83%;而担子菌门丰度在不同土壤含水量水平下波动不大。此外,鉴定出壶菌门Chytridiomycota分布于土壤含水量15%(2.76%)和25%(10.10%)中,少量的被孢霉门Mortierellomycota真菌出现在土壤含水量15%和35%中。 在属水平上,不同土壤含水量水平下的菌根真菌群落组成也存在一定差异(图3)。本研究将某一真菌占菌群总物种数的百分比≥10%判断为优势真菌,1%~10%的为常见真菌,≤1%的为稀有真菌[12]。随着土壤含水量的减少,白芨的优势菌根菌群种类发生改变。其中土壤含水量为45%(W4)中的双足囊菌属Dipodascus(OTU83、OTU832、OTU107等5个OTUs)、篮状菌属Talaromyces(OTU877、OTU103、OTU80等5个OTUs)和Cutaneotrichosporon(OTU73、OTU71)占优势地位;土壤含水量为35%(W3)时,新赤壳属Neocosmospora(OTU878、OTU874、OTU697)、篮状菌属(OTU877、OTU103、OTU554)和镰孢属Fusarium(OTU79、OTU727)占主导地位;土壤含水量为25%(W2)时菌根真菌中以伞菌纲(OTU360、OTU198、OTU783等9个OTUs)和肉座菌目(OTU801)为优势菌属;土壤含水量为15%(W1)中竞争力较高的菌根真菌是伞菌纲(OTU398、OTU287和OTU246)和Serendipita(OTU289、OTU356、OTU203等6个OTUs)真菌。受土壤含水量影响,共有真菌的丰度在含水量较少的处理中明显下降,如青霉属Penicillium(从W4中的5.71%下降到W1中的0.52%,转变为稀有真菌)。常见真菌数量随着土壤含水量的减少显著下降,种类也会存在差异。如土壤含水量为45%的常见菌根真菌有单胞菌属Kazachstania(7.29%)、新赤壳属(6.99%)、青霉属(5.71%)等13属,而土壤含水量为15%时只鉴定出Cutaneotrichosporon(5.46%)、短梗霉属Aureobasidium(4.95%)、丝核菌属Rhizoctonia(2.63%)等10属。 2.1.4白芨菌根真菌Lefse多级物种差异判别分析 由图4-A可见,土壤含水量为15%和45%时存在有显著差异的真菌。其中土壤含水量为15%时存在1组有显著丰度差异的真菌类群,为散囊菌纲Eurotiomycetes(从纲到目);土壤含水量45%有2组显著丰度差异的真菌,即子囊菌门(从纲到属)和被孢霉属Mortierella(从门到属)。此外,土壤含水量15%和45%中占主要优势的真菌分别是散囊菌纲Eurotiomycetes[JP3]和被孢霉科Mortierellaceae(图4-B)。 2.1.5白芨菌根真菌Beta多样性分析通过Beta多样性分析不同土壤含水量水平之間菌根真菌多样性的差异。由图5可知,白芨菌根真菌在不同土壤含水量条件下存在差异,同时造成该差异的最大主成分(PC1)可解释其中23.87%的差异。 2.2土壤含水量对菌根真菌侵染过程的影响 2.2.1白芨根部结构 在不同土壤含水量条件下,白芨根部结构一致,从外至内可分为表皮(根被)、皮层、中柱3部分(图6)。但根径、根被厚度和中皮层细胞层数等随着土壤含水量减少无显著差异。在光学显微镜下可观察到根最外围的是若干层扁平砖状表皮细胞(即根被),且土壤含水量为15%时,根被最厚(56.5μm)。根被向内是皮层组织,在根中占最大的比例,又分为外皮层、中皮层和内皮层。外皮层是紧挨着根被的1层长短表皮细胞间隔排列的多角形细胞,其中短的表皮细胞体积较小、近方形且细胞核膨大,又称通道细胞。外皮层向内为中皮层,细胞体积较大,近似等径球形,排列疏松,土壤含水量为15%时细胞层数最多,为(7±1)层。部分皮层细胞中出现针状结晶。中皮层向内是由单层细胞组成的内皮层,细胞体积较小,排列紧密整齐。内皮层向内是由中柱鞘、维管束和髓组成的中柱,经番红固绿对染后,木质部被染成红色,韧皮部被染成蓝色;当土壤含水量为45%时维管束数量最多(11个)。 2.2.2白芨在不同土壤含水量下的菌根真菌侵染方式和菌丝形态特征 由图6可知,在不同土壤含水量条件下,白芨菌根真菌侵染方式无差异,均通过通道细胞进入根的皮层细胞,菌丝穿过细胞壁后继续向邻近细胞扩展并集中分布于皮层细胞的某一区域;染菌细胞的细胞核常膨大,同时可观察到形状不一、呈蓝绿色的菌丝或菌丝团,且菌丝常向细胞核靠近。 由表2可知,白芨的真菌侵染率和菌丝团数量等菌丝特征受土壤含水量的影响存在一定差异。当土壤含水量为45%时的真菌侵染率最高,为25%,共有63个菌丝团;皮层细胞中存在2种不同的菌丝形态,即丝状菌丝团和团块状菌丝团,且丝状菌丝团居多;邻近染菌细胞的未侵染细胞的细胞核膨大,番红固绿对染后呈红色。当土壤含水量为25%和35%时,真菌侵染率均下降为15%,并以团块状菌丝团为主,但菌丝团数量存在差异,土壤含水量25%(37个)高于土壤含水量35%(32个)。当土壤含水量为15%时菌根真菌侵染率最低(5%),仅存在少量菌丝残结。 2.3土壤含水量对白芨碳氮同位素特征和光合特性的影响 2.3.1土壤含水量对白芨碳氮同位素特征的影响 在不同土壤含水量水平下,白芨叶片的δ13C值均明显高于对照植物,不同土壤含水量水平之间白芨[CM(22]δ13C值变化很小,δ13C值介于-26.99‰~-28.19‰之间,变幅为1.2‰。由图7可知,不同土壤含水量水平之间Δδ13C值无差异。白芨叶片的δ15N在不同土壤含水量水平下低于对照植物,δ15N值范围为1.29‰~2.32‰。同时Δδ15N随着土壤含水量的减少而增加,其中当土壤含水量为15%时Δδ15N值最高,为-1.14‰;土壤含水量为25%和35%次之;土壤含水量为45%时Δδ15N值最低,-2.18‰(图7)。对白芨叶片δ13C、δ15N和土壤含水量进行相关分析,发现δ13C与土壤含水量呈极强负相关(相关系数为-0.824),δ15N与土壤含水量呈显著负相关(相关系数为-0.974,P<0.05),同时δ13C与δ15N呈极强正相关(相关系数为0.933)(表3)。 2.3.2土壤含水量对白芨光合特性的影响 不同土壤含水量条件下,菌根真菌对白芨光合特性产生影响。白芨叶片的叶绿素总量在不同土壤含水量条件下无差异,但叶片净光合速率、气孔导度、蒸腾速率和胞间CO2浓度存在显著差异(图8)。净光合速率、气孔导度和蒸腾速率随土壤含水量的减少而明显降低。当土壤含水量为45%(W4)时,叶片净光合速率6.65μmol/(m2·s)明显高于其余3个土壤含水量水平;W4的气孔导度0.10mol/(m2·s)也是明显高于其余3个土壤含水量水平;同时蒸腾速率随土壤含水量的减少而逐渐降低,即W4[JP3][2.36mmol/(m2·s)]>W3[1.55mmol/(m2·s)]>[JP4]W2[0.63mmol/(m2·s)]>W1[0.17mmol/(m2·s)]。随土壤含水量的减少,胞间CO2浓度在土壤含水量为15%(W1)时达到顶峰(282.02μmol/mol),而土壤含水量25%(W2)最低(157.93μmol/mol)。此外,δ13C与净光合速率呈极强负相关,与气孔导度呈强负相关;δ15N与净光合速率呈极强负相关(P<0.05),与气孔导度呈极强负相关(表3)。 3讨论与结论 本研究从细胞水平与分子水平、形态及生理等方面研究土壤含水量对白芨与菌根真菌共生关系的影响。结果表明,土壤含水量为45%时是白芨与菌根共生的最佳水平;干旱胁迫条件下,菌根真菌会通过增加物种多样性和改变菌根真菌群落组成来增加对兰科植物的养分供给,从而弥补干旱对植物所造成的生理伤害。 对于地生兰植物来讲,影响植株生长的土壤因子和影响兰科植物分布的因子是不可分割的[8]。土壤因子对兰科植物的重要性以及它是如何改变兰科植物与菌根真菌共生关系是生态学的一个重要领域,而这方面的知识在很大程度上仍知之甚少。干旱常被证明是造成地生兰植物种群分布的重要因素[13],同时土壤濕度和透气性会直接影响菌根真菌的生长发育和菌根共生体的形成[1]。我们观察到白芨菌根真菌总数和优势菌属数随土壤含水量的减少而增加,最有可能的解释是土壤含水量缺乏时,菌根真菌的多样性增加是为了提高白芨的抗旱性,缓解干旱胁迫[14]。本研究发现随着土壤含水量的减少,白芨优势菌属最终被伞菌纲(OTU398、OTU287、OTU246)和蜡壳耳目(OTU289、OTU356、OTU764)真菌所替代,可见这些真菌更适宜在干旱环境中生存并促进白芨菌根共生体的形成,对白芨应对干旱胁迫有重要的意义。这也进一步验证了McCormick等的研究结果:干旱条件会抑制斑叶兰接触菌根真菌,迫使植物转换共生真菌[8]。水分胁迫会抑制光合作用,降低蒸腾速率,阻碍植物生长[15]。本研究结果与以往研究结果一致,即白芨叶片的净光合速率、气孔导度和蒸腾速率均随着土壤含水量的减少而下降。结合菌根真菌的种类随着土壤含水量减少有所增加的结果,可以推测干旱对白芨所造成的生理伤害更严重,而菌根真菌只能缓解干旱胁迫程度,并无法完全弥补这一伤害。鉴于土壤含水量、菌根真菌和白芨三者之间的相互关系,未来在白芨等其他兰科植物的栽培管理上一定要注意保证土壤水分充足,同时筛选出抗旱菌根真菌,针对性制备菌剂,为兰科植物保育提供参考依据。 白芨菌根真菌的侵入方式不受土壤含水量的影响,均是通过通道细胞进入皮层细胞,且菌丝穿过细胞壁侵染邻近细胞继续扩展,最终在皮层细胞中定殖。这与郭顺星的研究结果[16]类似,指出白芨菌根真菌是通过根毛和通道细胞侵入菌根内。白芨菌根真菌的侵染率和菌丝团数量随土壤含水量的减少而下降,但白芨菌根真菌总数随土壤含水量的减少而增加,可见菌根真菌侵染率和菌丝团数量只能作为不同土壤含水量条件下菌根差异比较的指标,但不可作为判断真菌多样性的标准。有研究表明菌丝团形态代表某一菌根真菌种类的一种表现形态[17]。本研究发现当土壤含水量为45%时存在2种形态的菌丝团(丝状和团块状),而土壤含水量减少后仅存在团块状菌丝团。由此推测,这是白芨在不同土壤含水量条件下需要依赖不同的菌根真菌造成的。 总之,白芨与菌根真菌共生关系对土壤含水量缺乏的响应是由土壤水分缺乏程度、白芨、菌根真菌等多种因素影响的复杂反应过程,有待于进一步深入研究二者共生关系响应干旱胁迫的分子机制。 参考文献: [1]刘润进,陈应龙.菌根学[M].北京:科学出版社,2007:35-36,221-222. [2]梁宇,郭良栋,马克平.菌根真菌在生态系统中的作用[J].植物生态学报,2002,26(6):739-745. [3]McCormickMK,WhighamDF,ONeillJP,etal.AbundanceanddistributionofCorallorhizaodontorhizareflectvariationsinclimateandectomycorrhizae[J].EcologicalMonographs,2009,79(4):619-635. [4]GaleSW,YamazaiJ,HutchingsMJ,etal.Constraintsonestablishmentinanendangeredterrestrialorchid:acomparativestudyofinvitroandinsituseedgerminabilityandseedingdevelopmentinNervilianipponica[J].BotanicalJournaloftheLinnaeanSociety,2010,163(2):166-180. [5]PhillipsRD,BrownAP,DixonKW,etal.Orchidbiogeographyandfactorsassociatedwithrarityinabiodiversityhotspot,theSouthwestAustralianFloristicRegion[J].JournalofBiogeography,2011,38(3):487-501. [6]魏明,童秦怡,柴瑞娟,等.兰科菌根真菌对干旱胁迫下铁皮石斛生长和抗氧化能力及相关基因表达的影响[J].西北植物学报,2018,38(10):1905-1912. [7]DiezJM.Hierarchicalpatternsofsymbioticorchidgerminationlinkedtoadultproximityandenvironmentalgradients[J].JournalofEcology,2007,95(1):159-170. [8]McCormickMK,WhighamDF,SloanD,etal.Orchid-fungusfidelity:amarriagemeanttolast?[J].Ecology,2006,87(4):903-911. [9]QianCD,JiangFS,YuHS,etal.AntibacterialbiphenanthrenesfromthefibrousrootsofBletillastriata[J].JournalofNaturalProducts,2015,78(4):939-943. [10]BiermannB,LindermanRG.Quantifyingvesicular-arbuscularmycorrhizas:aproposedmethodtowardsstandardization[J].NewPhytologist,1981,87(1):63-67. [11]舒展,張晓素,陈娟,等.叶绿素含量测定的简化[J].植物生理学通讯,2010,46(4):399-402. [12]庞雄飞,尤民生.昆虫群落生态学[M].北京:农业出版社,1996:77-103. [13]ReddochJM.PopulationdynamicsandfloweringsynchronyofGoodyerapubescens(Orchidaceae)insouthwesternQuebec,Canada[J].JournaloftheTorreyBotanicalSociety,2007,134(3):379-388. [14]McCormickMK,WhighamDF,ONeillJP.Mycorrhizaldiversityinphotosyntheticterrestrialorchids[J].NewPhytologist,2004,163(2):425-438. [15]向丹,徐天乐,李欢,等.丛枝菌根真菌的生态分布及其影响因子研究进展[J].生态学报,2017,37(11):3597-3606. [16]郭顺星.药用植物内生真菌生物学[M].北京:科学出版社,2016:632. [17]KristiansenKA,TaylorDL,KllerR,etal.IdentificationofmycorrhizalfungifromsinglepelotonsofDactylorhizamajalis(Orchidaceae)usingsingle-strandconformationpolymorphismandmitochondrialribosomallargesubunitDNAsequences[J].MolecularEcology,2001,10(8):2089-2093.

