受体光漂白FRET技术的实践与优化
刘双双,王 君,尹 伟,娄绘芳
(1.浙江大学 医学院公共技术平台,浙江 杭州 310058;2.浙江大学 浙江大学校医院,浙江 杭州 310058)
蛋白质间的相互作用是细胞各种基本功能的主要完成者,对生命活动的调节具有重要意义。许多经典的生物化学方法用于阐明这种相互作用,如免疫共沉淀、酵母双杂交等,但这些方法却无法检测细胞中发生的较弱或瞬态相互作用。荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术克服了光学分辨率的限制,能够精确检测蛋白质间的相互作用。具体是指当这两个荧光基团间的距离小于10 nm 时,基团之间的能量通过偶极-偶极耦合作用,以非辐射方式从供体传递给受体的现象。所以FRET 技术适合研究几纳米内相邻两个分子之间的相互作用[1]。
利用显微镜建立的FRET 技术的4 种方法为光谱成像法、受体光漂白法、敏化发射法和荧光寿命法。其中受体光漂白法不受光渗透的影响,可重复性高,是建立FRET 技术的常用方法[2-3]。但此方法对图像采集和漂白效率具有严格的要求,只有通过优化设置,才能检测到蛋白质之间微弱的相互作用。本文利用Olympus FV1000 共聚焦显微镜介绍受体光漂白法FRET 技术的实现方式及优化方法,并详细阐述了图像展示和数据分析的具体方法。
1 FRET 荧光对的选择
理想的FRET 体系需要样本标记一对荧光基团,这对荧光基团通常称为供体-受体荧光对,需同时满足以下条件:①供体荧光团的发射光谱与受体荧光团的激发光谱具有重叠(>30%)且供体的激发波长对受体无影响。②供体和受体的荧光团彼此紧密相邻(通常为1~10 nm)。③供体和受体的偶极子电极方向大致平行[4-5]。
由荧光团和传感域组成的FRET 生物传感器广泛用来监测邻近分子的变化。根据两个荧光团是否连接到同一分子上,将FRET 生物传感器分为两大类:①分子内类型,供体和受体荧光团与同一分子相连,分子中构象变化诱导产生FRET 现象,可用来检测细胞内Ca2+、cAMP 活性和激酶活性。②分子间类型,供体和受体荧光团融合到不同的分子上,当两个分子非常接近时产生FRET 现象,如检测受体的寡聚化。选择高性能的生物传感器是建立FRET 体系的关键[6-7]。
FRET 生物传感器中的荧光团主要有3 种类型:荧光蛋白、小型有机染料和量子点(QDs)。目前,遗传编码的荧光蛋白是高分辨率成像的最佳选择之一,已有多种基因改造的荧光蛋白用做FRET 荧光对,通过转染或者病毒感染的方式进入到体内或体外细胞,通过显微镜检测FRET 效率,应用较多的有ECFP-EYFP、GFP-RFP 等[8]。但荧光蛋白发射光谱的半高宽为60 nm,甚至超过100 nm,容易产生受体和供体无法分离的重叠现象。因此,荧光蛋白的光谱分布限制了其应用。相比之下,许多合成染料的发射光谱半高宽度为30~40 nm,在测量受体荧光时,供体的串色干扰较少。尤其是红色激发染料(如CY3-CY5)不仅具有更高的光子记数,而且时间寿命长,在生物研究中同样具有较高的应用价值。但是染料在没有抗体帮助的情况下,不具有标记感应域的能力。量子点可用于标记膜成分以检查质膜外部的现象,这些探针无法穿透膜,因此在检测细胞内结构(如核、线粒体、高尔基体)中很少使用[9]。
设计实验时,选择荧光对的主要标准是Förster半径r0,是指发生50% FRET 效率时荧光对的特征距离,根据供体-受体的光谱和偶极子定向参数计算得出,其范围约为3~8 nm。FRET 效率随着Förster 半径、光谱重叠、供体的量子产率、受体的消光系数增加而增大。此外还受到水溶性、抗干扰能力等方面的影响。表1 列出了常用FRET 对的特性[5]。除了待测样本标记符合要求的荧光对外,还需要设定严格的阳性对照和阴性对照,以确保显微镜系统的稳定性。

表1 常用FRET 对及其特性
2 受体光漂白FRET 技术的建立
受体光漂白法是由发生FRET 现象时,抑制供体发射荧光的事实建立起来的方法。对受体进行光漂白,能量转移受到抑制,供体的荧光信号增强[1]。通过检测供体荧光的增强计算FRET 效率。本文以供体为CFP、受体为YFP 的荧光对为例,利用Olympus FV1000 共聚焦显微镜建立FRET 技术,操作流程和步骤如图1 所示。
2.1 设置图像采集参数
采集图像的原则是在保证图像质量的基础上,尽量减少采集时间。在FV10-ASW 软件主界面下,从染料库(dyelist)里选择荧光对,设置荧光光路。通过focus X2 或者focus X4 预扫描图像,适当调节激光通过率,光电倍增管电压值HV 和增益offset 等参数,使图像达到最佳信噪比状态。为了得到高质量图像,可通过“Ctrl+H”快捷键切换到HiLo 模式,查看图像信号强度,信号过强或过弱都无法得到理想结果。
2.2 设置光刺激参数
刺激参数是否合适是FRET 技术成败的关键。设置流程如下:打开“刺激(Stimulation)”窗口,选择主扫描器,设置刺激区域为目标细胞内画出的感兴趣区域,刺激速度为10 μs/pix、刺激光透过率为80%~ 100%。选择刺激程序(Activation in Series),通过“采 集—刺激—刺激后采集”的方式实现受体漂白程序,设置刺激前采集图像3~5 张,刺激时间3~10 s。

图1 光漂白FRET 技术实验设计流程图
完整的FRET 图像采集需要使用共聚焦显微镜的时间序列扫描功能,在时间序列扫描时,设置时间间隔及获取的图像张数。其方法如下:在软件主界面下,点击“Image Acquisition”下面的“Time”按钮进行时间序列扫描,设置图像采集帧数20 张,时间间隔为“Freedom”。然后点击“Capture”按钮运行上述程序。软件将会按照“刺激前采集图像3~5 张—光刺激3~ 10 s—刺激后采集图像15~17 张”的程序运行,结束后点击“Series Done”按钮获得FRET 序列图像。
3 受体光漂白FRET 技术的优化
为了得到真实可靠的数据,获取FRET 图像时需要注意以下几点:首先,受体发生光漂白的同时不会降低供体荧光强度;其次,受体漂白后荧光值达到初始值的10%;最后,受体和供体的荧光信号不宜过强或过弱。如果图像采集或者光刺激设置不当,将检测不到FRET 现象,导致实验失败。经过大量的实验和探索,通过在以下方面进行优化,建立了一套稳定实用的方法。
3.1 图像采集优化措施
图像采集时优化方式:①采集图像时,扫描速度尽量快以减少长时间照射对供体的光漂白,所以扫描尺寸设为512×512 pix,扫描速度为2 μs/pix。②供体的激发光能量尽量低,激光设置在5%以内,以减少采集图像过程中供体发生的光漂白现象。③为防止受体漂白后供体荧光值达到饱和,采集图像时,供体的在荧光强度保持在1 000~2 000 范围内最佳。受体YFP荧光强度在2 000~4 000 范围内最佳,在这个范围内进行光刺激后,如有FRET 现象,供体的荧光增强将更加明显。④选择数值孔径较大的物镜。物镜对于图像的分辨率具有较大的影响,不同物镜的数值孔径不一致,光子汇聚能力也不一样。数值孔径大的物镜,受体的漂白效率高,供体信号增强也更明显。⑤适当增大针孔,每个镜头对应的针孔大小不一致,但都有一个最佳推荐值,建议将针孔增大到推荐值的2 倍及以上,增大针孔后,对应的供体和受体的荧光信号增强。为了达到合适的荧光强度,需要降低供体和受体激发光的透过率,不仅可减少随时间变化产生的供体光漂白,而且可增加待测样品z轴的荧光信息(即增加采样厚度),使FRET 现象更加明显。
3.2 受体光刺激优化措施
受体光刺激时优化方式如下:①配合物镜,选择充分发挥物镜分辨率的ZOOM 值扫描图像,不仅可以增加图像分辨率,还可以在同样的刺激时间内增加受体漂白效率。以60XO(60 倍油镜)为例,ZOOM 值推荐为2。②为防止供体荧光受刺激光的影响,应选择适当的刺激光能量,既不产生过漂白(漂白效率达100%)也不会使漂白效率太低。如发生过漂白,供体容易受到刺激光的影响,信号变弱;如漂白效率过低,供体的信号变化也不明显。漂白效率达90%为佳。③受体光漂白FRET 技术适合用于固定细胞样品,由于强激光能量对活细胞具有高毒性,同时活细胞容易发生漂白后恢复现象,所以不适合在活细胞中应用。
4 图像展示和分析
FRET 现象通过显微图像或者FRET 效率进行展示。FRET 效率E是指能量从供体转移到受体的百分比,与蛋白间距离的关系满足式(1)。其中r是供体和受体偶极之间的距离,r0是Förster 半径[10-11]。

4.1 FRET 图像展示
待测样本进行受体光漂白后,如有FRET 现象发生,供体不再发生能量转移,图像上表现出受体荧光明显增强的现象。HECK293 细胞共同转染CFF 和YFP质粒(表示为CFP+YFP),CFP 和YFP 分别表达在细胞内的不同位置,因距离较远,受体光漂白后,供体荧光信号没有明显增加(见图2),无FRET 现象产生,通常作为阴性对照。HECK293 细胞转染由CFP 和YFP 组成的构建体(表示为CFP-YFP),因CFP 和YFP紧密连在一起,符合共振能量转移的条件,在受体感兴趣区域漂白后供体的荧光强度明显增强(见图3),产生FRET 现象,通常作为阳性对照。图2(a)和3(a)分别为共转染和构建体转染受体漂白后供体的荧光图像,图2(b)和3(b)分别为共转染和构建体转染光漂白受体感兴趣区域,图2(c)和3(c)分别为共转染和构建体转染受体光漂白后供体的伪彩色图像,供体荧光强度增强的现象在伪彩色图像中更加明显。

图2 CFP 和YFP 共转染受体光漂白FRET 图像

图3 CFP-YFP 构建体转染受体光漂白FRET 图像
4.2 计算FRET 效率
通过量化受体漂白前后供体荧光强度的变化计算FRET 效率E,即E=1-(Ipre/Ipost),其中Ipre和Ipost分别是光漂白前后供体的荧光强度。这是一种非常典型的方法,不依赖于图像采集参数的变化,也不依赖供体和受体量子产率和光谱渗透的干扰,因此不需要校正[12]。HECK293 细胞共转染CFP 和YFP 后测得的FRET 效率为0.035,转染CFP-YFP 构建体后测得的FRET 效率为0.208(见图4)。
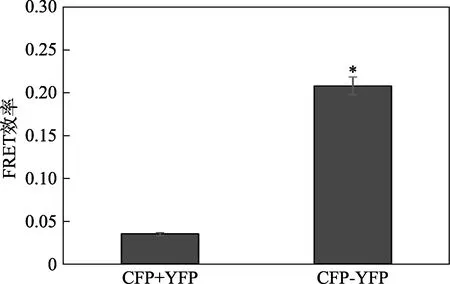
图4 FRET 效率计算结果
FRET 效率计算可通过 ImageJ、cellSense 和Metamorph 等图像处理软件实现。以下为利用ImageJ软件测量FRET 效率的具体实现方法。
(1)测量供体通道中背景荧光强度:用ImageJ 选择工具选择无细胞信号的背景区域并测量荧光强度。
(2)去掉供体通道中的背景:在Process 菜单下选择Math-Subtract,减去第一步中得到的背景荧光强度。
(3)测量漂白前后供体感兴趣区域(ROI)的荧光强度:用ImageJ 选择工具选择供体内感兴趣区域,即受体所对应的光漂白区域;利用ImagJ 的插件Time Series Analyzer 测量光漂白前后供体ROI 内荧光强度的变化。
(4)计算FRET 效率:漂白后供体荧光强度减去漂白前供体荧光强度;然后用漂白后荧光强度做归一化处理,得到FRET 效率;最后从多个ROI 区域得到不同的FRET 效率后,求出平均值。
(5)作为对照,选择细胞内没有漂白区域的同样大小的ROI,测量荧光强度。设置多个对照区域的ROI,求出FRET 效率平均值。
(6)评价漂白区域是否有FRET 现象产生:当FRET 现象发生时,得到的FRET 效率结果在10%~ 40%。
5 结语
1946 年,荧光共振能量转移理论首次被Theodor Förster 阐明,所以也称Förster 能量转移,20 世纪80年代,FRET 技术成功运用到蛋白质结构的研究中。在过去十年中,由于显微镜技术的发展和优化的荧光蛋白及其衍生物的增加,FRET 技术已在生物大分子相互作用、核酸结构功能检测、免疫分析等方面具有广泛的应用[13-15]。
利用显微镜建立FRET 技术有多种方法,其中受体光漂白法仅需要目标样本,不需要大量的校准样本,其统计结果可重复性高,方法简单可靠,应用广泛。主要缺点是光漂白具有破坏性,每个细胞只能使用一次,光漂白是一个相对缓慢的过程,通常需要几秒钟或更长时间,活细胞漂白后容易发生荧光恢复现象,因此较少应用于活细胞动态测量实验。此外,如果受体-供体荧光对的偶极子电极方向不同或它们不位于Förster 半径内,则FRET 效率明显降低。例如,如果两个标记的蛋白质发生了相互作用,但荧光标签位于复合物的对立面,则可能无法检测到FRET 现象。在实际操作中,这种假阴性现象经常发生[16]。所以,在检测到足够可靠的FRET 信号之前,需要进行多种标记策略,多次实验重复。

