高压脉冲电场法提取耐辐射奇球菌中类胡萝卜素的研究
何宇超 程琪琪 吴 莉 张莉莉 范成凯 应南娇 汪 婷 杨 勇
(杭州电子科技大学生命信息与仪器工程学院,浙江杭州 310018)
类胡萝卜素(carotenoid)是一种良好的食品添加剂和营养滋补品,具有极强的自由基清除能力,还具有防癌、抗衰老等功能。据估计,近年来类胡萝卜素全球年度需求量约为1 000 t,已广泛应用于食品、药品、化妆护肤品等各个领域[1]。目前工业上主要从天然果蔬、藻类及微生物中提取天然类胡萝卜素,但存在成本高、价格贵、工艺复杂及着色力差等不足[2],因而如何实现低成本、高附加值的提取天然类胡萝卜素显得尤为重要。研究表明,利用微生物发酵提取类胡萝卜素具有生长周期短,菌体破碎较容易,提取简便、易于控制发酵等优点[3],己成为当前制备天然类胡萝卜素的主要方法。
在可合成类胡萝卜素的微生物中,近年来耐辐射奇球菌(deinococcus radiodurans,DR)受到广泛关注。耐辐射奇球菌是一种不产生孢子的红色非致病性球形细菌[4],是地球上最具辐射抗性的生物之一[5]。该菌体内富含特殊的类胡萝卜素,该类胡萝卜素对电离辐射、强氧化剂、紫外线和干燥等极端胁迫条件均表现出极强的抗性[6],可有效抑制活性氧自由基的产生[7]。Tian 等[8]发现耐辐射奇球菌体内的类胡萝卜素可以防止蛋白质被氧化,还有助于抵抗细胞损伤。因而耐辐射奇球菌已成为制备天然类胡萝卜素的理想菌种,但目前关于耐辐射奇球菌发酵制备类胡萝卜素的研究尚鲜见报道。
目前工业上多采用有机溶剂萃取法[9]、超声辅助提取法[10]、酸热法[11]等方法从微生物体内提取类胡萝卜素,但上述方法均存在一定不足,如有机溶剂萃取法选择性不高、萃取率低等,且常需用多种溶剂进行提取,安全性有待提高[12];超声辅助提取法能耗高、噪声大,对提取物质具有破坏作用,且大规模生产经济性低[13-14];酸热法对设备腐蚀较大,也会破坏提取的类胡萝卜素[15]。高压脉冲电场(pulsed electrical fields,PEF)技术是新兴的非热加工技术,其原理是对两电极间的流态物料反复施加瞬时高电压,以脉冲电场的形式对物料进行处理[16],具有处理时间短、能耗低、可最大程度保留物质活性等优点[17]。目前该技术在食品领域的研究应用主要集中于液态食品灭菌[18]、酶钝化[19]、干燥预处理[20]等方面。研究表明,利用PEF 技术提取河蚌多糖[21]、海带多糖[22]以及人参中多种物质[23]的提取率均高于传统方法。
虽然PEF 技术在物质提取领域已被广泛研究,但利用该技术提取耐辐射奇球菌体内类胡萝卜素却鲜有报道。因此,本研究利用PEF 技术提取耐辐射奇球菌体内的天然类胡萝卜素,采用正交试验,对处理过程中的各项参数和影响因素进行分析及探讨,获取最优提取水平组合,以期为PEF 技术提取天然类胡萝卜素的产业化应用提供数据支持。
1 材料与方法
1.1 材料与试剂
耐辐射奇球菌,来源于美国典型物保藏中心,保藏号:ATCC No.13939;蛋白胨、酵母提取物、琼脂粉,杭州百思生物技术有限公司;D-无水葡萄糖,上海麦克林生化科技有限公司;乙酸乙酯(分析纯),杭州高晶精细化工有限公司;β-胡萝卜素标准品,上海源叶生物科技有限公司。
TGY 琼脂培养基(tryptone glucose yeast agar medium):蛋白胨1.0 g,葡萄糖0.2 g,酵母提取物0.6 g,蒸馏水200 mL,固体培养基加4.0 g 琼脂粉,121℃、103 kPa 高温高压灭菌20 min,备用。
磷酸盐缓冲液(phosphate buffer saline,PBS):氯化钠8.0 g,氯化钾0.2 g,磷酸氢二钠1.44 g,磷酸二氢钾0.24 g,蒸馏水1 000 mL,pH 值调至7.2,121℃、103 kPa 高温高压灭菌20 min,备用。
1.2 仪器与设备
T6 新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;ZGP-A2270 全自动新型隔水恒温培养箱,上海智城分析仪器制造有限公司;HZ-9211KB恒温振荡器,太仓市华利达实验设备有限公司。
PEF 灭菌设备,PEF 装置由杭州电子科技大学开发[24]。该电场系统输出电压U 为1 ~100 kV,输出脉宽r 为1~10 μs,输出脉冲频率f 为1~100 Hz,两电极间距d 为1~20 cm,输出波形为方波,样品处理容量为1 mL。
1.3 试验方法
1.3.1 β-胡萝卜素标准曲线绘制 精准配制浓度分别为1.5、3.0、4.5、6.0、7.5 μg·mL-1的β-胡萝卜素标准溶液,在棕色容量瓶内用乙酸乙酯定容至10 mL。在448 nm 波长处测定其吸光值,绘制标准曲线。
1.3.2 耐辐射奇球菌培养 将实验室冻存的耐辐射奇球菌菌种划线接种于TGY 琼脂培养基,于30℃培养72 h,得单菌落。
1.3.3 耐辐射奇球菌生长曲线绘制 将耐辐射奇球菌单菌落接种于TGY 液体培养基中,在30℃条件下振荡培养。空白对照组在同样条件下振荡培养,每隔2 h 在600 nm 波长处测定培养基吸光值,绘制生长曲线。
1.3.4 培养过程耐辐射奇球菌体内类胡萝卜素浓度曲线绘制 将耐辐射奇球菌单菌落接种于TGY 液体培养基中,在30℃条件下振荡培养,分别振荡10、15、20 和25 h,取出,4 000 r·min-1离心3 min,收集菌体沉淀,再用PBS 冲液清洗1 次,相同条件离心,收集沉淀。于菌体中加入4 mL 乙酸乙酯,遮光条件下浸提9 h,在448 nm 波长处测定浸提液吸光值,绘制浓度曲线。
1.3.5 耐辐射奇球菌生物量测定 将恒温振荡20 h的培养基取出,4 000 r·min-1离心3 min,收集菌体沉淀,用PBS 清洗1 次,相同条件离心,收集沉淀。再将菌体置于烘箱中60℃烘干至恒重,即为耐辐射奇球菌生物量。
1.3.6 单因素对类胡萝卜素提取影响 按照处理时间30 s、频率100 Hz、脉宽10 μs,选择不同的电场强度(10、15、20、25、30 kV·cm-1)进行试验,以最终类胡萝卜素提取量评价提取的效果,每组重复3 次,研究电场强度对类胡萝卜素提取的影响。
按照电场强度30 kV·cm-1、频率100 Hz、脉宽10 μs,选择不同的处理时间(10、15、20、25、30 s)进行试验,以最终类胡萝卜素提取量评价提取的效果,每组重复3 次,研究处理时间对类胡萝卜素提取的影响。
按照电场强度30 kV·cm-1、处理时间30 s、频率100 Hz,选择不同的脉宽(3、4.5、6、8、10 μs)进行试验,以最终类胡萝卜素提取量评价提取的效果,每组重复3 次,研究脉宽对类胡萝卜素提取的影响。
按照电场强度30 kV·cm-1、处理时间30 s、脉宽10 μs,选择不同的频率(30、45、60、80、100 Hz)进行试验,以最终类胡萝卜素提取量评价提取的效果,每组重复3 次,研究频率对类胡萝卜素提取的影响。
1.3.7 提取工艺优化试验 通过正交试验参数组合,每个因素选取3 个水平,试验重复3 次,取平均值,试验设计方案如表1 所示。通过正交试验,衡量各因素对提取量的影响程度,探索最优提取参数。

表1 正交试验设计方案Table 1 Orthogonal experimental design
1.3.8 类胡萝卜素提取及提取量计算 将PEF 处理后的菌液,5 000 r·min-1离心5 min,收集菌体沉淀,再用PBS 清洗1 次,相同条件离心,收集菌体沉淀。向菌体中加入4 mL 乙酸乙酯,在遮光条件下浸提,每隔3 h 在448 nm 波长处测定浸提液吸光值,每次检测后,向菌体中加入4 mL 乙酸乙酯,继续避光渍提,共检测3 次。将3 次检测后计算所得的类胡萝卜素质量相加,即为提取的类胡萝卜素总质量。
利用β-胡萝卜素标准曲线计算出提取溶液中类胡萝卜素的浓度,再根据提取溶液体积、每次试验时所需菌体质量以及稀释倍数,计算类胡萝卜素的提取量:
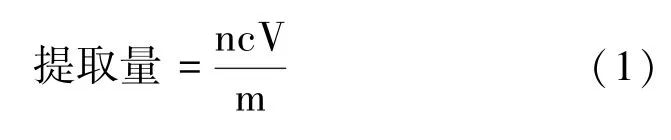
式中,n:浸提液稀释倍率;c:浸提液中类胡萝卜素的浓度,μg·mL-1;V:浸提液体积,mL;m:每次试验所用菌体质量,g。
1.4 数据分析
采用Origin 9.0 进行统计分析并制图。
2 结果与分析
2.1 β-胡萝卜素标准曲线
由图1 可知,β-胡萝卜素标准曲线的线性度较好,回归方程为:y=0.226 9x-0.012 1(R2=0.998 4)。
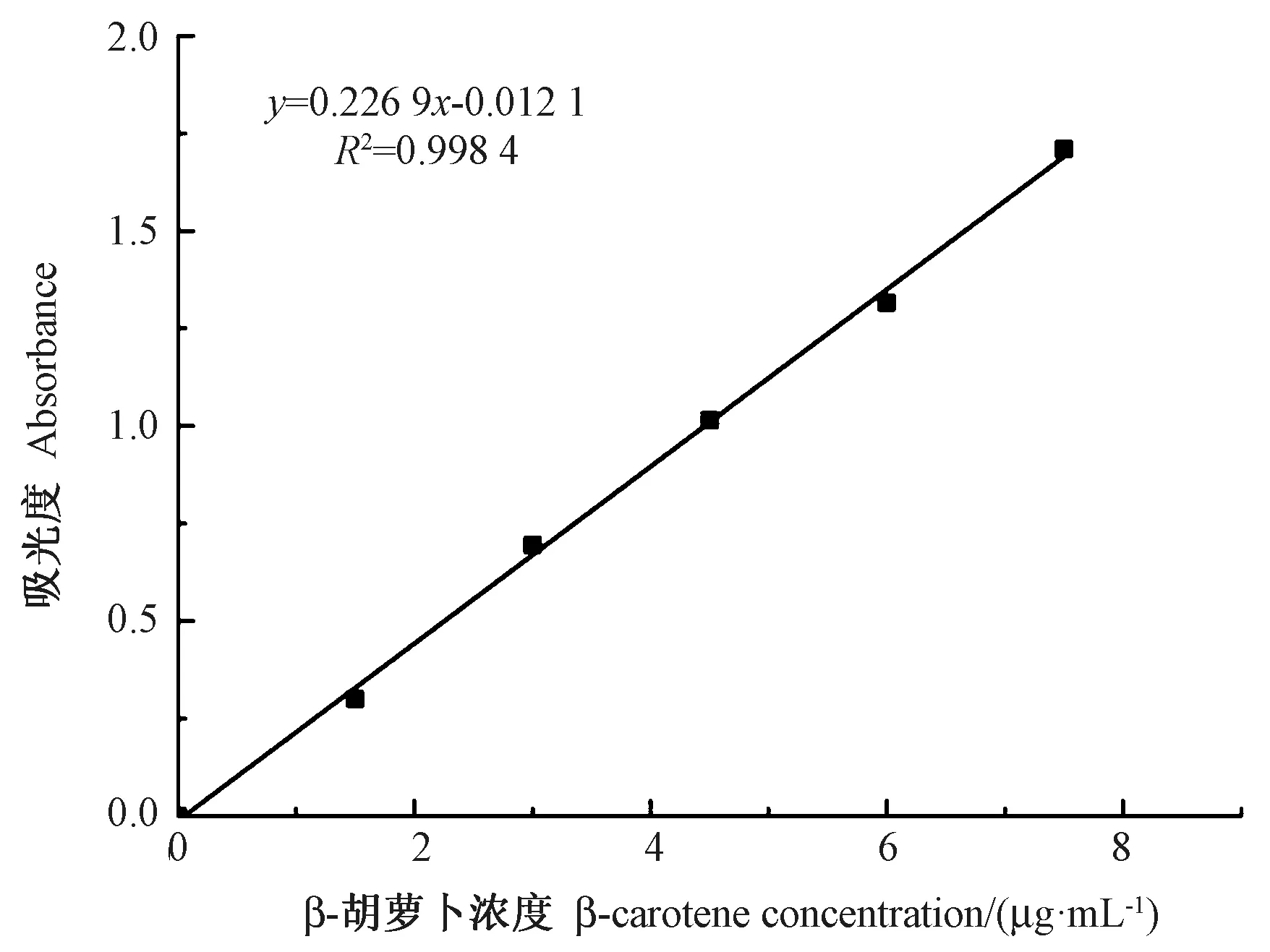
图1 β-胡萝卜素标准曲线Fig.1 β-carotene standard curve
2.2 耐辐射奇球菌生长曲线
由图2 可知,耐辐射奇球菌的生长期大致可分为3 个阶段,分别为迟缓期(0~10 h)、对数期(10 ~18 h)和稳定期(18 ~30 h)。在迟缓期耐辐射奇球菌生长平缓,而在对数期耐辐射奇球菌数量呈指数增长,到稳定期后,耐辐射奇球菌数量又趋于相对平稳。

图2 耐辐射奇球菌生长曲线Fig.2 Deinococcus radiodurans growth curve
2.3 培养过程耐辐射奇球菌体内类胡萝卜素浓度曲线
由图3 可知,耐辐射奇球菌扩增培养过程中,菌体内类胡萝卜素浓度均有所差异,扩增至20 h 时,菌体内类胡萝卜素浓度相对最高。杨桥等[25]在探究耐辐射奇球菌中产生类胡萝卜素的基因及该基因在抗辐射机理中的生理效应时,发现随着耐辐射奇球菌生长时间的延长,菌体中不断积累类胡萝卜素,且在稳定期类胡萝卜素的聚积量达到最大,其菌抗辐射能力也最强。耐辐射奇球菌在稳定期早期时,菌体内类胡萝卜素含量相对最高。因此后续试验选取扩增培养20 h 的耐辐射奇球菌进行PEF 处理。
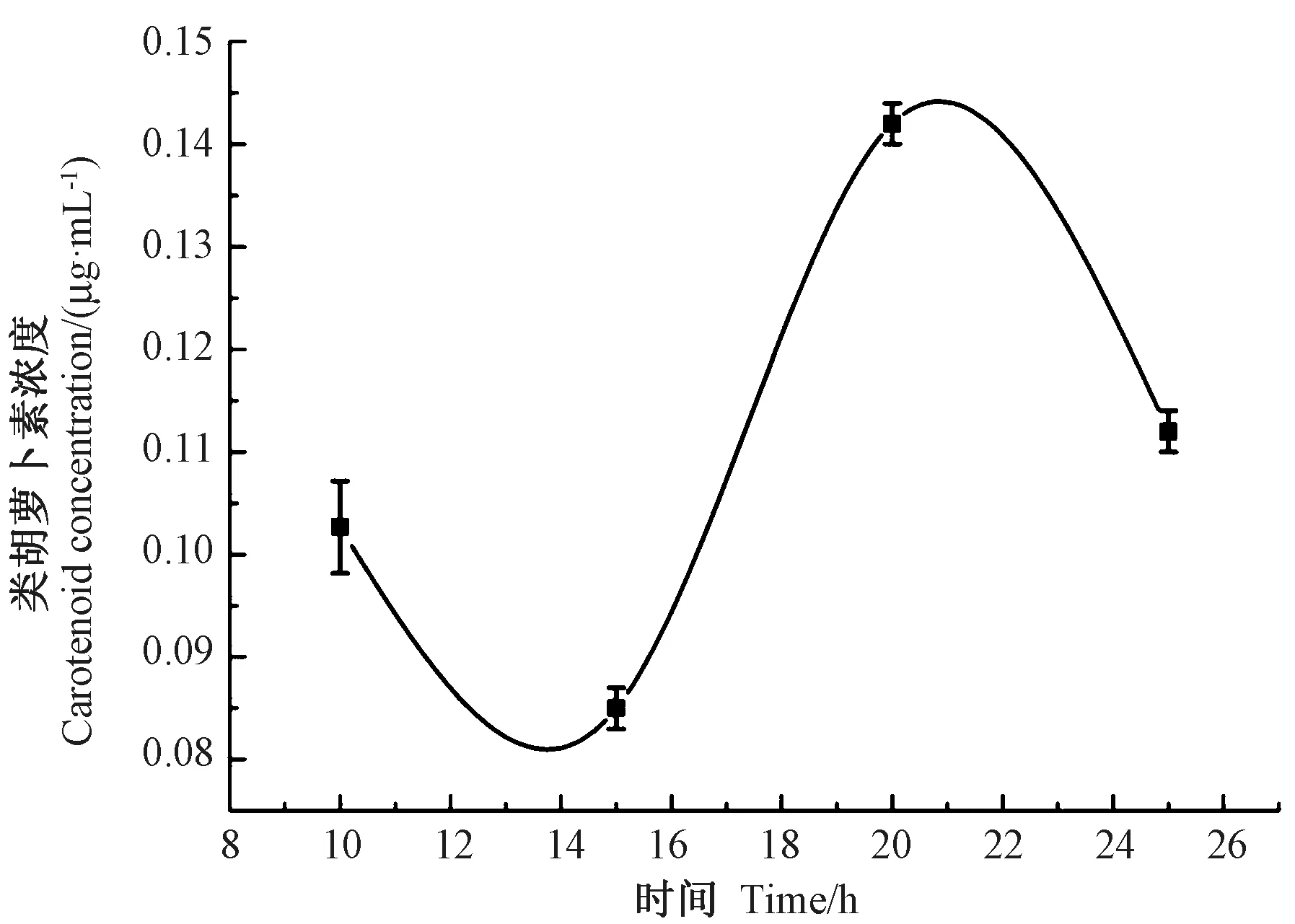
图3 培养过程耐辐射奇球菌体内类胡萝卜素浓度曲线Fig.3 Concentration curve of carotenoid in culturing Deinococcus radiodurans
2.4 单因素电学参数对类胡萝卜素提取量的影响
2.4.1 电场强度对提取量的影响 由图4 可知,随着电场强度的增加,类胡萝卜素的提取量呈先上升后下降的趋势,其中电场强度为10 ~25 kV·cm-1的上升趋势明显,25 kV·cm-1时提取量相对最大,到30 kV·cm-1时略有下降,故电场强度以25~30 kV·cm-1为宜。

图4 电场强度对类胡萝卜素提取量的影响Fig.4 Effect of electric field strength on the extraction yield of carotenoid
2.4.2 处理时间对提取量的影响 由图5 可知,在10~30 s 之间,类胡萝卜素的提取量呈上升趋势,30 s后随着处理时间的延长,提取量逐渐减小,因此处理时间应选择在30 s 左右。

图5 处理时间对类胡萝卜素提取量的影响Fig.5 Effect of processing time on the extraction yield of carotenoid
2.4.3 脉冲频率对提取量的影响 由图6 可知,随着高压脉冲频率的增加,类胡萝卜素的提取量呈逐步下降的趋势,因此脉冲频率可控制在30 Hz 左右。
2.4.4 脉冲宽度对提取量的影响 由图7 可知,随着脉宽的增加,类胡萝卜素的提取量呈先上升后下降再上升的趋势,其中脉宽为3~6 μs 时类胡萝卜素提取量为上升趋势,6~8 μs 时提取量逐渐下降,8~10 μs 时提取量又呈上升趋势,且6 μs 和10 μs 的提取量基本相同,10 μs 的提取量略高于6 μs,故脉宽选取10 μs 为宜。

图6 脉冲频率对类胡萝卜素提取量的影响Fig.6 Effect of pulse frequency on the extraction yield of carotenoid
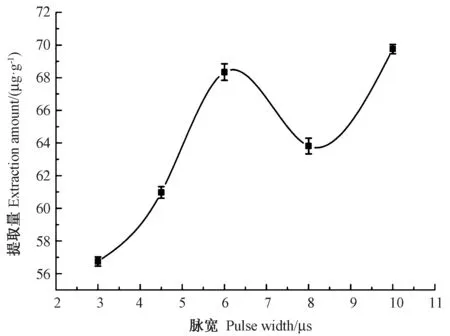
图7 脉冲宽度对类胡萝卜素提取量的影响Fig.7 Effect of pulse width on the extraction yield of carotenoid
2.5 PEF 提取工艺的优化
为探究各电场参数对耐辐射奇球菌破壁并从中得到类胡萝卜素的影响程度。利用正交试验的方法,分别对电场强度、处理时间、频率及脉宽等4 因素各取3水平,选择正交试验表L9(34)进行试验。
由图8 可知,第6 组条件下类胡萝卜素提取量最高,为68.50 μg·g-1。如表2 所示,在正交试验第六组参数条件下,可使提取量提升41.9%。9 组试验的平均提取量为61.28 μg·g-1。空白组提取量为48.27 μg·g-1。在电场强度为10~30 kV·cm-1,处理时间为10~30 s,频率为30~100 Hz,脉宽为3~10 μs 的范围内,经高压脉冲电场处理后类胡萝卜素的平均提取量较空白组增加了26.9%。
正交试验分析结果显示(表2),影响类胡萝卜素提取量的电场参数依次为:电场强度>时间>脉宽>频率,最优水平组合是:电场强度30 kV·cm-1,处理时间30 s,频率30 Hz,脉宽10 μs,此条件下类胡萝卜素提取量达75.06 μg·g-1,与空白组相比,提取量增加了55.5%。
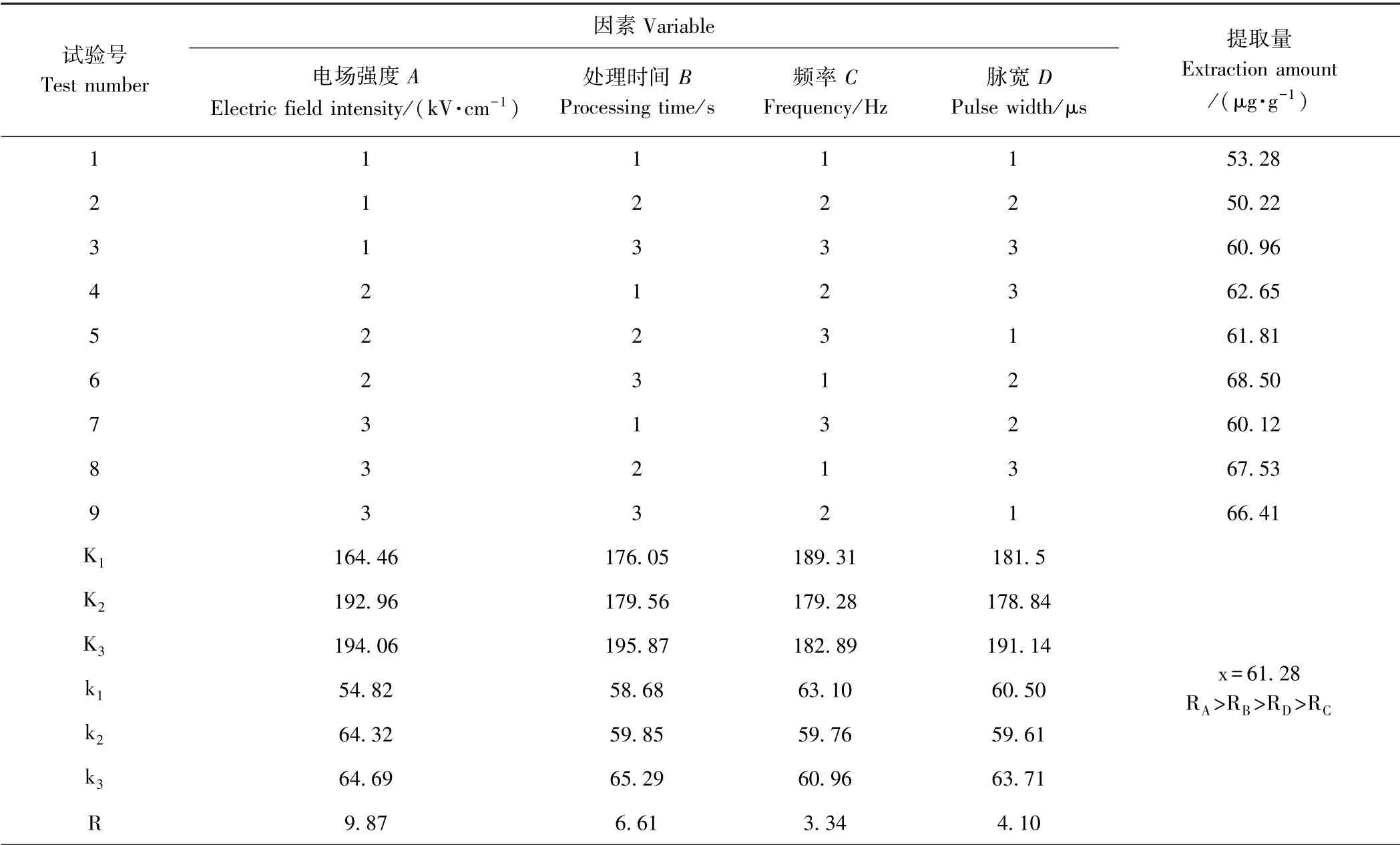
表2 正交试验结果及相关性分析Table 2 The orthogonal results and the analysis of variance
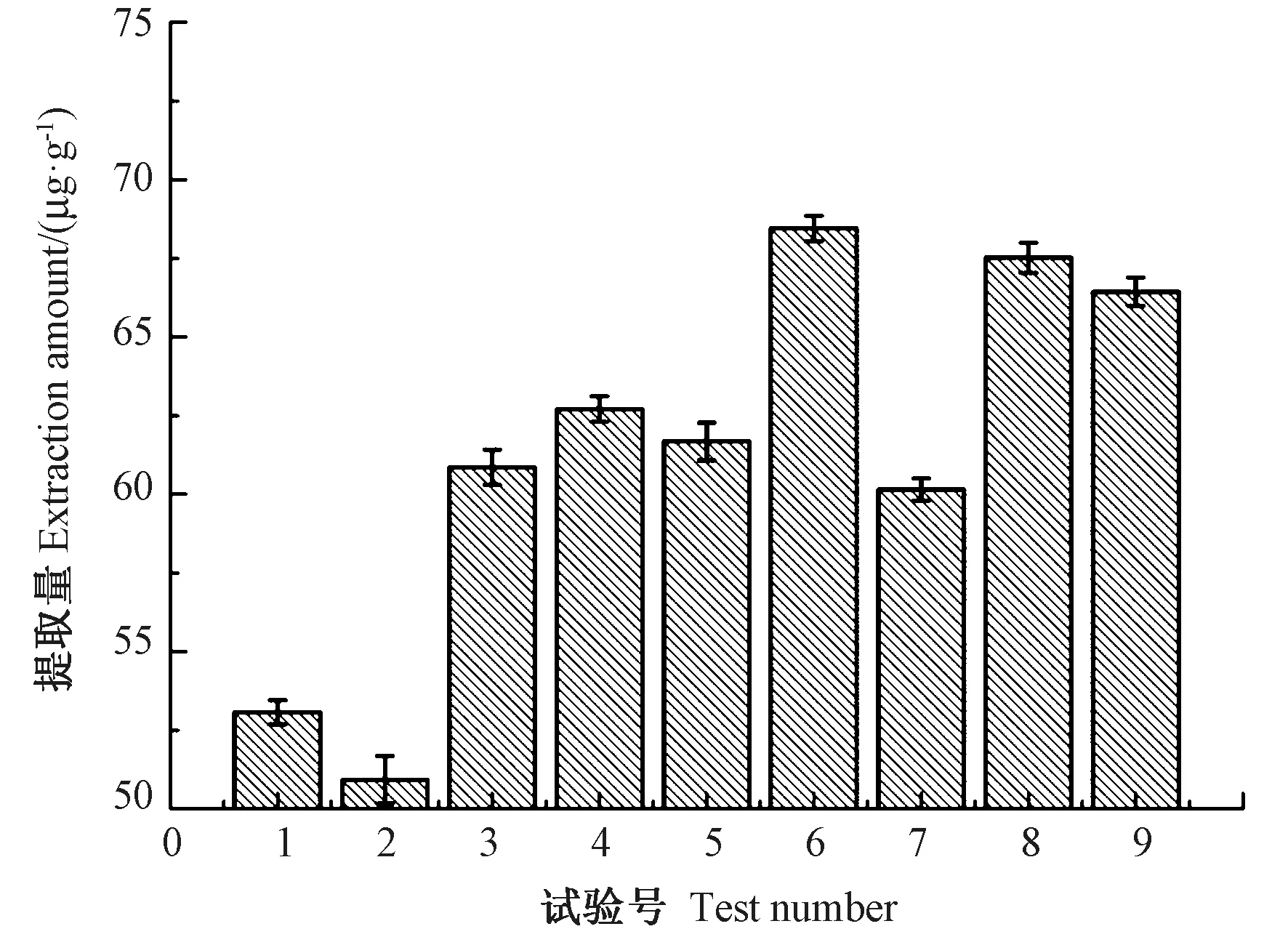
图8 不同组合下类胡萝卜素提取量Fig.8 Extraction rate of carotenoid under different combinations
3 讨论
本研究结果表明,利用PEF 技术提取耐辐射奇球菌体内的类胡萝卜素,可提高提取量,电场强度是影响其提取效果的最主要因素,这与方婷等[26]利用PEF提取茶汤中茶多酚的研究结果相类似。
本研究通过PEF 技术,明显提高了类胡萝卜素的提取量,但其提取机制尚未明确。有关高压脉冲电场对物料进行加工的机制有多种假说[27],如电穿孔理论[28]、电崩解理论[29],其中最为广泛认可的是电穿孔理论。同时也有研究表明,类胡萝卜素在胞体内与蛋白质结合[30],这种结合方式有利于类胡萝卜素的稳定,但目前关于类胡萝卜素与蛋白质如何结合尚未明确[31]。PEF可提高类胡萝卜素的提取量,有可能是脉冲电场处理导致细菌细胞壁和细胞膜破裂,促使细胞内容物流出,更多的类胡萝卜素溶解于浸提液中;也有可能是经过电场处理后蛋白质结构发生改变,导致类胡萝卜素与结合蛋白分离,类胡萝卜素更易溶解于提取剂中;还有可能是电场处理导致菌体细胞穿孔,同时改变色素结合蛋白结构,从而提高了类胡萝卜素的提取量。目前,尚不确定有关提取机制,还需更深入的探究。
本研究发现当电场处理时间为10 ~30 s 时,提取量随处理时间延长呈现明显的上升趋势,但提取时间大于30 s 时,提取量反而下降,这可能是由于菌体经PEF 处理时间过长而分解所致。通过PEF 处理提取类胡萝卜素提取量最高为75.06 μg·g-1,而空白组提取量为48.27 μg·g-1,提高了55.5%。目前,超声波[32]、酸热[33]等提取方法的提取量高于本研究,这可能是由于该技术在相关物质提取领域还处于初步探索阶段,有关参数的优化设计还不够完善,还需进一步探究。然而该提取技术具有处理时间短、能耗低、对提取物质破坏小等优点,具有广阔的应用前景。
本研究证实利用PEF 技术提取菌体内的类胡萝卜素切实可行,但今后还需探究更多试验条件,如提取剂、液料比、提取时间等因素对提取效果的影响。并进一步提高发酵产量,为今后的工业化、大规模应用奠定基础。
4 结论
本研究利用PEF 技术,从耐辐射奇球菌体内提取类胡萝卜素。采用单因素和正交试验,探究各电场参数对提取效果的影响程度。结果表明,PEF 可用于提取微生物体内的类胡萝卜素,且4 种电场参数对类胡萝卜素提取的影响程度由大到小依次为:电场强度、处理时间、脉冲宽度和脉冲频率。最优的提取参数组合为:电场强度30 kV·cm-1,处理时间30 s,脉冲频率30 Hz,脉冲宽度10 μs。本研究结果为探究PEF 技术提取类胡萝卜素提供了一定的理论参考,有利于推动PEF 技术的工业化应用。

