小麦TaAGPL1基因上游转录因子TabHLH39的分离及其功能研究
董洁, 李鸽子, 韩巧霞, 谢迎新, 王永华, 冯伟,马冬云, 王晨阳, 郭天财, 康国章
(河南农业大学农学院, 国家小麦工程技术研究中心, 郑州 450046)
淀粉是小麦籽粒的主要成分,约占小麦种子干重的70%[1],它的生物合成是一个复杂过程,由六大类功能酶直接催化:AGP-葡萄糖焦磷酸化酶 (ADP-glucose pyrophosphorylase, AGPase)、颗粒结合淀粉合成酶 (granule-bound starch synthase, GBSS)、可溶性淀粉合成酶 (soluble starch synthase, SS)、淀粉分支酶 (starch branching enzyme, BE)、淀粉去分支酶 (starch debranching enzyme, DBE) 和淀粉磷酸化酶 (phosphorylase, PHO)[2-3]。AGPase是淀粉生物合成过程的关键酶,它催化葡萄糖-1-磷酸 (G-1-P) 转化为二磷酸腺苷 (ADP-Glc)[4]。直链淀粉的合成由 AGPase 和 GBSS 参与作用,而支链淀粉的合成则由 AGPase、SS、BE 和 DBE 协同作用[3,5]。PHO作用于淀粉颗粒表面,在磷酸化过程中发挥重要作用[3]。淀粉生物合成的复杂途径包括上游的调控因子(激酶、转录因子等)及下游的上述功能基因等。关于淀粉合成相关功能基因 (酶) 的功能已有较多研究,然而,有关调控这些淀粉合成基因表达的上游调控因子较少报道,而分离这些调控因子有利于揭示淀粉合成的分子机制。
AGPase是由两个小亚基 (small subunit, AGPS) 和两个大亚基 (large subunit, AGPL) 构成的异源四聚体。AGPS 是 AGPase 催化活性的中心,AGPL 在 AGPase 酶活性中起调节作用,能提高 AGPase 酶与激活因子 (3-PGA) 的结合能力。植物 AGPase 主要存在于细胞质 (cytosol) 和质体 (plastid) (包括淀粉粒、叶绿体等) 两类亚细胞器内,因此,分别称之为胞质型 AGPase (cytosolic AGPase) 和质体型 AGPase (plastidial AGPase)[6-7]。在植物细胞内 AGPase 存在4种类型亚基:即胞质型小亚基 (AGPS1)、质体型小亚基 (AGPS2)、胞质型大亚基 (AGPL1) 和质体型大亚基 (AGPL2)[8-9]。在前期研究中,小麦 AGPase 胞质型大亚基的TaAGPL1-1D基因 (拷贝) 与 AGPase 活性和籽粒淀粉积累速率呈正相关[10],且该基因的过表达能显著提高 AGPase 活性和粒重[11]。这些结果表明,TaAGPL1-1D基因在小麦淀粉合成中的重要作用。
转录因子 (transcription factors, TFs) 是一类能够与基因启动子顺式作用元件专一性结合的蛋白,从而正向或负向调控基因的表达。它们能够参与调控植物的淀粉合成、信号转导以及逆境反应等[12-13]。然而,关于调控TaAGPL1-1D基因表达的上游转录因子尚未见报道。因此,本研究利用酵母单杂交技术筛选调控该基因表达的转录因子,进而采用大麦条纹花叶病毒诱导的基因沉默 (barley stripe mosaic virus-virus induced gene-silencing, BSMV-VIGS) 方法对其进行功能研究,以探讨小麦淀粉合成的分子调控机制。
1 材料与方法
1.1 试验材料、试剂及仪器
1.1.1供试材料 百农207为河南省大面积推广的小麦品种,由河南科技学院欧行奇教授馈赠,周麦18为河南省小麦区域试验对照品种,由周口市农业科学院提供,且经过本课题组每年提纯复壮。在小麦生长发育期间 (2016年10月15日至2017年5月31日),两种材料均种植于河南省郑州市河南农业大学科教示范园区,按高产麦田进行管理。选取周麦18花后不同时间点(5、10、15、20、25、30 和35 d) 的小麦籽粒用于cDNA文库的构建。前期研究表明,百农207品种适用于田间 BSMV-VIGS试验[14],选取接种后不同时间点 (14、19、24、29和34 d)的麦穗,立即放于液氮中快速冷冻, -80 ℃ 冰箱内长期保存。
1.1.2试剂与载体 金担子素A (aureobasidin, AbA)、酵母单杂交试剂盒 (Matchmaker®gold yeast one-hybrid library screening system)、高保真酶 (Tks GflexTMDNA Polymerase)、限制性内切酶、E.coliDH5α 感受态细胞均购自TaKaRa生物技术有限公司。高保真酶 (KOD FX Neo)、荧光定量cDNA合成试剂盒 (ReverTra Ace qPCR RT Kit)、荧光定量酶 (KOD SYBR®qPCR Mix) 均购自TOYORO有限公司。高保真聚合酶 (Phanta max super-fidelity DNA polymerase)、重组克隆试剂盒 (Phanta max super-fidelity DNA polymerase) 等均购自Vazyme生物技术有限公司。体外转录试剂盒 (RiboMAXTMLarge Scale RNA Production Systems) 购自Promega生物技术有限公司。基因沉默病毒载体BSMV-α、BSMV-β、BSMV-γ由河南农业大学王道文研究员馈赠。引物由上海尚亚生物技术有限公司合成。
1.1.3主要仪器 全自动数码凝胶图像分析系统 (3500R, Tanon Co., Ltd.)、实时荧光定量PCR仪 (QuantStudioTM5 Real-Time PCR System, Thermo fisher scientific Co., Ltd.)、智能生化培养箱(SPX-80, 宁波江南仪器厂)、全触控屏梯度PCR仪 (A200, Scientific instruments Co., Ltd.)。
1.2 TaAGPL1-1D启动子克隆
使用 CTAB 法[15]提取小麦花后20 d籽粒DNA, 根据小麦基因组数据库(https://urgi.versailles.inra.fr/blast/) 搜索获得了TaAGPL1-1D(GenBank: Z21969)基因启动子序列, 以此序列设计引物TaAGPL1-1D F/R(表1),以小麦籽粒DNA为模板,采用Tks Gflex高保真酶进行PCR扩增,反应体系:2×Gflex PCR buffer (Mg2+, dNTP plus) 25 μL, Tks Gflex DNA Polymerase 1 μL, 正反引物 (10 μmol·L-1) 各1.5 μL, DNA模板 (150 ng·μL-1) 4 μL, ddH2O 17 μL。PCR程序:94 ℃ 预变性1 min; 98 ℃ 变性10 s, 52~60 ℃ 退火15 s, 68 ℃ 延伸2 min, 32个循环; 68 ℃ 延伸3 min。将其回收产物送至上海尚亚生物技术有限公司进行测序。运用 PlantCARE 软件预测TaAGPL1-1D启动子序列的顺式作用元件,根据其顺式作用元件的种类和数目,将TaAGPL1-1D启动子分为3个片段 (ProL1-1,1 280 bp;ProL1-2,881 bp;ProL1-3,494 bp)。
1.3 酵母单杂交技术筛选转录因子
取周麦18品种花后不同天数 (5、10、15、20、25、30 和35 d) 的小麦籽粒用于cDNA文库的构建,由上海欧易生物医学科技有限公司完成。将TaAGPL1-1D基因启动子的3个片段整合到酵母诱饵载体 pAbAi中,并将这些重组载体质粒 (pAbAi-ProL1-1、pAbAi-ProL1-2和pAbAi-ProL1-3) 用BstB I内切酶线性化,将其转化到Y1H Gold酵母菌株中,均匀涂抹于 SD/-Ura 固体培养基[16]。而后将小麦籽粒cDNA文库的质粒转化到含有Y1HGold/TaAGPL1-1D-pro-pAbAi诱饵酵母菌株中,菌液涂布于金担子素A 浓度分别为100、200、300 ng·mL-1的SD/-Leu/-Ura固体培养基,置于30 ℃下培养3 d[17]。使用高保真聚合酶 (Phanta max super-fidelity DNA polymerase)对酵母转化菌落进行PCR鉴定,体系为:Phanta max super-fidelity DNA polymerase 1 μL, 2×Phanta max buffer 25 μL, dNTP mix (10 mmol·L-1) 1 μL, 模板2 μL, 正反引物各2 μL,加ddH2O至50 μL。程序为:95 ℃ 3 min; 95 ℃ 15 s,55 ℃ 15 s,72 ℃ 2 min,30个循环; 72 ℃ 10 min。选取检测正确的PCR产物送至上海尚亚生物技术有限公司进行测序,测序所用引物(T7-F/3AD-R1)如表1所示。

表1 本研究所用的引物Table 1 Primers used in this study
1.4 pGADT7-TabHLH39 载体构建及酵母转化
运用国际小麦基因组测序联盟 (International wheat genome sequencing consortium, IWGSC) 数据库对TabHLH39基因进行分析,运用 MEMEv5.0.3软件根据TabHLH39 氨基酸序列进行结构域分析。根据TabHLH39(GenBank: KX085422.1)编码区序列设计引物,将pGADT7载体在NdeⅠ/XhoⅠ酶切位点进行线性化,并在插入片段(TabHLH39)引物5’端加上NdeⅠ/XhoⅠ酶切位点和与pGADT7线性化载体末端序列相一致的9 bp碱基,pGADT7-TabHLH39 F/R 引物序列如表1所示。运用重组克隆试剂盒将两者进行连接,体系如下:5×CE Ⅱ Buffer 4 μL, Exnase Ⅱ 2 μL, TabHLH39 回收产物 (225.5 ng·μL-1) 1.5 μL, pGADT7 线性化载体 (63.8 ng·μL-1) 0.8 μL, 加ddH2O至10 μL。配好的体系置于37 ℃反应30 min后,转化DH5α 感受态细胞。将成功构建的载体质粒pGADT7-TabHLH39转入包含 pAbAi-TaAGPL1-1D 3个启动子片段的酵母菌株中,并均匀涂布于SD/-Leu/-Ura固体培养基上,30 ℃培养3 d。之后挑取单菌落用上述高保真聚合酶进行PCR检测,选取阳性菌落在 SD/-Leu/-Ura 液体培养基里扩摇,测OD值为0.2,并将其按10倍稀释成4个不同的浓度梯度,吸取5 μL菌液点至含有金担子素A浓度分别为100、200、300 ng·mL-1的 SD/-Leu/-Ura 固体培养基上,30 ℃培养3 d,观察生长情况。
1.5 BSMV-VIGS 病毒沉默载体构建及田间接种
本研究选取TabHLH39基因 5A、5B和5D三拷贝同源性高达99.5%的序列 (189 bp),运用重组克隆试剂盒构建 BSMV-VIGS-TabHLH39 重组载体[18],引物序列BSMV-VIGS-TabHLH39 F/R如表1所示,以BSMV-VIGS-GFP作为对照。
将体外转录成功后的 RNA-α、RNA-β 和RNA-γ-TabHLH39/RNA-γ-GFP载体以1∶1∶1的比例混合,并用等体积的DEPC处理水稀释[19]。将18倍体积的FES缓冲液与转录混合物充分摇匀后用于田间病毒接种[14]。接种后36 d收获 BSMV-VIGS-GFP和BSMV-VIGS-TabHLH39 成熟籽粒,测定其长度、宽度、千粒重和淀粉含量。
1.6 沉默小麦植株籽粒内TabHLH39和TaAGPL1基因表达量的测定
提取接种后不同时间点 (14、19、24和34 d) 的小麦籽粒 RNA,并运用 ReverTra Ace qPCR RT 试剂盒进行反转录。采用 qPCR 方法测定沉默小麦植株籽粒内TabHLH39和TaAGPL1基因的表达量,以小麦肌动蛋白基因 (Actin) 和甘油醛-3-磷酸脱氢酶 (GAPDH) 为内参基因。使用 KOD SYBR®qPCR Mix 试剂配置qPCR体系,每管20 μL反应液,引物如表1所示,每个样品3次生物学重复。利用相对定量分析法 (2-ΔΔCT法) 计算基因表达量[20]。
1.7 数据处理
数据进行统计学分析,所有试验至少重复3次,采用SPSS 19 统计软件 (P<0.05) 进行方差分析,用Origin 8.0软件制图。
2 结果与分析
2.1 TabHLH39转录因子与TaAGPL1-1D启动子的互作
本研究将TaAGPL1-1D启动子 (1 280 bp) 与小麦籽粒 cDNA文库进行酵母单杂交,获得一个属于碱性/螺旋-环-螺旋家族蛋白的转录因子 TabHLH39。为了验证该转录因子与TaAGPL1-1D启动子之间的互作,将重组载体 pGADT7-TabHLH39 质粒分别转入含有 pAbAi-TaAGPL1-1D (ProL1-1、ProL1-2和ProL1-3) 的酵母菌株内,结果显示,在AbA0条件下,含有3个启动子片段的 SD/-Leu/-Ura 平板均长出菌落,且生长状况一致。而在+AbA100,200,300条件下,含有Y1HGold/ProL1-1 (-1 269 bp至+11 bp) 的转化酵母细胞生长状态最好,其次是Y1HGold/ProL1-2 (-870 bp至+11 bp),次之为Y1HGold/Pro-3 (-483 bp至+11 bp)(图1)。根据植物转录因子数据库 (http://planttfdb.cbi.pku.edu.cn/) 搜索得知 bHLH 家族蛋白与启动子结合元件是 E-box (核心序列:CANNTG), 运用 PlantCARE 软件预测得知 TaAGPL1-1D 启动子3片段分别包含 18、14和11个E-box 顺式作用元件,表明TabHLH39转录因子与TaAGPL1-1D启动子之间存在互作,且结合能力可能与E-box顺式作用元件的数目密切相关。
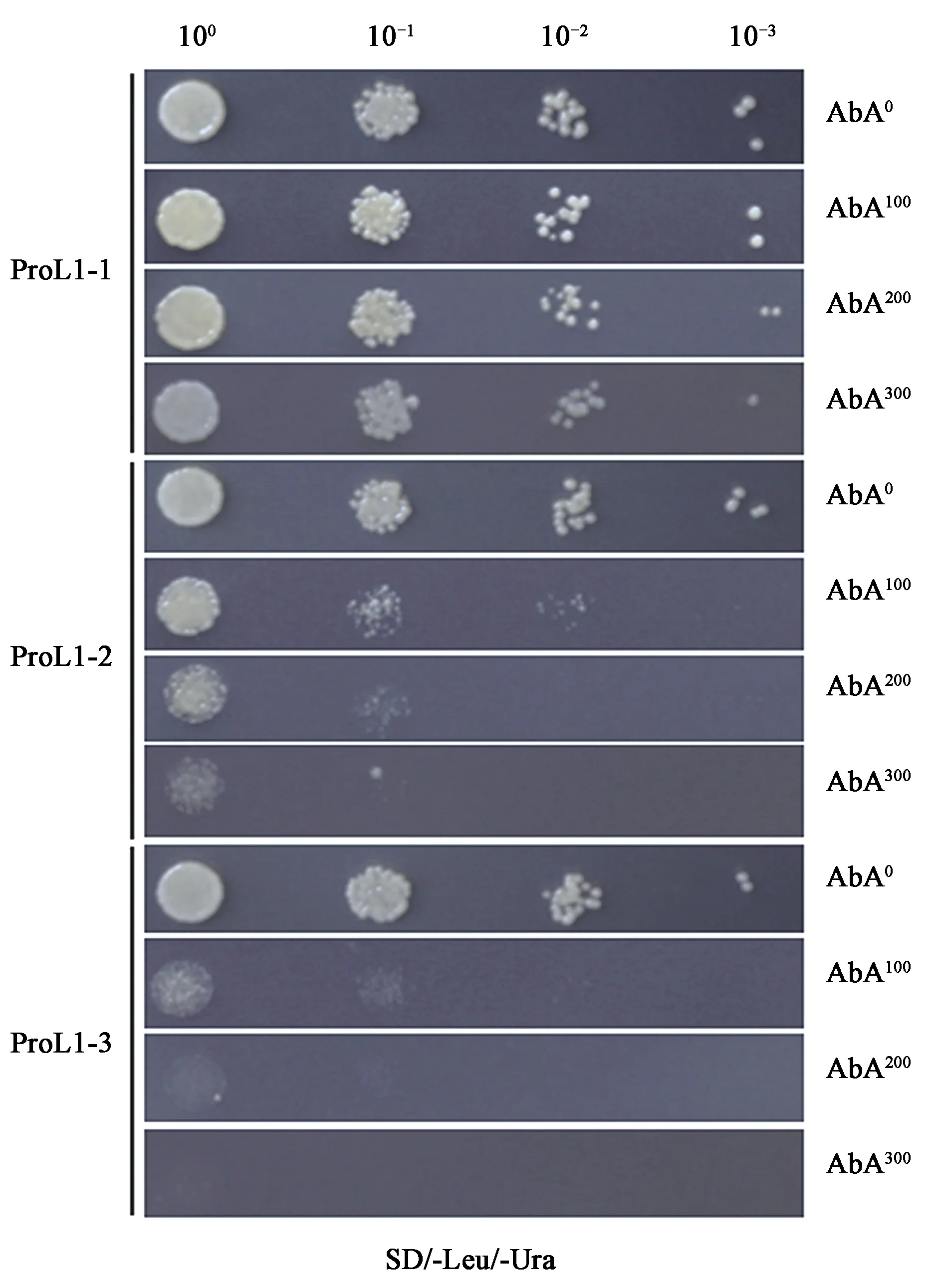
图1 TabHLH39转录因子和TaAGPL1-1D启动子之间的酵母单杂交Fig.1 Y1H assay between TabHLH39 protein and the TaAGPL1-1D promoter
2.2 转录因子TabHLH39的结构域与系统进化树分析
分析发现,分离出的TabHLH39 基因定位于 5 D 染色体,其 CDS 含有 1 461 bp,编码 486 个氨基酸。从图2可以看出, TabHLH39 转录因子含有四个典型的结构域,即一个碱性区域,一个环区域和两个螺旋区域,且每个区域均包含不定数量的保守残基;TabHLH39 与 OsbHLH102、OsbHLH107 和 AtbHLH015 的结构域序列高度保守(>90%),其中,OsbHLH102基因在水稻直链淀粉合成过程中发挥了重要作用[21],OsbHLH107基因的过表达能显著增加水稻籽粒粒径[22],因此,推测 TabHLH39 在小麦籽粒淀粉合成过程中可能也发挥了重要作用。
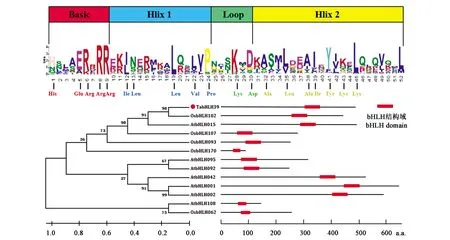
图2 TabHLH39 结构域与系统进化树分析Fig.2 Structural analysis and phylogenetic tree of the TabHLH39 protein
2.3 BSMV-VIGS-TabHLH39 沉默植株分析
选取 TabHLH39 三拷贝同源性高达 99.5% 的片段构建沉默载体,田间接种19 d后,沉默小麦植株穗部表现出明显的光漂白及黄褐色斑点症状,如图3所示。以接种后14、19、24、29和34 d的小麦籽粒RNA为模板进行 qPCR,结果(图3)显示,BSMV-VIGS-TabHLH39病毒植株籽粒中TabHLH39表达量均显著下降,表明成功获得了TabHLH39基因沉默小麦植株。
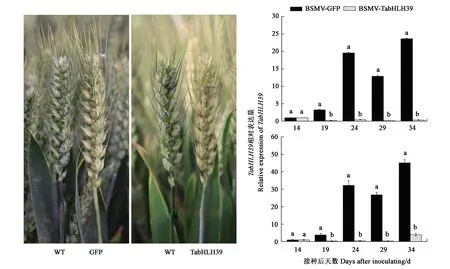
注:TaAGPL1-1D的相对表达量水平分别用Actin(上)和GAPDH(下)两基因作内参进行测定。Note: Relative expression levels of TaAGPL1-1D are measured by using Actin (up) and GAPDH (down) as control genes, respectively.图3 BSMV-VIGS-TabHLH39沉默植株表型和基因转录水平Fig.3 Phenotypes of BSMV-TabHLH39 silencing wheat plants and transcription levels of TabHLH39
2.4 TabHLH39沉默小麦植株籽粒淀粉的变化
从图4可以看出,与对照植株籽粒 (BSMV-VIGS-GFP) 相比,BSMV-VIGS-TabHLH39 植株籽粒表现出明显的皱缩,定量检测结果显示BSMV-VIGS-TabHLH39 籽粒的长度、宽度、千粒重和淀粉含量均显著低于对照,降幅分别达 10.1%、11.7%、3.7% 和 8.8%, 表明TabHLH39基因沉默导致了小麦籽粒淀粉生物合成的减少。沉默植株TaAGPL1基因的表达量分析结果表明,在接种后19、24、29和34 d的4个测定时期,BSMV-VIGS- TabHLH39 沉默小麦植株籽粒内TaAGPL1的表达量均显著下降(图4),这显示 TabHLH39 可能通过调控TaAGPL1-1D基因的表达,从而参与了小麦籽粒淀粉的合成。
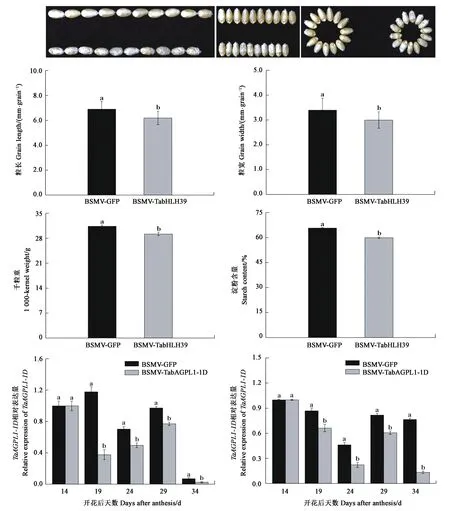
注:TaAGPL1-1D的相对表达量分别用Actin(左)和GAPDH(右)两基因作内参进行测定。Note: Relative expression levels of TaAGPL1-1D are measured by using Actin (left) and GAPDH (right) as control genes, respectively.图4 BSMV-VIGS-TabHLH39 接种小麦植株籽粒表型、相关参数及 TaAGPL1-1D基因的转录水平Fig.4 Grain phenotype, parameter and transcription level of the TaAGPL1-1D gene in BSMV-TabHLH39-inoculated wheat plants
3 讨论
近年来,作物分子生物学的研究领域已从直接控制性状的功能基因逐渐转到控制这些功能基因表达的上游调控因子(如转录因子等)方面,这是由于调控因子能控制下游一系列功能基因的表达,比单一功能基因改变作物性状的效果更佳[2]。在作物淀粉合成的调控机制方面,一些淀粉合成重要基因上游的转录因子相继被分离出来。如,调控玉米ZmAGPL2和ZmAGPS2基因表达的ZmaNAC36 转录因子、调控玉米ZmAGPS1和ZmSSIIIa表达的 ZmbZIP91 转录因子[23-24]。bHLH 蛋白是植物第二大类转录因子家族,参与作物生长、发育、逆境胁迫等诸多方面[25]。已有研究发现,OsbHLH93能负向调节穗粒数,它的突变显著增加了穗粒数,从而提高水稻产量[26];OsbHLH170基因的过表达能显著增加水稻籽粒长度和粒重,从而显著增加水稻产量[27]。本研究通过酵母单杂交技术筛选到调控小麦TaAGPL1-1D基因表达一个转录因子 TabHLH39(图1),通过 BSMV-VIGS 技术在田间对该转录因子的功能进行了验证,发现TabHLH39沉默植株小麦籽粒相关参数、籽粒淀粉含量与TaAGPL1-1D基因表达均显著下降 (图4),表明该转录因子为一个正向调控因子,通过调控TaAGPL1-1D基因的表达,从而影响了小麦籽粒淀粉的合成与粒重。
TabHLH39 在小麦植株对盐、冻、干旱等非生物逆境胁迫中也发挥了重要的功能[28],表明该转录因子在小麦中具有一因多效的功能,具有很高的应用价值。若在现今小麦品种中筛选出含该转录因子优异等位变异的种质资源,将其与主栽小麦品种进行常规杂交,可创制出淀粉含量显著提高、非生物逆境胁迫抗性显著增强的小麦新品种 (系)。另外,由于该转录因子为正向调控因子,通过无筛选标记将该转录因子在小麦植株内进行过表达等,也可创制出优异的小麦种质资源。

