贺兰山东麓葡萄灰霉病菌对不同类型杀菌剂抗药性水平的评价
姜彩鸽, 宋双, 李茜, 王国珍, 张怡*, 关晓燕
(1.宁夏农林科学院植物保护研究所, 银川 750002; 2.宁夏大学, 银川 750021;3.吴忠市红寺堡区自然资源局, 宁夏 吴忠 751999)
宁夏贺兰山东麓地区是我国最大的葡萄酒地理标志保护产区,随着葡萄种植面积不断扩大,单一生态环境的持续,有害生物的生态适应性也不断提高。葡萄灰霉病已成为贺兰山东麓葡萄产业重大病害之一,主要造成成熟期果实腐烂。据调查,不同年份造成不同葡萄品种的产量损失在20%~50%[1]。对于葡萄灰霉病害的防治,生产上仍以化学防治为主,且化学用药水平也在逐年提高[2-5]。我国灰霉病化学防治中常用杀菌剂品种为苯并咪唑类的多菌灵、二甲酰亚胺类的腐霉利和异菌脲、苯胺基嘧啶类的嘧霉胺以及 N-苯氨基甲酸酯类的乙霉威等。2013年,啶酰菌胺和啶菌噁唑在我国登记用于灰霉病的防治。而引致葡萄灰霉病的灰葡萄孢菌(Botrytiscinerea)具有寄主范围广、产孢量大、再侵染频繁、遗传变异大和适合度高的特性[6-7]。特别是在对该病的防治中单一化学杀菌剂的长期反复使用,极易产生抗性。国内外已有大量报道表明,灰霉病菌对这些药剂产生了不同程度的抗性[8-9]。因此,定期对灰霉病菌进行抗药性检测以及引入与现有杀菌剂没有交互抗性的新型杀菌剂是灰霉病综合治理中的必要措施。
本研究通过比较分析贺兰山东麓不同地区、不同葡萄品种上的灰霉病菌对目前生产上常用和新引入使用的8类杀菌剂(多菌灵、腐霉利、乙霉威、嘧霉胺、咯菌腈、啶酰菌胺、氟啶胺、啶菌噁唑)的抗药性,旨在根据其不同的抗药性水平而采取不同的用药策略,延缓病菌的抗药性发展,提高葡萄灰霉病的防治效果,降低农药残留,推动宁夏贺兰山东麓地区有机葡萄的可持续发展。
1 材料与方法
1.1 试验材料
1.1.1菌株采集地区和品种 葡萄灰霉病菌菌株采自贺兰山东麓三大葡萄主栽区及主栽品种,具体如下。
宁夏农垦:黄羊滩的红地球(Red Globe)和赤霞珠(Cabernet Sauvignon),玉泉营农场的霞多丽(Chardonnay);青铜峡市:先锋村的大青(Daqing),树新林场的乍娜(Zana),御马的赤霞珠(Cabernet Sauvignon)和霞多丽(Chardonnay);贺兰山沿山:园林场的红地球(Red Globe)、赤霞珠(Cabernet Sauvignon)和霞多丽(Chardonnay)。
菌株从常规施药的葡萄园中病果上分离获得,单孢纯化后转入试管内PDA斜面培养后,保存于4 ℃冰箱中待用。
1.1.2药剂及试剂 8类药剂各选一种田间常用的药剂以供研究:苯并咪唑类-97.09%多菌灵(carbendazim)、二甲酰亚胺类-98.1%腐霉利(procymidone)、N-苯基氨基甲酸酯类-95.4%乙霉威(diethofencarb)、苯胺基嘧啶类-98.2%嘧霉胺(pyrimethanil)、吡咯类-97.8%咯菌腈(fludioxonil)、酰胺类-84.39%啶酰菌胺(boscalid)、吡啶胺类-98.2%氟啶胺(fluazinam)和甾醇生物合成抑制剂-95%啶菌噁唑(SYP-Z048)原药,均由农业农村部农药检定所提供。除多菌灵用0.1 mol·L-1HCL溶液溶解外,其余均用丙酮溶解,配制成1.0×104μg·mL-1的母液,均加入0.2%乳化剂Tween-80,母液在4 ℃冰箱中贮藏备用。用时以无菌水稀释至适当的浓度,以药剂与培养基1∶9的比例制成含最终所需浓度药量的水琼脂平板(培养基冷却至45 ℃左右时,再加入药剂),用以进行抗药性水平测定。
1.1.3培养基 水琼脂平板培养基:每1 000 mL水中含有20 g琼脂。
1.1.4主要仪器 超净工作台SW-CJ-IBU(苏州安泰空气技术有限公司)、空气浴摇床HZQ-C(哈尔滨市东明医疗仪器厂)、智能光照培养箱RXZ型(宁波东南仪器有限公司)。
1.2 检测方法
采用孢子萌发测定法,参照潘金菊等[10]的方法进行。将用灭菌去离子水洗脱、过滤得到的孢子悬浮液,调至100倍显微镜下每视野30~40个孢子。分别加入8种供试药剂,制备质量浓度为20、50、100 μg·mL-1的含药水琼脂平板,取100 μL孢子悬浮液加在平板中央,用涂布棒将孢子悬浮液涂布均匀,置于21 ℃黑暗条件下培养12 h,在显微镜下观察分生孢子萌发。
1.3 数据处理
分生孢子萌发抑制率=[(对照分生孢子萌发率-药剂处理分生孢子萌发率)/对照分生孢子萌发率]×100%
按上述公式用Excel及DPS软件统计不同药剂浓度的分生孢子萌发抑制率,并进行系列药剂浓度的对数值(x)与孢子萌发抑制率的几率值(y)之间的线性回归分析,求出各药剂抑制灰霉病菌分生孢子萌发的毒力回归方程、相关系数及有效抑制中浓度(EC50)。
1.4 灰霉病菌抗药性水平判断标准
以灰霉菌株对各药剂的EC50来确定菌株抗药性水平。本研究葡萄灰霉病菌的抗药性水平判定采用表1[11-18]中的标准。其中,咯菌腈、啶酰菌胺、氟啶胺和啶菌噁唑抗药性水平的判定依据敏感基线值[15-18]进行判别。当菌株的EC50小于敏感基线的10倍时,为敏感菌株;当菌株的EC50处于敏感基线的10倍和50倍之间时,为低抗菌株;当菌株的EC50处于敏感基线50倍和100倍之间时,为中抗菌株;当某菌株的EC50大于敏感基线的100倍时,为高抗菌株。
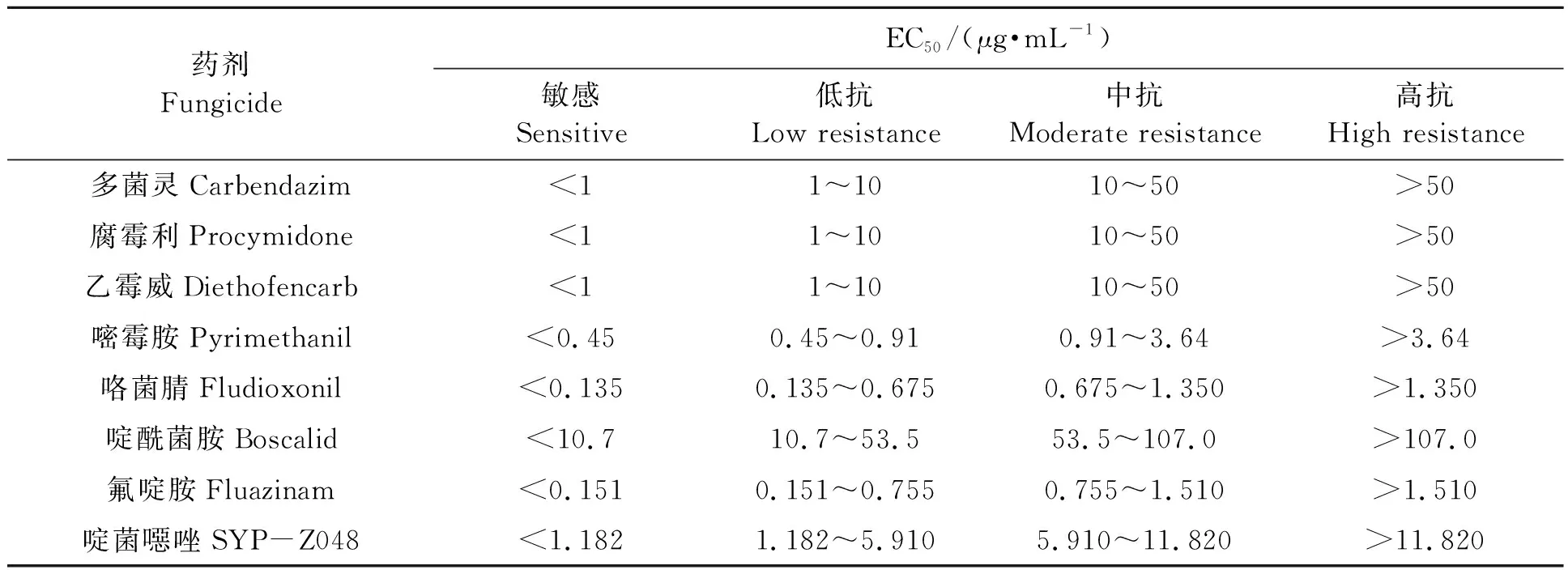
表1 灰霉病菌抗药性水平判断标准[11-18]Table 1 Standard of resistant level of Botrytis cinerea[11-18]
2 结果与分析
2.1 8类药剂在不同地区不同品种条件下的毒力水平差异
表2显示,供试8类药剂在不同地区不同品种条件下的毒力水平表现不一。从药剂水平看,氟啶胺、咯菌腈和啶酰菌胺对葡萄灰霉病菌分生孢子萌发的抑制率整体较高,其毒力相对较好,尤其是氟啶胺;而多菌灵和啶菌噁唑对葡萄灰霉病菌分生孢子萌发的抑制率整体较低,其毒力相对较差,尤其是多菌灵,灰霉病菌已明显对其产生抗药性。从不同地区看,青铜峡地区的灰霉病菌孢子萌发抑制率平均值为61.29%,对药剂敏感性稍好;其次是贺兰山沿山的灰霉病菌孢子萌发抑制率平均值为60.76%;宁夏农垦的灰霉病菌孢子萌发抑制率平均值为56.35%。从不同品种看,鲜食葡萄品种整体较好,尤其是红地球上的灰霉病菌孢子萌发抑制率平均值为71.40%,对药剂敏感性稍好;而酿酒葡萄品种稍差,尤其是赤霞珠上的灰霉病菌孢子萌发抑制率较低,平均值为46.88%,抗药性较强。
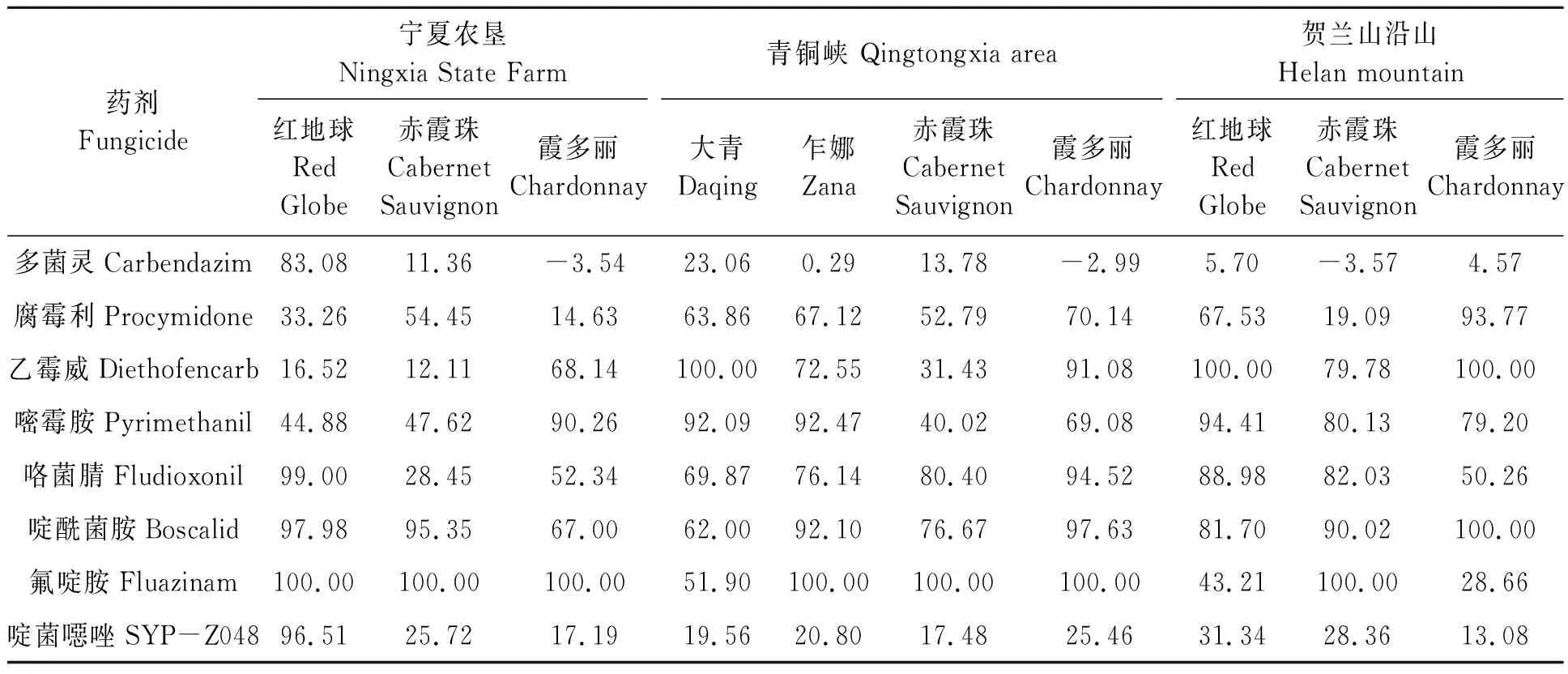
表2 8类药剂下葡萄灰霉病菌的分生孢子萌发抑制率Table 2 Inhibition rate of conidia germination of Botrytis cinerea under 8 fungicides %
2.2 不同地区主栽品种上的灰霉病菌株对8类药剂的敏感性
2.2.1不同灰霉病菌株对多菌灵的敏感性 从表3可以看出,供试10个菌株对多菌灵的EC50,均远高于50 μg·mL-1,全部为高抗菌株。近些年来,多菌灵在各葡萄主产区普遍使用,已明显产生很高的抗药性,个别地区品种上EC50值高达35 000 μg·mL-1左右。
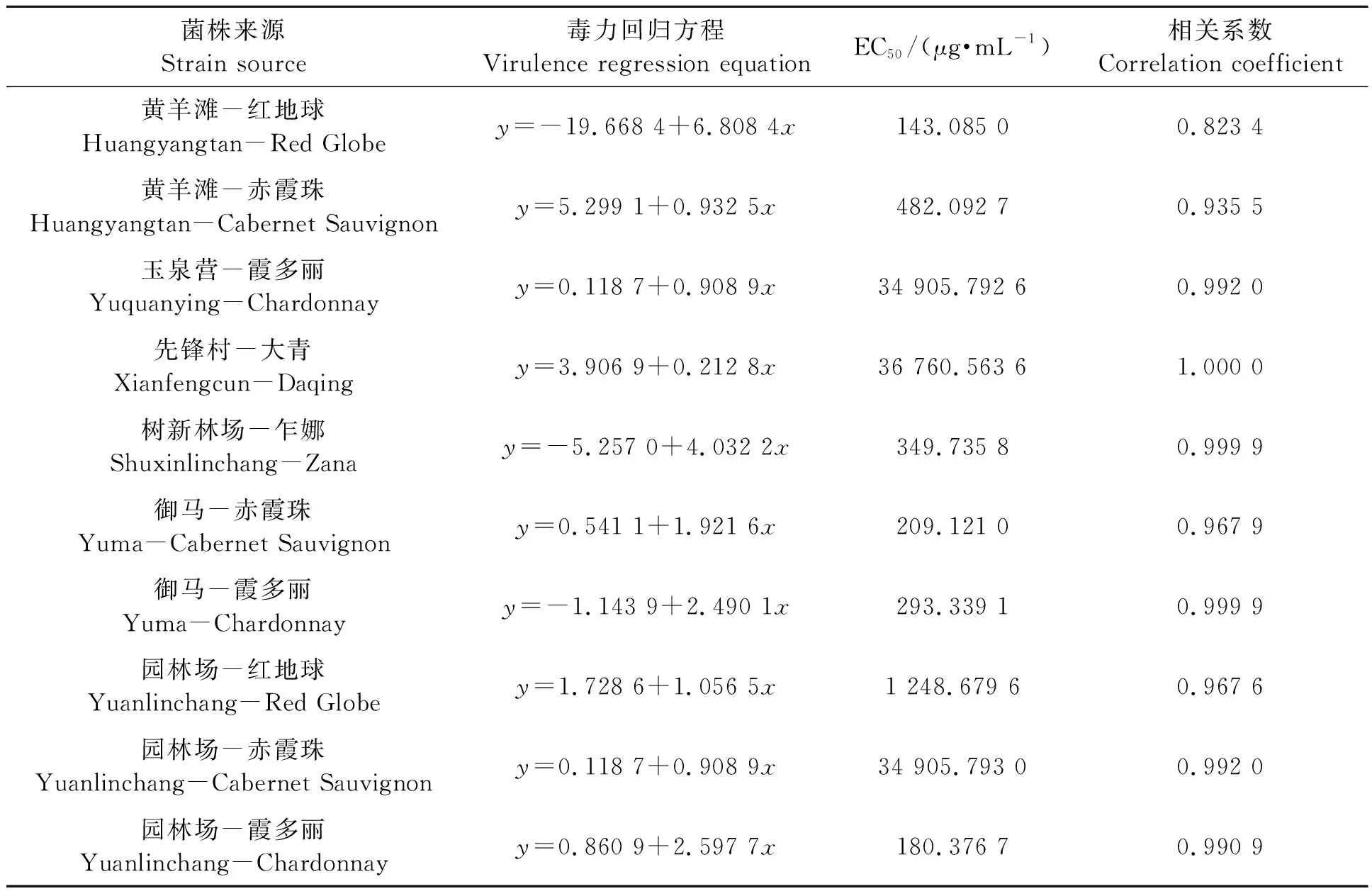
表3 不同灰霉病菌株对多菌灵的敏感性Table 3 Sensitivity of different strains of Botrytis cinerea to carbendazim
2.2.2不同灰霉病菌株对腐霉利的敏感性 表4中数据显示,供试10个菌株中,玉泉营和园林场园区葡萄灰霉病菌株对腐霉利的EC50均高于50 μg·mL-1,为高抗菌株;黄羊滩和青铜峡园区的10 μg·mL-1≤EC50<50 μg·mL-1,均为中抗菌株。腐霉利起初进入产业使用时,防效非常突出。但据田间调查,近几年,随着该药在各葡萄产区频繁使用或妄自高浓度施用,抗药性问题已显现。
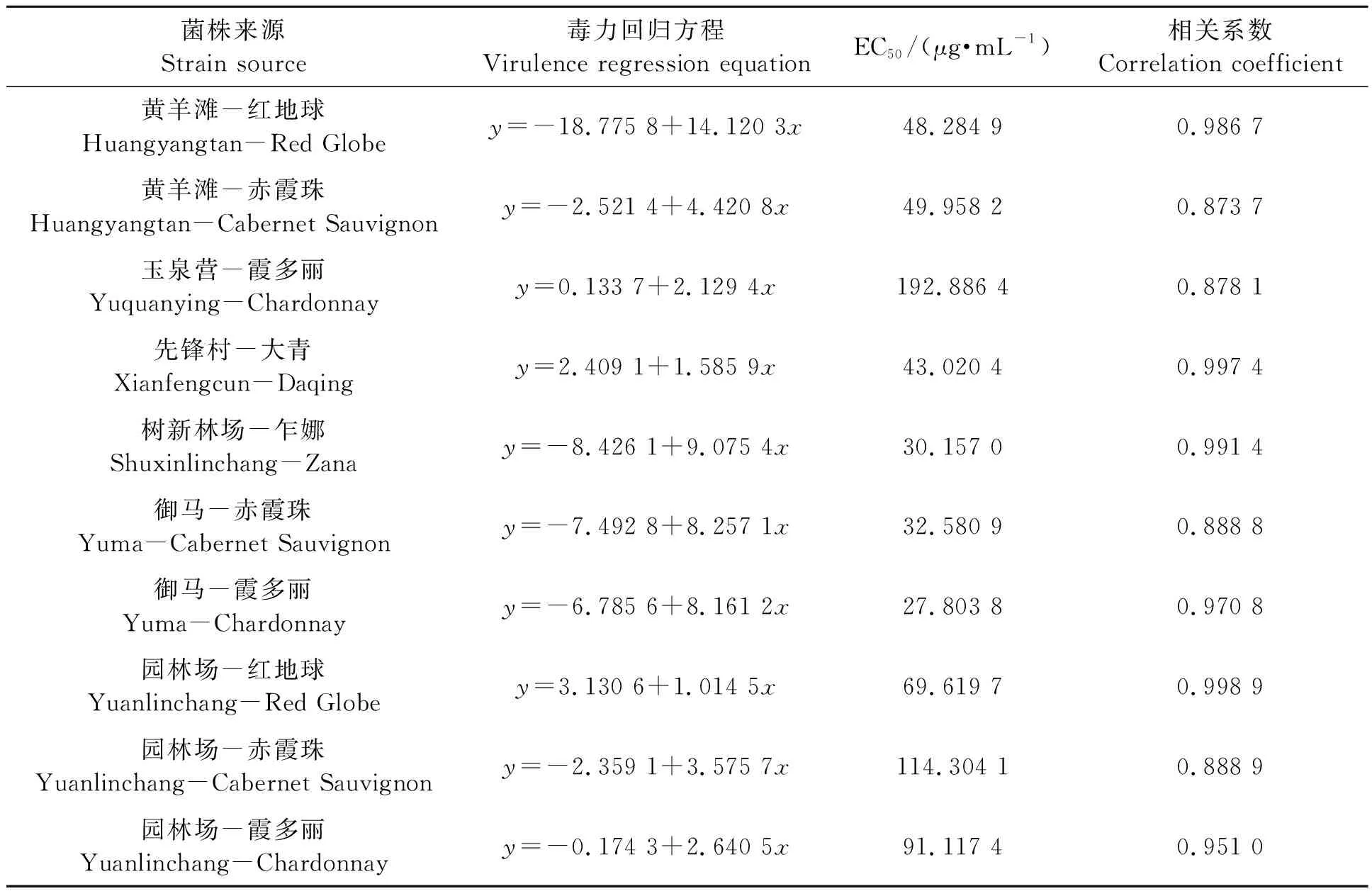
表4 不同灰霉病菌株对腐霉利的敏感性Table 4 Sensitivity of different strains of Botrytis cinerea to procymidone
2.2.3不同灰霉病菌株对乙霉威的敏感性 表5显示,供试10个菌株中,先锋村大青、御马霞多丽和园林场霞多丽上葡萄灰霉病菌株对乙霉威的EC50均低于1 μg·mL-1,为敏感菌株;玉泉营霞多丽和园林场赤霞珠的1 μg·mL-1≤EC50<10 μg·mL-1,为低抗菌株;树新林场乍娜、御马赤霞珠和园林场红地球均为中抗菌株;而黄羊滩红地球和黄羊滩赤霞珠为高抗菌株。由此可见,黄羊滩园区的灰霉病菌株对乙霉威的抗药性已很高,需引起重视。
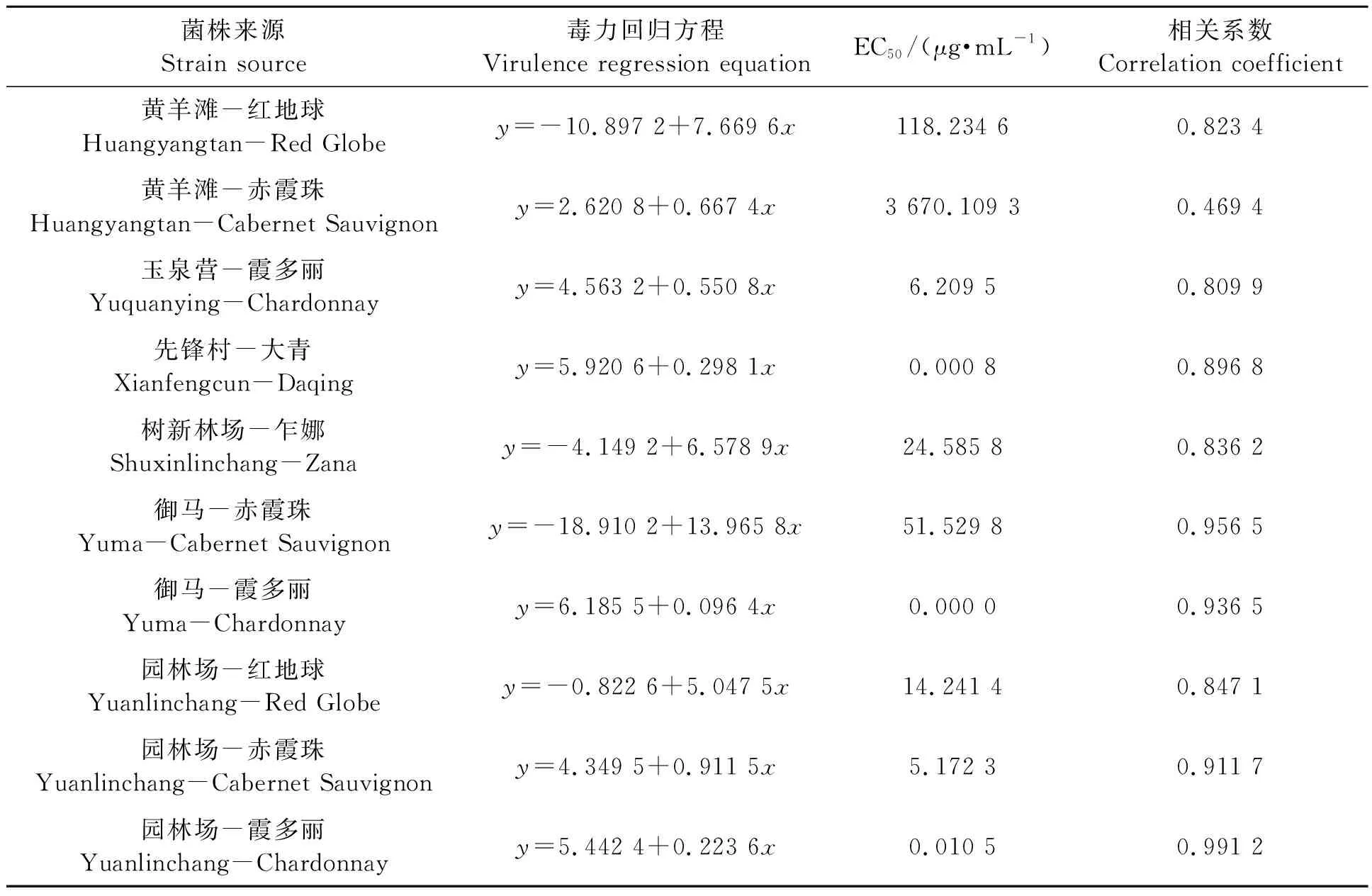
表5 不同灰霉病菌株对多菌灵的敏感性Table 5 Sensitivity of different strains of Botrytis cinerea to diethofencarb
2.2.4不同灰霉病菌株对嘧霉胺的敏感性 从表6可以看出,供试10个菌株对嘧霉胺的EC50均远高于3.64 μg·mL-1,全部为高抗菌株。嘧霉胺为近些年常用药剂,在各葡萄主产区使用年限和水平无明显差异,今后应酌情施用。
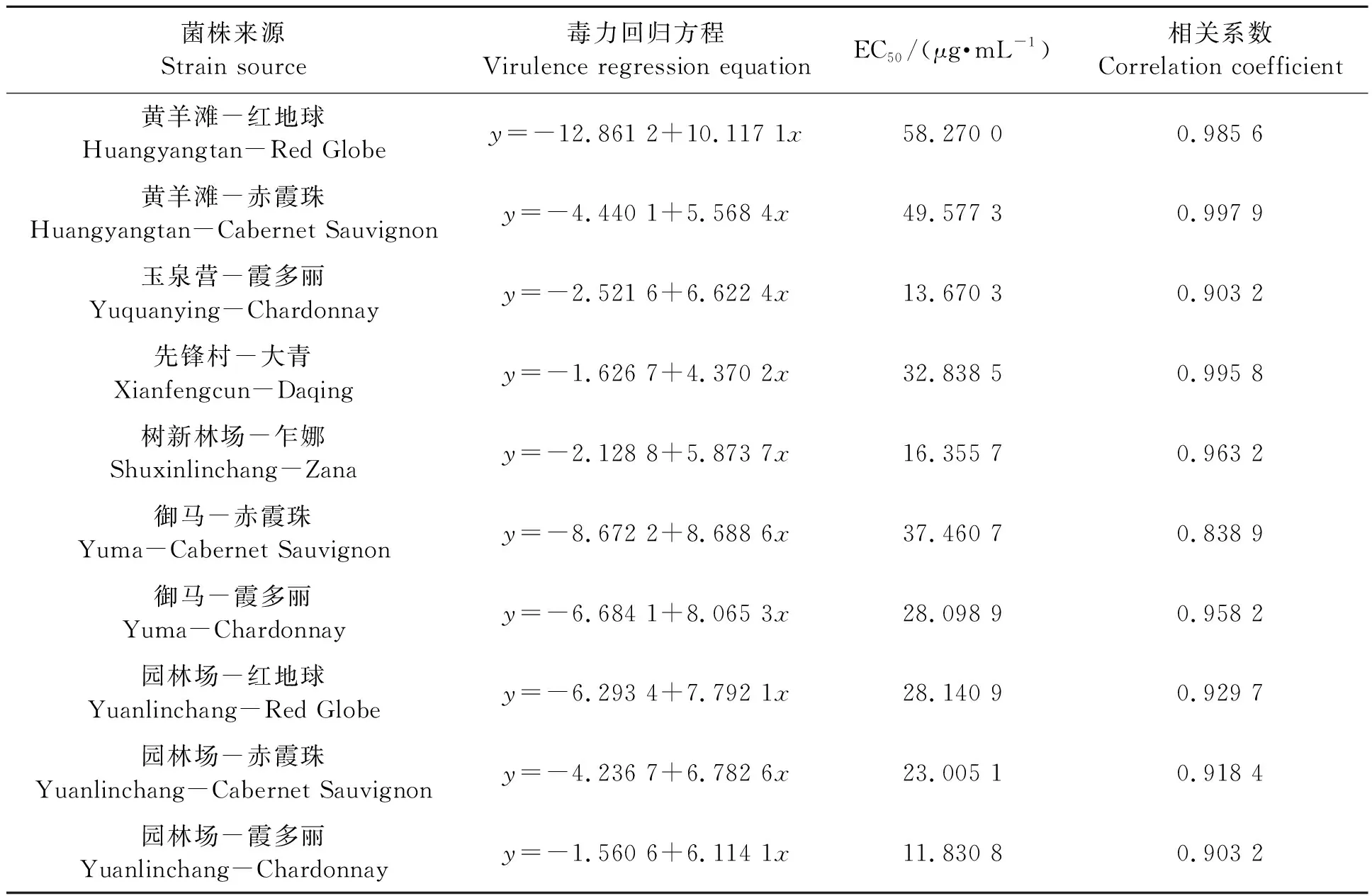
表6 不同灰霉病菌株对嘧霉胺的敏感性Table 6 Sensitivity of different strains of Botrytis cinerea to pyrimethanil
2.2.5不同灰霉病菌株对咯菌腈的敏感性 表7显示,除园林场红地球上的灰霉病菌对咯菌腈为中抗,其余菌株均为高抗,可能与霞多丽为灰霉病易感品种,且近两年施用该药较多有关。但整体而言,供试10个菌株对咯菌腈的EC50均较低,田间使用该药效果也较好,今后需注意施用浓度和频率,防止抗药性问题的严重发展。
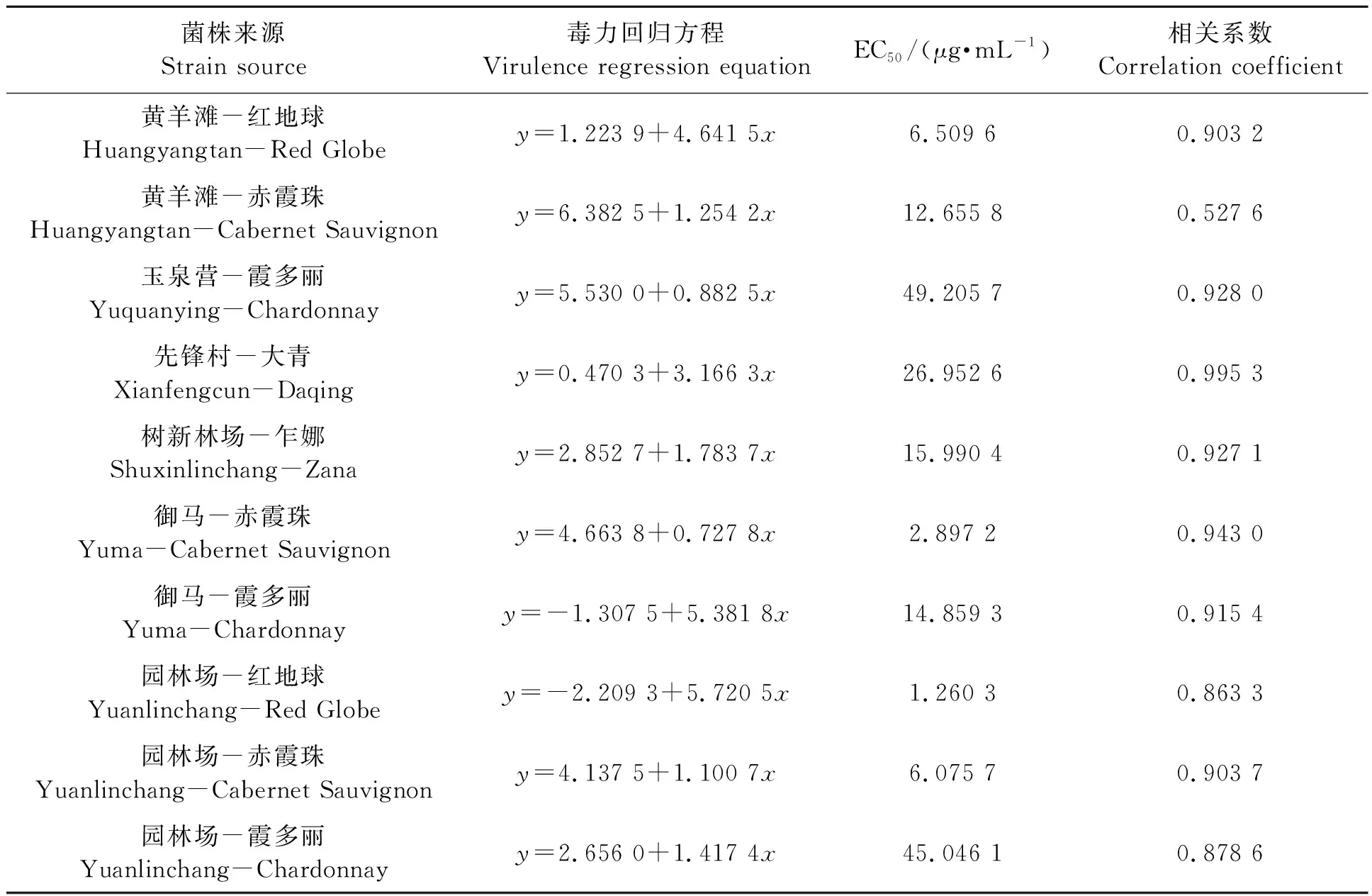
表7 不同灰霉病菌株对咯菌腈的敏感性Table 7 Sensitivity of different strains of Botrytis cinerea to fludioxonil
2.2.6不同灰霉病菌株对啶酰菌胺的敏感性
从表8可以看出,黄羊滩红地球和赤霞珠、树新林场乍娜、御马霞多丽、园林场霞多丽上灰霉病菌株对啶酰菌胺的EC50<10.7 μg·mL-1,均为敏感菌株;其余菌株均为低抗菌株。该药在贺兰山东麓各葡萄园使用较少,目前抗药性不明显,今后可与抗药性明显的药剂交替施用,以减缓抗药性的产生。
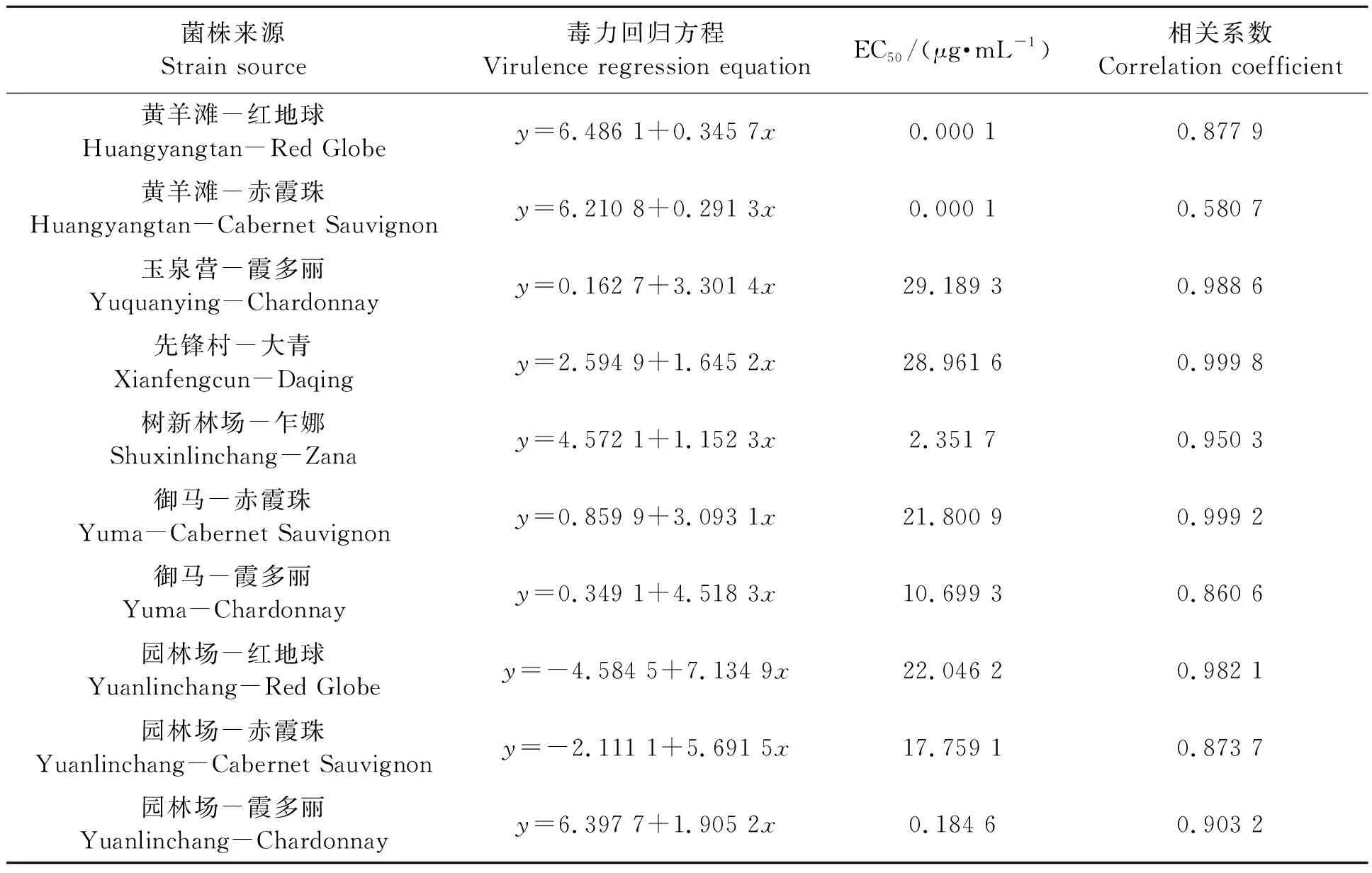
表8 不同灰霉病菌株对啶酰菌胺的敏感性Table 8 Sensitivity of different strains of Botrytis cinerea to boscalid
2.2.7不同的灰霉病菌株对氟啶胺的敏感性
表9中数据显示,供试10个菌株对氟啶胺的EC50均为0.184 6 μg·mL-1,均为低抗菌株,表现一致。该药在贺兰山东麓各葡萄园使用较少,今后可与抗药性明显的药剂交替施用,以减缓抗药性的产生。
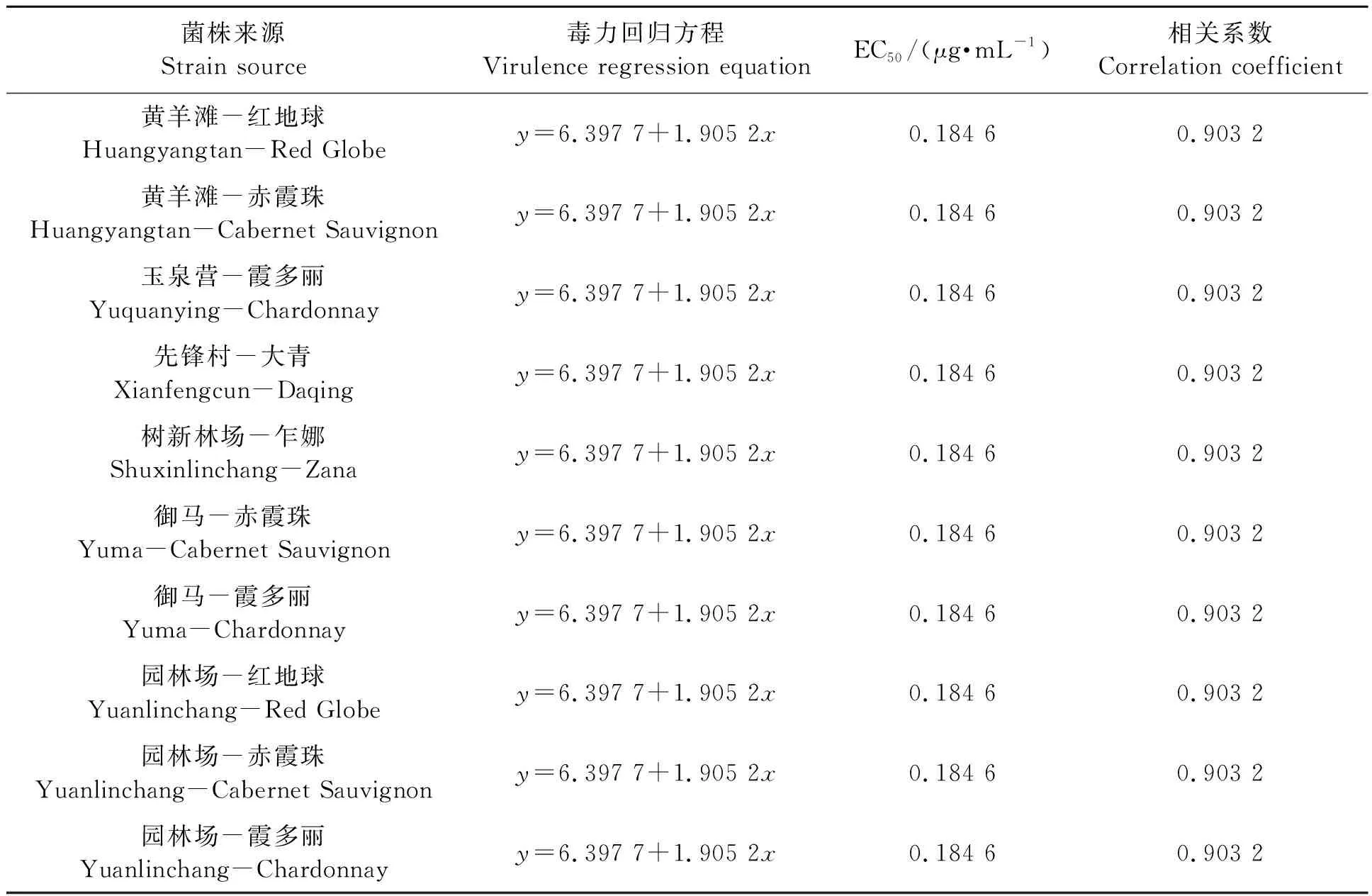
表9 不同灰霉病菌株对氟啶胺的敏感性Table 9 Sensitivity of different strains of Botrytis cinerea to fluazinam
2.2.8不同灰霉病菌株对啶菌噁唑的敏感性
从表10可以看出,供试10个菌株对啶菌噁唑的EC50全部高于敏感基线的100倍,即11.82 μg·mL-1,均为高抗菌株;尤其是树新林场乍娜和园林场霞多丽上的灰霉病菌对啶菌噁唑的EC50高达220 μg·mL-1以上,为特高抗菌株。由于该药在贺兰山东麓各葡萄园施用频繁,抗药性已表现明显,今后应减少施用。
3 讨论
本研究发现,乙霉威对青铜峡产区的乍娜、赤霞珠、霞多丽上的灰霉病菌孢子形态产生影响。多菌灵也使该地区赤霞珠上的灰霉病菌孢子形态发生改变。此外,多菌灵作用下多数菌株的灰霉病菌孢子芽管几乎等同于对照,有的甚至已发育成菌丝体,抗药性明显很高;但与乙霉威不会同时出现在同一抗性水平上。这与张传清等[11]报道的乙霉威作用特点一致,是一种与多菌灵有负交互抗性的杀菌剂。药剂进入菌体细胞后与菌体细胞内的微管蛋白结合,从而影响细胞的分裂。这种作用方式与多菌灵很相似,但二者不在同一作用点。如灰霉菌一旦对多菌灵产生抗药性,而对乙霉威很敏感。相反,对多菌灵敏感的灰霉菌,乙霉威则表现为无抑菌活性。因此,可参考沈宙等[19]报道的将多菌灵与乙霉威进行适当比例复配,可表现出相加或增效作用。
本研究结果显示,贺兰山东麓3大葡萄种植区各主栽品种上用药种类和水平不一,所产生的抗药性程度也有所不同。但总体比较来看,灰霉病菌株对氟啶胺的敏感性最强,这与陈志芳等[17]的研究结果一致。其次为啶酰菌胺、咯菌腈和乙霉威,对多菌灵和啶菌噁唑产生的抗药性最强。在今后化学防治时,田间可依据病害发生情况、气象条件及环境因素交替使用不同抗性杀菌剂,预防时可使用抗药性较强药剂或低浓度的敏感药剂,病害发生较重时使用较高浓度的敏感药剂,尽量降低农药的过度使用、浪费和污染,达到药剂的高效利用和延缓病菌产生抗药性的目的。
本研究在实施过程中也引发了一些思考,若能进一步研究供试8类药剂的交互抗性关系,将有助于制定出更详尽更科学的葡萄灰霉病化学防治细则,对指导贺兰山东麓葡萄产业生产使用更有实效与意义。

