我国市场上UHT灭菌乳和巴氏杀菌乳中四种兽药残留风险评估
乔勤勤 文 芳 郑 楠 王加启 程建波 薛秀恒
(1.安徽农业大学 茶与食品科技学院,合肥 230036; 2.中国农业科学院 北京畜牧兽医研究所/农业农村部奶及奶制品质量安全控制重点试验室/ 农业农村部奶产品质量安全风险评估试验室(北京),北京 100193; 3.安徽农业大学 动物科技学院,合肥 230036)
在奶牛养殖过程中使用兽药可预防和治疗奶牛疾病,提高养殖业生产率[1-3]。然而,兽药使用不当或休药时间不足可能会导致牛奶中出现兽药残留,危害消费者健康,如引起过敏反应、导致耐药性增强和致癌等[4-8]。一般兽药在热处理下具有高稳定性,兽药残留很容易从生鲜乳中转移到超高温灭菌乳(UHT乳)和巴氏杀菌乳中[9-11]。因此,欧盟(The European Union)、食品法典委员会(The Codex Alimentarius Commission)和我国农业农村部分别对牛奶中兽药的最大残留限量(Maximum residue limits)作出了明确的规定[12-14]。我国农业农村部235公告中明确规定牛奶中氟喹诺酮(Quinolones)、四环素(Tetracyclines)、链霉素(Streptomycin)和林可霉素(Lincomycin)的最高残留限量分别为100、100、200和150 μg/kg[14]。
以酶联免疫吸附试验(ELISA)为基础的可视化微阵列检测技术作为一种快速、高特异性的分析牛奶中兽药残留方法,与传统检测方法如液相色谱法(LC)、液相色谱质谱联用法(LC-MS/MS)和ELISA等相比较,具有操作简便、特异性强、检测速度快、检测通量大,可同时检测牛奶中多种残留物等优点[15-18]。该检测技术已成功应用于检测多种目标物分析中,如抗生素残留、硝基呋喃代谢物和乳铁蛋白等[19-21]。
目前,对我国市场上牛奶中四环素和喹诺酮的残留进行风险评估的报道较少[22-23],缺乏对于牛奶中链霉素和林可霉素的残留分析的相关研究。因此,本研究拟以从我国25 个省(市)中采集的150 份UHT灭菌乳样品和50 份巴氏杀菌乳样品为研究对象,采用ELISA可视化微阵列芯片检测试剂盒检测我国奶牛养殖过程中常用的氟喹诺酮、四环素、链霉素和林可霉素类等4 种兽药残留并进行分析,以检测我国市场上UHT灭菌乳样品和巴氏杀菌乳样品中兽药残留并分析风险水平。
1 材料与方法
1.1 样品采集
2017年3—9月,本课题组分别从我国北京、天津、河北、上海、山东、山西、陕西、湖北、河南、江苏、江西、浙江、安徽、四川、重庆、甘肃、黑龙江、辽宁、内蒙古、宁夏、新疆、福建、广东、广西和云南等25 个省(市)的超市共收集了150 份UHT灭菌乳样品和50 份巴氏杀菌乳样品。在分析之前,将UHT灭菌乳样品在室温下储存,巴氏杀菌乳样品在4 ℃下储存。所有分析均在样品保质期到期之前完成。
1.2 试剂及仪器
芯片扫描仪(MRS-4800QA,上海中晶科技有限公司,中国),氮吹浓缩仪(N1-Automatic Nitrogen Concentrator,上海屹尧仪器科技发展有限公司,中国),涡旋振荡器(Vortex- Genie 2,Scientific Industries,美国),恒温震荡孵育器(MTS-2,南京祥中生物科技有限公司,中国),ELISA可视化微阵列芯片检测试剂盒(南京祥中生物科技有限公司,中国)。
氟喹诺酮、四环素、链霉素和林可霉素混合标准液、抗体工作液、二抗工作液、显色液A、显色液B、终止液、10×浓缩复溶液、20×浓缩洗涤液、10×浓缩标准液,均购自南京祥中生物科技有限公司。乙酸乙酯(分析纯)和正己烷(分析纯)购自国药集团化学试剂有限公司。
1)配制洗涤工作液:去离子水20×浓缩洗涤液按1∶19体积比进行稀释用于芯片板的洗涤,于 4 ℃ 储存。
2)配制复溶工作液:去离子水10×浓缩复溶液按1∶9体积比进行稀释用于芯片板的洗涤,于4 ℃储存。
3)配制标准工作液:复溶工作液按照1∶9的体积比例稀释10×浓缩标准液,现配现用。
分析成像结果可以发现,异常出现在两个球体中央靠近左侧质量比较小的球体,这就说明该成像技术在比较浅的地层中异常越明显,和单个球体成像结果相同。但这种模型对小质量异常体表现得更加明显,总而言之,这样的成像技术适合浅源矿体勘探。
1.3 试验方法
1.3.1样品前处理
移取1.00±0.05 mL牛奶样品至50 mL聚苯乙烯离心管中,加入6 mL乙酸乙酯,2 500 r/m转速下涡旋振荡,5 000 r/m转速下离心10 min。离心后,移取3 mL乙酸乙酯至10 mL干净干燥的玻璃试管中,于50 ℃下用氮吹仪吹干。加入1 mL正己烷,用振荡仪(2 000 r/m)振荡1 min。再加入500 μL复溶工作液,用振荡仪(2 000 r/m)振荡3 min。移入2 mL聚苯乙烯于离心管中,在 5 000 r/m 转速条件下离心10 min。去除上层有机相,取下层水相25 μL用于分析。
1.3.2检测牛奶中四种兽药残留
采用ELISA可视化微阵列芯片试剂盒同时检测牛奶中氟喹诺酮、四环素、链霉素和林可霉素残留。本试验检测方法按照试剂盒的说明书进行。方法概要如下:
1)使用前,将试剂盒置于室温(20~25 ℃)下平衡30 min以上,摇匀所有液体试剂并避光储存。
2)在微孔支架中插入足够数量的芯片微孔条,以容纳所有标准品、对照品和样品。并按照对应微孔按序编号,每个标准品、对照品和样品均做双孔平行。
3)加样:依次加入25 μL样品或标准品和 25 μL 抗体工作液到各自的微孔中,用盖板膜封板,轻轻振荡混匀,25 ℃ 600 r/m 振荡反应30 min。
4)洗板:将液体从孔中倒出,然后将微孔支架上下颠倒3 次,放在吸水纸上以完全除去液体。用250~300 μL洗涤缓冲液填充所有微孔,并如上步骤中所述倒出液体,重复洗涤3 次。
5)向每个孔中加入50 μL二抗溶液,用盖板膜封板,轻轻振荡混匀,37 ℃ 600 r/m振荡速度下反应30 min。取出并重复洗板操作。
6)显色:将显色液A和显色液B以1∶1混合均匀。每孔加入混合液50 μL,37 ℃ 600r/m避光孵育12 min。重复洗板操作。
7)测定:对于比色成像和信号采集,使用微阵列定制的芯片扫描仪(灰度从0到65,535任意单位,分辨率为3 200 dpi)扫描和分析96 孔板,同时进行成像和数据采集,检测结果报告将自动生成。
本试验所采用的试剂盒对牛奶中氟喹诺酮、四环素、链霉素和林可霉素残留的检测限(Limit of detection,LOD)分别为5.00、10.00、10.00和10.00 μg/L,低于检测限则判定为未检出。本试验首先对试剂盒的相关参数进行验证分析,以确保试验的准确性。试验中4 种兽药标准品浓度见表1,试剂盒相关参数见表2。
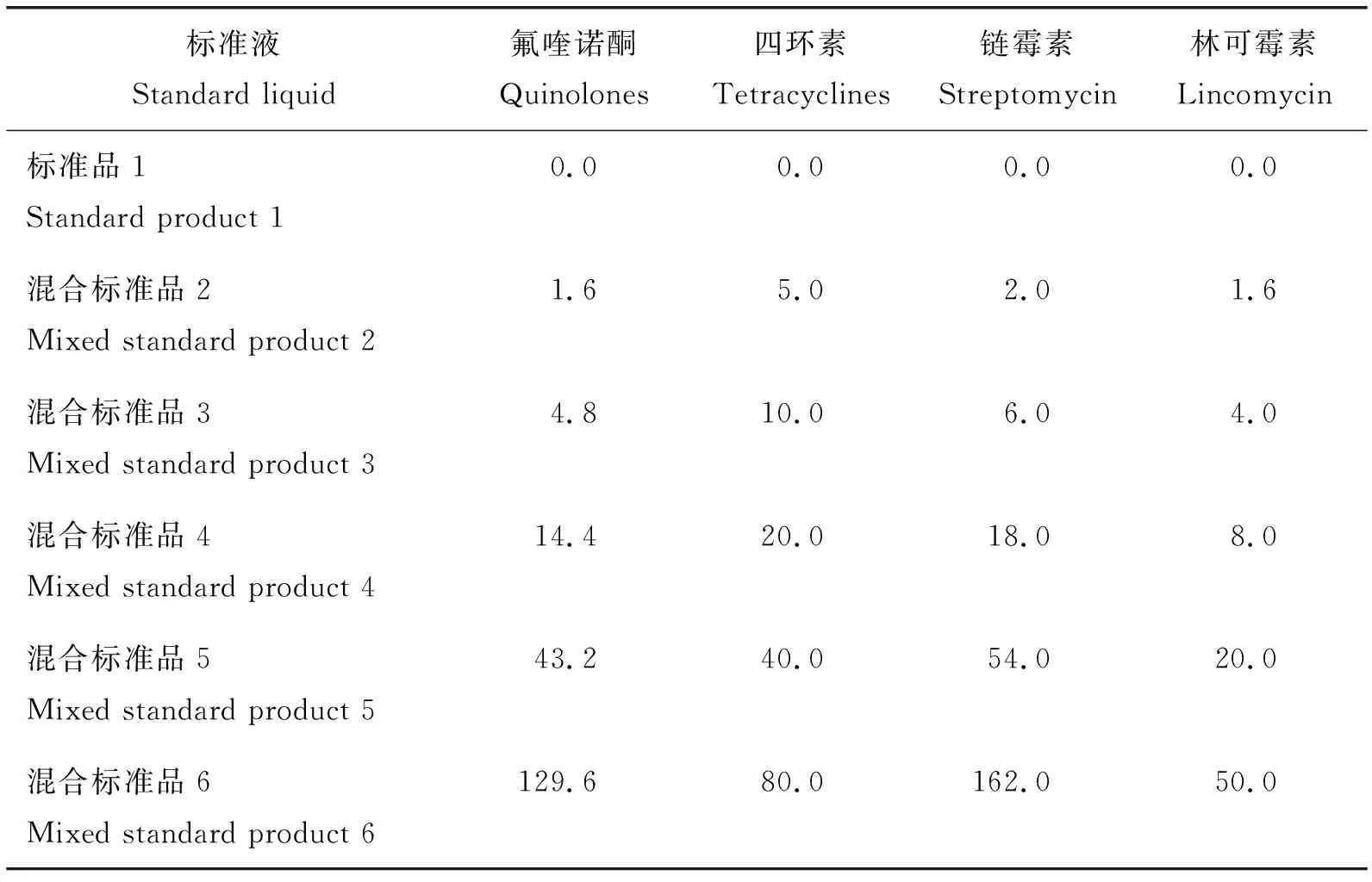
表1 四种兽药标准品质量浓度Table 1 Standard concentrations of four different veterinary drugs μg/L
1.3.3试剂盒相关参数验证试验
氟喹诺酮、四环素、链霉素和林可霉素的标准溶液浓度为1 000 μg/L,向1 mL牛奶样品中添加标准溶液体积为20 μL,牛奶样品中氟喹诺酮、四环素、链霉素和林可霉素加标浓度为20 μg/L。随机选取24份牛奶样品,每份样品进行2次平行试验。
1.4 统计方法
每份牛奶样品进行2个平行测定,平均值用于计算兽药的残留水平。使用MiELISA软件(MiELISA v 1.11,南京祥中生物科技有限公司)自动进行图像分析和定量分析。

表2 试剂盒相关参数Table 2 Related parameters of experiment kit used
2 结果与分析
2.1 试剂盒的相关参数验证
验证试剂盒的相关参数的结果表明:氟喹诺酮测定浓度17.02~23.41 μg/L,回收率85%~117%;四环素测定浓度17.00~23.61 μg/L,回收率85%~118%;链霉素测定浓度16.34~25.5 μg/L,回收率82%~128%;林可霉素测定浓度17.44~21.88 μg/L,回收率87%~109%。进一步统计发现(表3):牛奶样品中氟喹诺酮、四环素、链霉素和林可霉素测定浓度平均值分别为19.11、20.15、21.22和18.82 μg/L,回收率平均值分别为95.53%、94.94%、106.8%和94.11%。根据我国国家标准(GB/T 27404—2008)[24],这些数值都符合ELISA方法中限定的回收值范围,说明该试剂盒测定结果可信。
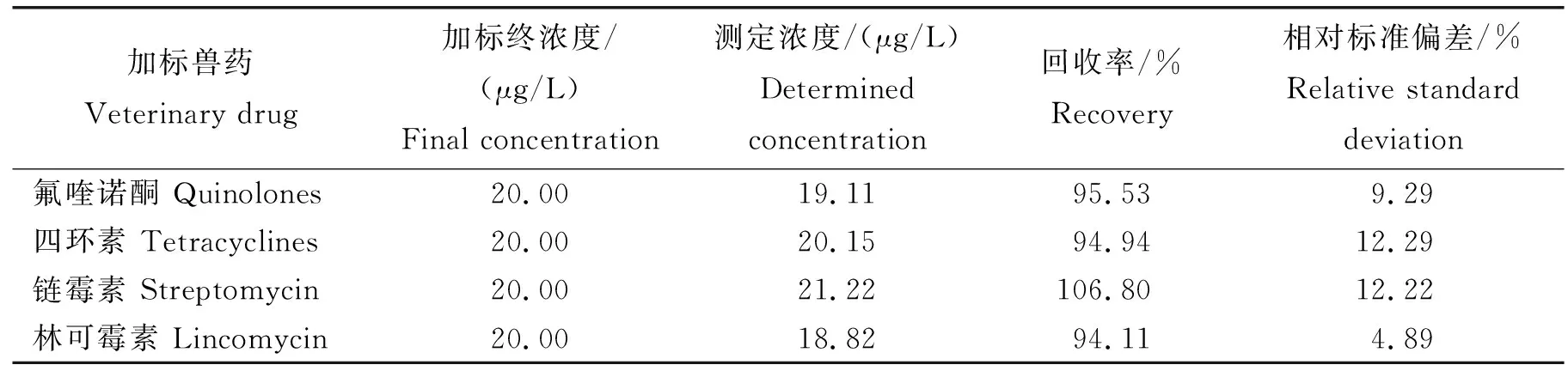
表3 四种兽药残留的检测结果(n=24)Table 3 Test results of four types of veterinary drug residues (n=24)
2.2 我国市场上UHT灭菌乳和巴氏杀菌乳中四种兽药残留
我国农业农村部颁布的《全国奶业发展规划》将奶业产区划分为东北内蒙古产区(黑龙江、吉林、辽宁和内蒙古)、华北产区(河北、河南、山东和山西)、西部产区(陕西、甘肃、青海、宁夏、新疆和西藏)、南方产区(湖北、湖南、江苏、浙江、福建、安徽、江西、广东、广西、海南、云南、贵州和四川)和大城市周边产区(北京、天津、上海和重庆)等5个区域[25]。根据奶业产区划分特点,对从我国市场上收集的150 份UHT灭菌乳和50 份巴氏杀菌乳样品进行兽药残留分析。
兽药残留分析表明:收集的150 份UHT灭菌乳样品中氟喹诺酮、四环素、链霉素和林可霉素的检出率分别为0%、0%、3.3%和0%,其中链霉素检出值为12.49 μg/L;我国生产的100 份UHT灭菌乳样品中氟喹诺酮、四环素、链霉素和林可霉素的检出率分别为0%、0%、2.0%和0%,其中链霉素检出值为12.49 μg/L,检出链霉素的牛奶样品均来源于南方产区(2 份);进口的50 份UHT灭菌乳样品中氟喹诺酮、四环素、链霉素和林可霉素的检出率分别为0%、0%、6.0%和0%,其中链霉素检出值为12.09 μg/L,检出链霉素的牛奶样品分别来源于德国、法国和澳大利亚(表4)。收集的50份巴氏杀菌乳样品中氟喹诺酮、四环素、链霉素和林可霉素的检出率分别为0%、0%、8.0%和2.0%,其中链霉素和林可霉素检出值分别为21.16和16.48 μg/L;兽药检出样品均来自国产巴氏杀菌奶,其中检出链霉素的牛奶样品分别来源于华北产区(2 份)、西部产区(1 份)和南方产区(1 份),检出林可霉素的牛奶样品来源于南方产区(1 份);进口巴氏杀菌奶中未检出兽药残留(表5)。


3 讨 论
本试验牛奶样品中,氟喹诺酮、四环素、链霉素和林可霉素的检出率分别为0%、0%、4.5%和0.5%,其中:链霉素残留在华北产区、西部产区和南方产区检出率分别为8.0%、3.2%和6.0%;林可霉素残留在南方产区检出率为2%,其他产区检出率均为0%;检测氟喹诺酮和四环素残留量最高浓度均低于检测限,检测样品均来源于UHT灭菌乳样品;链霉素残留量最高浓度为21.16 μg/L,林可霉素残留量为16.48 μg/L,均来源于巴氏杀菌乳样品。4 种兽药残留量最高浓度均低于欧盟、食品法典委员会和我国标准中规定的最大残留限量。已有研究相继报道了我国市场上牛奶样品中氟喹诺酮和四环素残留的情况:崔海辉[26]从浙江省内收集的140 份巴氏杀菌乳样品中四环检出率为2.8%;张养东等[22]2010年9月从我国市场上收集的94 份UHT灭菌乳样品和26份巴氏杀菌乳样品,UHT灭菌乳样品中氟喹诺酮和四环素检出率为95.7%和0%,巴氏杀菌灭菌乳样品中氟喹诺酮和四环素检出率为61.5%和7.7%,所有液态奶样品中氟喹诺酮和四环素残留量最高浓度为20.49和47.7 μg/L;Han等[23]2011年6月从我国市场上收集的180份UHT灭菌乳样品中氟喹诺酮和四环素的检出率为100%和0%,其中氟喹诺酮和四环素残留量最高浓度为58.8 μg/L和<1.5。上述结果表明,液态奶中兽药残留量检出率因检测方法和检测限不同而存在差异,但仍可明显看出氟喹诺酮和四环素残留在液态奶中经常被检出。我国市场上也发现牛奶中一些其他兽药残留物,例如磺胺类和磺胺二甲嘧啶[12-13]。因此,有必要严格实施有效的监管措施,从生产源头上控制原料奶中兽药残留,严格执行牛奶质量安全监测体系,坚决贯彻落实食品安全有关部门的决策部署,从根本上保障牛奶的质量安全[27-28]。
4 结 论
本研究发现2016下半年和2017年上半年我国市场上UHT灭菌乳和巴氏杀菌乳样品中氟喹诺酮、四环素、链霉素和林可霉素残留情况污染的发生率较低,且均未超过欧盟、食品法典委员会和我国标准中规定的最大残留限量。但是,由于牛奶中某些兽药残留仍有检出,需要严格执行有效的监管和控制措施,残留物控制在安全水平以内,确保牛奶产品安全。

