鲟鱼软骨酶解条件优化及酶解物的体外抗肿瘤活性
武瑞赟 杜怡丽 黄雨霞 李鹏飞 郑海涛 李平兰
(中国农业大学 食品科学与营养工程学院,北京 100083)
癌症也称作恶性肿瘤,近年来发病率呈现逐年上升的趋势[1-2]。在癌症治疗的漫长过程中,药物的毒副作用明显,已成为急需解决的问题。因此,研究与开发高效低毒的生物活性物质成为研究的热点。
目前研究较多的生物活性物质为多糖类[3]、黄酮类[4]以及生物碱类[5]。长期以来,人们认为蛋白质只有变成氨基酸才能够被人体吸收,且仅仅能够为人体提供氮源和氨基酸[6]。然而已有研究证明,2~6个氨基酸组成的寡肽可被机体吸收和利用[7];新的研究还发现,当体内缺少一些调节生理功能的肽时,会导致机体机能的改变[8],适当补充某些生物活性肽如抗菌肽[9]、胶原多肽[10]等对于调节机体免疫力,促进人体健康具有重要的作用。因此,新型生物活性肽类资源的挖掘受到广泛关注,已成为近年来研究的又一个热点。骨胶原多肽是胶原或者明胶经过蛋白酶降解处理得到的产物,具有较强的水溶性,易被机体吸收[11-12],且具有抗氧化、抗肿瘤活性及抑制DPP-4酶等多种[13]功能。鲟鱼(Sturgeon)是现存起源最早的硬鳞软骨脊椎动物之一[14],除头盖骨外,其余全为软骨,约占鱼体的10%左右[15]。软骨中富含蛋白质等多种营养成分,其中胶原蛋白占比很大。目前鲟鱼骨作为加工副产物未进行精深开发,主要用于饲料的生产,利用率低,附加值少。因此,研究与开发功能性的鲟鱼骨胶原肽具有潜在的市场应用前景。
本研究拟采用碱性蛋白酶和中性蛋白酶联合使用的方法,对鲟鱼骨制备骨胶原多肽的酶解条件进行研究;利用细胞模型,考察骨胶原多肽对癌细胞增殖的抑制能力,并探究其对癌细胞中参与凋亡的关键酶活性的影响以及作用方式,以期为鲟鱼骨胶原多肽功能研究及产品开发应用提供理论依据。
1 材料与方法
1.1 试验材料
人结直肠癌细胞Caco-2、人乳腺癌细胞MCF-7、人肝癌细胞HeGp2、人肺癌细胞A549、人宫颈癌细胞HeLa,中国医学科学院基础医学研究所赠予;人工养殖西伯利亚鲟和史氏鲟杂交鲟鱼,北京市农科院水产技术研究所十渡鲟鱼繁育基地提供。
DMEM培养基、磷酸盐缓冲液(Phosphate buffered saline,PBS),美国Corning公司;胰蛋白酶-乙二胺四乙酸消化液(0.25%),北京索莱宝科技有限公司;细胞增殖Cell Counting Kit-8(CCK-8)试剂盒、细胞膜电位检测试剂盒、caspase-1、caspase-3活力检测试剂盒,上海碧云天生物技术有限公司;碱性蛋白酶(2.30×105IU/g),中性蛋白酶(7.68×104IU/g),购自诺维信(中国)生物技术有限公司;木瓜蛋白酶(1.00×105IU/g),胰蛋白酶(2.50×105IU/g),购自宝如亿(北京)生物技术有限公司;胃蛋白酶(8.00×105IU/g),购自宝如亿(北京)生物技术有限公司。L-亮氨酸,北京酷来搏科技有限公司;三氯乙酸,牛血清蛋白,碳酸钠,酒石酸钾钠,硫酸铜,Folin-酚乙液,上海百赛生物技术股份有限公司;四硼酸钠,西陇科学股份有限公司;5-氟脲嘧啶(5-fluorouracil,5-FU),武汉制药集团股份有限公司。
1.2 仪器与设备
电子分析天平FA1004,上海天平仪器厂;紫外可见分光光度计UV-1800,上海美谱达仪器有限公司;pH计EF28,上海梅特勒-托利多仪器有限公司;恒温磁力搅拌器IT-07A-3,上海一恒科学仪器有限公司;微量台式离心机Sorvall Legend Micro 17,赛默飞世尔科技公司;Imark酶标仪,美国Bio-Rad公司。
1.3 方法
1.3.1鲟鱼软骨粉制备
鲟鱼软骨经煮沸剔除残留肉渣后,浸泡于95%乙醇中脱脂后晾干,经24 h冷冻干燥后磨粉制得所需的鲟鱼软骨粉。
1.3.2鲟鱼骨酶解物肽得率测定
将三氯乙酸(TCA)沉淀法与 Folin-酚法结合测定肽得率。
取原溶液及酶解液各5 mL,加入5 mL 30%的TCA,静置20 min 后4 000 r/min离心15 min,取 1 mL 稀释一定倍数的上清液,加入5 mL Folin-酚甲液后混匀。在25 ℃条件下保温10 min,之后加入0.5 mL Folin-酚乙液并且立刻振荡均匀,在 25 ℃ 条件下保温30 min,保温结束后测定500 nm的吸光值,代入标准曲线中,计算出样品中多肽的含量。肽得率即酶解得到的多肽与原样品中总的肽含量的比值,计算公式为:

1.3.3蛋白酶种类筛选
选取5种酶解鱼骨常用酶,以肽得率为考察指标,在各酶理论最适酶解条件(表1)下处理鲟鱼软骨粉,选出适宜的酶种类。

表1 各酶理论最适酶解条件Table 1 Optimal conditions for enzymatic hydrolysis by theory
以骨粉与水质量比为1∶25将骨粉溶于去离子水中,分别取相同体积的骨溶液,按表1条件各添加1×105IU/g的相应蛋白酶,酶解3 h后置于沸水中灭酶10 min,经4 000 r/min,10 min离心收集上清液,测定鲟鱼软骨粉酶解液中肽含量。
1.3.4单因素试验
在碱性蛋白酶与中性蛋白酶酶活力比为1∶1的条件下,以酶解时间(1、3、5、7、9 h)、酶解温度(35、40、45、50、55 ℃)、骨粉与水质量比(1∶5、1∶15、1∶25、1∶35、1∶45)、加酶量(0.5×105、1×105、1.5×105、2×105、2.5×105IU/g)为变量,研究不同酶解条件对鲟鱼骨肽得率的影响,然后固定以上最优条件,考察碱性蛋白酶与中性蛋白酶在不同的酶活力比下对肽得率的影响。酶解时先加入碱性蛋白酶,调节溶液pH至8.0(碱性蛋白酶最适pH),经过一半时间后加入中性蛋白酶,调节溶液pH至7.0(中性蛋白酶最适pH)。
1.3.5酶解条件正交试验优化
在蛋白酶初筛试验的基础上,选择肽得率最高的两种酶对鲟鱼软骨粉进行酶解,选择加酶量、骨粉与水质量比、酶解时间、酶解温度和碱性蛋白酶与中性蛋白酶酶活力比5个因素,以肽得率为考察指标,设计5因素5水平L25(55)正交试验(表2)。用IBM SPSS Statistics.V22设计正交试验并进行方差分析。

表2 正交试验因素与水平表Table 2 Orthogonal test factors and level table
1.3.6细胞复苏培养及细胞增殖检测
细胞从液氮罐中取出,迅速置于37 ℃水浴中,不断摇动细胞冻存管快速解冻。将解冻后的细胞快速转移至15 mL的离心管中,加入DMEM培养液重悬细胞后,转移至无菌的细胞培养瓶中,于37 ℃、5% CO2条件下培养,待细胞长至80 %以上,进行传代,传至3 代以上后用于试验。
细胞经胰蛋白酶消化后,轻轻吹打使其分散成单个细胞,进行细胞计数,将细胞悬液加入96 孔细胞培养板中,细胞数为5×103个/孔;置于37 ℃、5% CO2培养箱中贴壁过夜培养;弃去原细胞培养液,处理组每孔加入100 μL不同质量浓度的鲟鱼骨胶原多肽(50、100、200、400、800、1 000 μg/mL),另设不添加任何受试物只加有细胞的对照组和不加细胞的空白组,同时设置50 μg/mL 5-氟脲嘧啶(5-fluorouracil,5-FU)为阳性对照组。每个质量浓度设6 个平行,继续培养24 h。药物处理结束,每孔添加10 μL的CCK-8试剂,于37 ℃避光反应4 h;用酶标仪于450 nm波长处测定吸光度,细胞抑制率(U)的计算公式如下:
式中:M处理、M对照、M空白分别为处理组、对照组和空白组于450 nm波长处测定的吸光度,nm。
1.3.7caspase-1、 caspase-3活力测定
细胞以5×105个/mL种于6 孔培养板中,在DMEM完全培养基中培养,待细胞贴壁12 h后,加入不同质量浓度的骨胶原多肽样品,另设不加任何刺激物的对照组。培养24 h后,胰蛋白酶消化细胞,经PBS洗涤1次后,裂解细胞测定caspase-1、caspase-3活力。在冰浴条件下,加入细胞裂解液,冰浴裂解15 min后,4 ℃、12 000 r/min离心20 min,收集上清液。向收集好的上清液中加入底物,37 ℃孵育2 h,用酶标仪在405 nm测定吸光度。最终的caspase酶活力单位定义为每微克蛋白样品在37 ℃、2 h内作用于底物所产生的物质的量。
1.3.8线粒体膜电位(JC-1)检测
细胞以5×105个/mL种于6 孔培养板中,在DMEM完全培养基中培养,待细胞贴壁12 h后,加入不同质量浓度的骨胶原多肽样品,另设不加任何刺激物的对照组。培养24 h后,胰蛋白酶消化细胞,经PBS洗涤1次后,加入1 mL JC-1染色工作液,充分混匀。置于细胞培养箱中37 ℃孵育20 min。吸除上清液,用JC-1染色缓冲液(1倍)洗涤2次。加入2 mL细胞培养液后在475~520 nm处使用荧光分光光度计检测。
1.4 数据分析
测量数据由统计软件SPSS 16.0进行单因素方差分析检测不同数据间是否存显著差异。试验数据以平均值±标准差表示。
2 结果分析
2.1 标准曲线的绘制
精密称取牛血清蛋白(BSA)配制成浓度为 250 μg/mL 的BSA标准溶液,向各管试管中依次加入 Folin-酚甲液并混匀。将试管置于25 ℃保温10 min,加入 Folin-酚乙液后立即振荡混匀,在 25 ℃ 下保温30 min,在500 nm下测定吸光度。绘制标准曲线见图1,线性方程为y=0.001 5x+0.017,相关性R2=0.998 8,表明线性关系良好。

图1 牛血清蛋白标准曲线
Fig.1 Standard curve of BSA
2.2 酶解鲟鱼软骨粉蛋白酶的筛选
蛋白酶解的主要目的是生成具有更多功能特性的肽类,但在蛋白酶解同时,会生成少量氨基酸。因而如何计算水解过程中多肽得率是广泛关注的问题。三氯乙酸(TCA)作为一种蛋白质沉淀剂可以沉淀蛋白质以及较长的肽段。蛋白质的多肽链在酶解反应中会随着反应的进行逐渐被切成大小不等的片段,在TCA中的溶解指数就会增大。TCA溶解指数就特定的底物而言可以定性地反映蛋白质的分裂情况,溶解指数越高,表明较短肽段的含量越高。试验将三氯乙酸(TCA)沉淀法与Folin-酚法结合测定肽得率,以多肽得率为指标,探究适合鲟鱼软骨酶解的酶解条件。
首先分别测定了碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶在其理论条件下酶解鲟鱼软骨粉蛋白的肽得率,结果见图2。碱性蛋白酶在其理论酶解条件下酶解效果最好,酶解后肽得率可达(51.74±1.63)%,其次是中性蛋白酶(36.05±0.26)%,因此选择碱性蛋白酶和中性蛋白酶作为下一步研究用酶。

J,碱性蛋白酶;Z,中性蛋白酶;Y,胰蛋白酶;M,木瓜蛋白酶;W,胃蛋白酶。柱形上方不同字母表示在0.05水平上有显著性差异,下图同。
J,alkaline protease; Z,neutral protease; Y,trypsin; M,papain; W,pepsin. The letter above the column indicates that there is significant difference at 0.05 level. The same bellow.
图2 蛋白酶酶解肽得率
Fig.2 Determination of the yield of peptidyl hydrolyzed by protease
2.3 单因素试验
采用控制变量的方法,探究不同因素对肽得率的影响,以期为正交试验的设计提供依据。试验结果见图3。
2.4 正交试验优化
2.4.1正交试验设计
根据单因素试验结果,选取加酶量(A)、料液比(B)、酶解时间(C)、酶解温度(D)和碱性蛋白酶与中性蛋白酶酶活力比(E)5个因素,每个因素5个水平,以酶解后骨胶原多肽得率为考察指标,进行L25(55)正交试验确定制备鲟鱼骨胶原多肽各因素的最佳条件。

图3 酶解条件对鲟鱼骨胶原多肽得率的影响
Fig.3 Effect of hydrolysis on the yield of sturgeon bone collagen polypeptide
表3 正交试验方案及结果
Table 3 Orthogonal test scheme and results

试验号Test number因素水平 FactorABCDE肽得率/%Peptide yield12251232.70±0.6025521562.60±0.8033452166.01±0.6645243172.24±0.4751555351.27±1.0865354482.98±0.3372145460.07±0.4383235557.12±1.1093124236.75±0.61101111142.15±0.69114153568.03±1.29124214355.56±1.42132534164.07±1.01141444553.95±0.31155132373.53±0.96163341365.58±1.12174431464.53±1.45181333234.31±0.13193513446.98±0.32201222437.12±0.24212423351.07± 0.09224325160.76±1.14232312550.01±1.18245415232.19±1.61254542239.02±0.66K1218.8280.53206.89247.56295.23K2247.92232.04248.30265.69174.97K3272.44283.64293.56283.63297.01K4297.9267.75290.86293.31301.68K5333.54273.94320.99271.41301.71R16.815.8922.305.9124.14
注:A、B、C、D、E为试验因素,具体含义见表2,下表同。
Note:A,B,C,DandEare the test factors and the specific meaning is shown in
Table 2. The same in the following table.
正交试验方案及极差分析结果见表3,方差分析结果见表4。
由表3极差分析中R值比较可知,影响肽得率的因素顺序为E>C>A>D>B,即碱性蛋白酶与中性蛋白酶酶活比>酶解时间>加酶量>酶解温度>骨粉与水质量比。由表4极差分析中K值可初步得到各因素最优水平分别为A5B3C5D4E5,由方差分析结果可知,A、C、E这3个因素对肽得率具有极显著影响(P<0.01),B、D两因素对其影响不显著(P>0.05)。

表4 正交试验结果方差分析Table 4 Analysis of variance of orthogonal test results
2.4.2骨胶原肽最佳酶解条件的验证
结合酶解条件正交试验的极差及方差分析结果,考虑到复合酶酶解中多种酶会在蛋白中产生多种作用位点,相比单酶反应,能够得到更多多肽,最优酶解工艺为A5B3C5D4E5,即加酶量1.5×105IU/g、骨粉与水质量比1∶25、酶解时间5 h、酶解温度55 ℃、碱性蛋白酶与中性蛋白酶酶活比为1∶2时酶解。该条件下测得肽含量为(72.36±2.33)%。
2.5 鲟鱼骨胶原多肽对癌细胞增殖活性的影响
对于毒性小、高活性的天然抗肿瘤药物的发现与评价一直是研究热点。在这些研究中,研究者们评价抗肿瘤活性所使用的细胞种类很多,包括结肠癌细胞(HT-29,DLD-1),乳腺癌细胞(MCF-7),胶质瘤细胞(U87),前列腺癌细胞(PC-3,DU-145,H-1299),胃癌细胞(AGS)与宫颈癌细胞(HeLa)等[19-20]。Gouic等[21]从金枪鱼蛋白酶解物中分离得到肽,发现它们对人乳腺癌细胞 MCF-7的增殖具有明显的抑制作用。贾盈露等[22]利用酶解法,从沙蚕中分离纯化出多肽PAP,并发现PAP可以抑制人肺癌细胞A549的增殖。
本研究利用CCK-8试剂盒测定并计算不同质量浓度(ρ)的骨胶原多肽以及5-FU分别作用于5株癌细胞24 h后的细胞存活率,结果见图4。不同质量浓度的骨胶原多肽对5种癌细胞都存在一定的抑制作用,尤其对人乳腺癌细胞MCF-7、人结直肠癌细胞Caco-2以及人肺癌细胞A549,骨胶原多肽都在一定程度上降低了细胞的存活率,且抑制率呈现剂量依赖效应,最大抑制率阳性对照5-FU的抑制率,说明鲟鱼骨胶原多肽具有抑制细胞增殖的潜力。
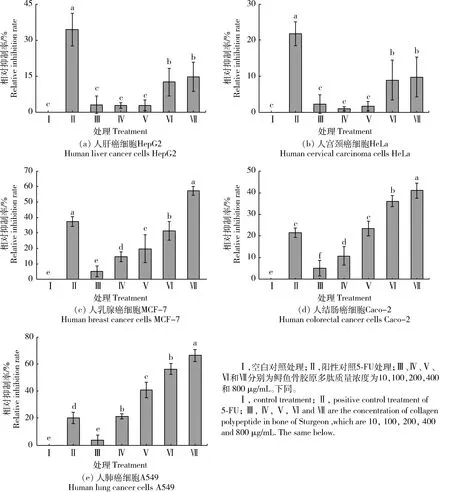
图4 鲟鱼骨胶原多肽对癌细胞增殖的影响
Fig.4 Effect of sturgeon bone collagen polypeptide on proliferation of cancer cells
2.6 鲟鱼骨胶原多肽对癌细胞凋亡的影响
抑制细胞增殖的途径很多,其中凋亡是最常见,也是最主要的途径,细胞凋亡分为早期凋亡、中期凋亡以及晚期凋亡,不同时期,蛋白酶表达不同。Slattery等[23]发现LL-37是通过激活caspase非依赖性的凋亡通路抑制人结肠癌细胞的生长;化疗药物紫杉醇、阿霉素等都可通过激活caspase途径诱导凋亡[24]。选择抑制效果较好的1株癌细胞——人肺癌细胞A549,通过检测处理前后,其各时期具有代表性的酶活力大小,进而阐明作用机理。
2.6.1鲟鱼骨胶原多肽对癌细胞中caspase-1酶活力的影响
Caspase(Cysteine-requiring Aspartate Protease)是1个在细胞凋亡过程中起重要作用的蛋白酶家族[25]。caspase 1是caspase家族中唯一可以剪切IL-1b前体蛋白或IL-18前体产生相应成熟的细胞因子的酶,并可以产生20和10 ku的蛋白片段,这2个片段可以形成异源二聚体,并进一步由2个异源二聚体形成四聚体,从而调节细胞凋亡。试验结果显示,随着鲟鱼骨胶原多肽浓度的增加,细胞中caspase-1酶活力增加,当肽质量浓度为400 μg/mL时,酶活力可达216 IU/μg,且具有剂量效应关系(图5),表明骨胶原多肽处理细胞后,可以引起细胞早期凋亡。

图5 鲟鱼骨胶原多肽对癌细胞中caspase-1酶活力的影响
Fig.5 Effect of sturgeon bone collagen polypeptide on caspase-1 enzyme activity in cancer cells
2.6.2鲟鱼骨胶原多肽对癌细胞中线粒体膜电位(JC-1)的影响
本试验采用荧光检测酶标仪对骨胶原多肽处理人肺癌细胞A549后的细胞线粒体膜电位电势进行了测定。试验结果表明(图6),随着处理浓度的增加,膜电位电势Δψm呈现下降趋势,当浓度为 400 μg/mL 时,Δψm仅为239.875,低于阳性对照433.875。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。凋亡机制的深入研究表明,几乎在所有诱导剂引起的各种类型的细胞凋亡中,如肿瘤坏死因子诱导的单核细胞凋亡等,均出现Δψm下降,并且由于膜电位电势的改变可以引起膜通透性的改变,进而促使细胞凋亡的发生,因此,Δψm下降为凋亡早期阶段[26]。

图6鲟鱼骨胶原多肽对癌细胞中线粒体膜电位(JC-1)的影响
Fig.6 Effect of sturgeon bone collagen polypeptide on mitochondrial membrane potential (JC-1) in cancer cells
2.6.3鲟鱼骨胶原多肽对癌细胞中caspase-3酶活力的影响
caspase-3(Cysteine-requiring Aspartate Protease 3)也称凋亡执行酶,最终可以直接诱导细胞发生凋亡,属于细胞晚期凋亡酶[27-28]。Black等[29]在SD大鼠的IRI的心肌细胞中发现,与对照组相比,在凋亡心肌细胞中caspase-3酶活增加显著,但仅为80.33%;Du等[30]在研究大豆异黄酮对2型糖尿病小鼠睾丸细胞凋亡的抑制作用中发现,在高血糖环境下小鼠睾丸细胞凋亡增多,同时细胞中的caspase-3酶活力增强。本研究对鲟鱼骨胶原多肽处理细胞后,细胞中的caspase-3酶活进行了测定,结果显示随多肽浓度的增加而增加,最大酶活可达149.90 IU/μg,显著高于空白对照组(40.08 IU/μg)和阳性对照组5-FU(66.56 IU/μg),说明鲟鱼骨胶原多肽可以促进凋亡酶活性的增加,诱导细胞晚期凋亡的发生(图7)。
3 讨 论

图7 鲟鱼骨胶原多肽对癌细胞中caspase-3酶活力的影响
Fig.7 Effect of sturgeon bone collagen polypeptide on caspase-3 enzyme activity in cancer cells
癌症是由于细胞中DNA突变,不能正常的调控细胞增殖和凋亡,细胞异常分裂形成癌细胞。抑制癌细胞增殖是抗癌的主要途径之一。关于食源性抗肿瘤蛋白酶解物和多肽的研究很多,如从凤尾松分离的多肽Cr-ACP1[31]、分离自小牛脾脏的脾多肽[32]等都被证明具有很好的抗肿瘤效果,但其中来源是水产品的较少,Liang 等[33]考察海洋胶原肽对自然衰老过程中自发肿瘤的影响,发现摄入海洋胶原肽后雌雄SD大鼠自发肿瘤率有一定程度的下降,表明海洋胶原肽长期喂养对SD大鼠自发肿瘤的发生及发展具有一定的抑制作用,并在一定程度上可以延长生存时间;Tao等[34]发现白僵菌素作为一种环肽,可降低线粒体膜电位,促进细胞色素C释放,激活 caspase系统,从而杀伤肿瘤细胞,进一步的构效分析发现,抗肿瘤肽限定为包含12~100个氨基酸残基且富含碱性氨基酸(赖氨酸,精氨酸,组氨酸)的短肽。本研究利用碱性蛋白酶和中性蛋白酶复合酶解,通过正交优化试验获得了较高得率的鲟鱼骨胶原多肽,肽含量为(72.36±2.33)%。生物活性检测结果显示,鲟鱼骨胶原多肽可以激活细胞中的凋亡蛋白酶caspase-1,形成细胞早期凋亡现象,进而诱导PT孔打开,线粒体跨膜电位下降,激活凋亡执行酶caspase-3,酶活性增加,促进细胞凋亡。初步验证了鲟鱼骨胶原多肽可以诱导人肺癌细胞A549凋亡,为鲟鱼等水产品的精深加工及增值利用提供了新的思路与途径。

