Omega-3多不饱和脂肪酸衍生物18-HEPE对人子宫内膜癌细胞株侵袭的抑制作用研究
李杰萍,邹建平,江絮萍,杨 琳,刘桐宇,谢 榕
(1.武警福建总队医院 a.检验科;b.妇产科, 福州 350003;2.福建省肿瘤医院妇科肿瘤外科,福州 350014)
多不饱和脂肪酸(poly unsaturated fatty acids, PUFAs)作为一类独特的生物活性物质对人体有重要的生理功能,主要包含omega-3 PUFAs和omega-6 PUFAs两大类,它们都是合成类二十烷酸化合物的前体,具有稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、抗癌、抗炎和抗心血管病等生理功能,是目前营养生化研究热点之一[1]。随着时间的推移和社会经济的发展变化,特别是近100~150年以来,人类的膳食结构发生巨大变化。人类食物中omega-3 PUFAs含量明显减少,而omega-6 PUFAs含量明显增多,造成人类摄入的omega-3 PUFAs与omega-6 PUFAs比值严重失调。高omega-6/omega-3 PUFAs比值的膳食引发一系列慢性疾病如肿瘤、心血管疾病、糖尿病和自身免疫性疾病等,增加摄入omega-3 PUFAs对于保持身体健康和预防多种慢性疾病有着极为重要的意义[2-5]。Omega-3 PUFAs除了通过结合其受体发挥生物学功能外,还通过其衍生物或代谢产物发挥作用[2,6]。我们以前的研究表明,omega-3 PUFAs衍生物(5Z,8Z,11Z,14Z,16E)-18-羟基-5,8,11,14,16-二十碳五烯酸[(5Z,8Z,11Z,14Z,16E)- 18-Hydroxy-5,8,11,14,16icosapentaenoic acid,18-HEPE]能有效抑制黑色素瘤细胞的肺转移[7]。本研究我们探讨18-HEPE对子宫内膜癌(endometrial cancer, EC)细胞侵袭能力的影响。
1 材料与方法
1.1 实验细胞 人EC细胞株HEC-1B和RL952细胞购自中国科学院典型培养保藏委员会细胞库。HEC-1B细胞用含有10 g/dl灭活小牛血清、100 IU/ml青霉素、100 μg /ml链霉素的DMEM高糖培养基;RL95-2细胞采用含10 g/dl灭活小牛血清、100 IU/ml青霉素、100 μg/ml链霉素、NaHCO3及胰岛素的DMEM/F12培养基,置37 ℃、5 ml/dl CO2饱和湿度的培养箱内培养。
1.2 主要试剂和仪器 Trizol试剂盒购自美国Ambion公司;荧光定量PCR试剂盒购自美国Invitrogen公司;Transwell小室购自美国Coming公司;Matrigel基质胶购自美国BD公司;18-HEPE购自美国Cayman公司;抗MMP-2抗体、抗MMP-9抗体和抗PTEN抗体购自美国Santa Cruz公司;GAPDH抗体购自北京中山公司。实时荧光定量PCR仪购自美国ABI公司;低温高速离心机购自美国Thermo Fisher公司。
1.3 方法
1.3.1 侵袭实验:肿瘤细胞的侵袭潜力通过体外Transwell小室实验来评估,实验按照说明书进行。首先,用Matrigel覆盖Transwell板上室,将含不同浓度的18-HEPE处理的细胞(5×105)于无血清培养基中加入上室,500 μl含 FBS的培养基加入下室,培养24 h后,将Transwell小室取出,小心擦去上层细胞,晾干后,固定、染色,于显微镜下随机选取5个视野,计算穿膜细胞数。实验重复3次,取其平均值。
1.3.2 实时定量PCR分析:收集细胞后,加入Trizol试剂提取RNA,逆转录为cDNA后进行实时定量PCR。IL-6上游引物:5’-TCCAGTTGCCTTCTTGGGAC-3’,下游引物:5’-GTGTAATTAAGCCTCCGACTTG-3’;GAPDH上游引物:5’-CGACTTCAACAGCAACTCCCACTCTTCC-3’,下游引物:5’-TGGGTGGTCCAGGGTTTCTTACTCCTT-3’。 反应条件为93 ℃变性2 min,然后按93 ℃ 30s,55 ℃ 1min,72 ℃ 30s,共35个循环,最后72 ℃延伸10 min。样本结果均用GAPDH标化,每个样本设3个复孔,采用2-ΔΔCt计算相对表达量。
1.3.3 Western blot分析 : 样品进行SDS-PAGE后,电转移至硝酸纤维素膜,然后用50 g/L脱脂奶粉4 ℃封闭过夜,弃溶液,加入用50 g/L脱脂奶粉稀释的一抗,室温轻摇1 h,TBST洗膜3次后,加入用50 g/L脱脂奶粉稀释的二抗(辣根过氧化物酶偶联的羊抗兔/羊抗鼠IgG),室温轻摇1 h,TBST洗膜3次后,用化学发光法显色5 min,压片显影。
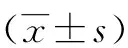
2 结果
2.1 18-HEPE明显抑制EC细胞的侵袭 Transwell小室侵袭实验结果见图1。18-HEPE在50~200 pg/ml的浓度范围内以剂量依赖性抑制EC细胞HEC-1B和RL95-2的侵袭。
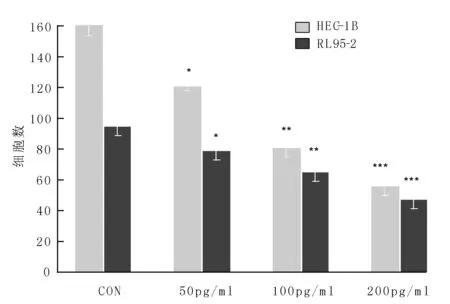
*P<0.05,**P<0.01,***P<0.001 图1 18-HEPE抑制EC细胞侵袭
2.2 18-HEPE抑制EC细胞侵袭相关基因的表达 见图2。本研究采用Western Blot实验进一步观察18-HEPE对EC细胞侵袭相关基因的影响,结果发现100 pg/ml 18-HEPE明显抑制HEC-1B和RL 95-2细胞MMP-2和MMP-9的表达。
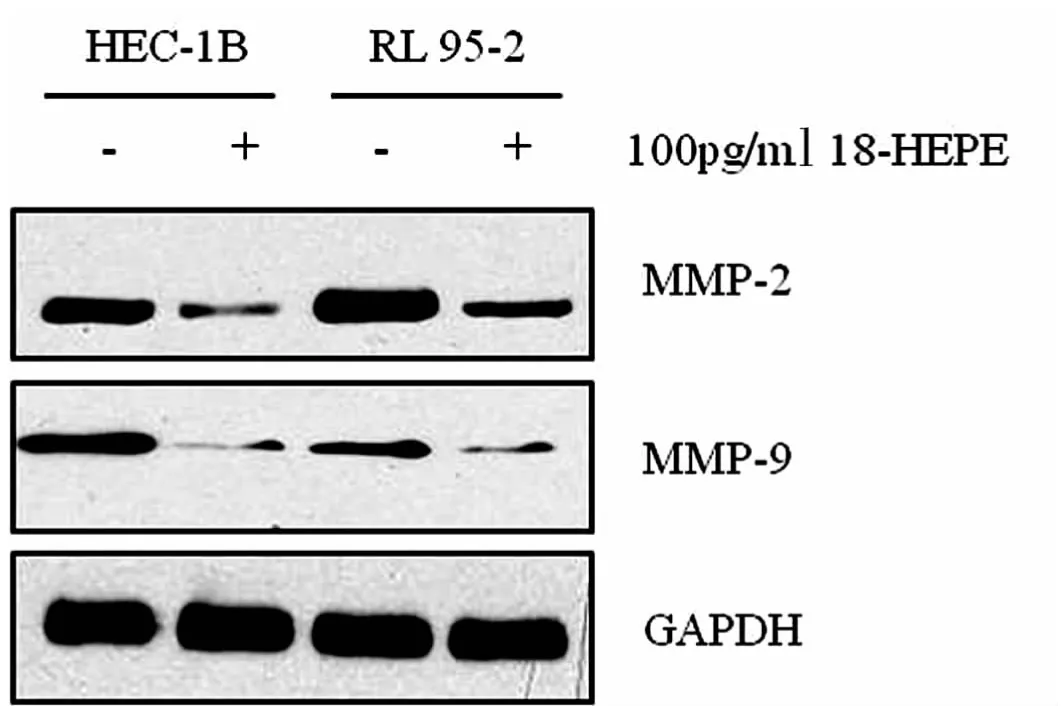
图2 18-HEPE明显抑制EC细胞MMP-2和MMP-9的表达
2.3 18-HEPE抑制EC细胞IL-6的表达 见图3。由于炎性因子在肿瘤侵袭过程中起重要的作用,本研究探讨了18-HEPE 对EC细胞IL-6表达的影响。实时定量PCR实验结果显示,100 pg/ml 18-HEPE能明显抑制HEC-1B和RL 95-2细胞的IL-6表达。
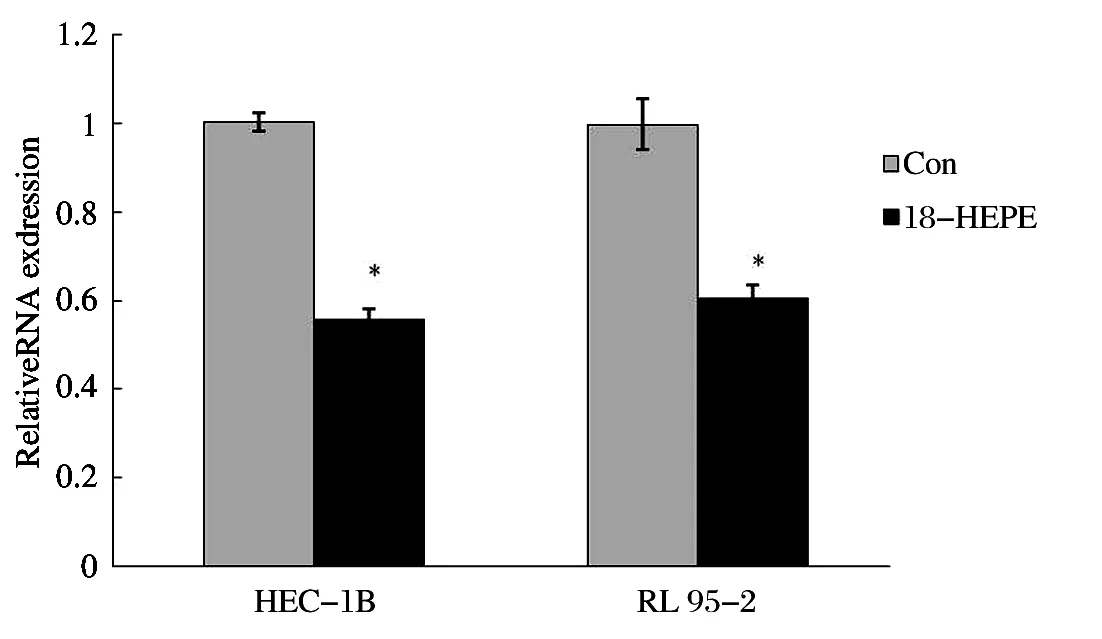
图3 18-HEPE抑制EC细胞IL-6表达(*P<0.05)
2.4 18-HEPE升高EC细胞中PTEN的表达 见图4。由于抑癌基因PTEN缺失或突变在EC的发生发展中是极为重要的分子事件,为了进一步探讨18-HEPE抑制EC细胞侵袭的相关机制,本研究观察了18-HEPE对EC细胞PTEN表达的影响。结果发现,100 pg/ml 18-HEPE处理细胞后能明显上调EC细胞中PTEN的表达。
3 讨论
脂类代谢参与调节细胞的生长、增殖、分化等多种生命活动,细胞膜中脂肪酸代谢的改变(尤其是PUFAs)影响细胞的结构、功能、细胞的氧化状态以及信号通路,从而改变细胞的特性,与肿瘤、心血管疾病和糖尿病等慢性疾病的发生发展密切相关[3,8]。Omega-3 PUFAs主要包括α-亚麻酸(α-Linolenic acid, ALA)、二十碳五烯酸(Eicosapentaenoic acid, EPA)和二十二碳六烯酸(Docosahexaenoic acid, DHA),ALA主要来源于核桃、亚麻子和菜籽等植物油,而EPA和DHA主要来源于深海鱼油;omega-6 PUFAs主要包括亚油酸和花生四烯酸,主要存在于玉米油、葵花子油和红花油中[9]。Omega-3 PUFAs和omega-6 PUFAs在生物体内的代谢是一个复杂的过程,在体内有各自的代谢途径,但在相同的代谢步骤中所需的酶为同一酶系,存在着代谢竞争抑制,omega-3 PUFAs和omega-6 PUFAs相互影响机体合成类廿碳烷酸化合物的速度;omega-6 PUFAs的代谢产物具有强炎性作用,而omega-3 PUFAs的代谢产物具有低炎性作用或者具有强抗炎作用;在机体内,omega-3 PUFAs拮抗omega-6 PUFAs的生理功能,以维持其体内平衡[1]。Omega-3 PUFAs可以通过直接结合其机体细胞中的受体或者通过其衍生物、代谢产物影响机体细胞的特性,还可以通过降低机体局部组织的炎性水平改变肿瘤发生发展的微环境,从而影响肿瘤的发生发展、侵袭转移等多个环节,对肿瘤的防治具有重要意义[6,10-11]。
EC是一种常见的女性生殖系统肿瘤,近年来,我国的EC发病率逐年升高,居女性生殖系统肿瘤第二位[12]。流行病学研究表明,多摄入鱼或EPA/DHA明显降低EC发生率[13-16]。Omega-3与omega-6 PUFAs比值也与EC风险负相关[13]。小鼠接种EC细胞后,与用低omega-3 /omega-6 PUFAs比值饮食喂养的小鼠相比,用高omega-3/omega-6 PUFAs比值饮食喂养的小鼠的癌细胞中mTOR和AKT表达明显降低[17]。细胞实验结果表明,DHA可以通过抑制mTORC1/2信号通路抑制EC细胞的增殖、迁移及诱导EC细胞凋亡,还可以抑制他莫西芬诱导的子宫内膜生长[18]。这些研究都显示,omega-3 PUFAs可以抑制EC的发生发展。但是目前还没有有关omega-3 PUFAs与EC侵袭的研究报道。
本研究表明,EPA衍生物18-HEPE能抑制EC细胞的侵袭相关基因MMP-2,MMP-9的表达以及炎性因子IL-6分泌,从而抑制其侵袭。肿瘤组织局部微环境中的炎性反应对肿瘤的侵袭有着重要作用。研究表明,IL-6可以诱导其下游基因(如:Cyclin D1和MMP-2等)表达,参与雌激素介导的EC生长与侵袭[19]。雌激素能促进EC细胞合成分泌IL-6,分泌的IL-6上调局部组织中基质细胞芳香化酶的表达,进而增强局部组织的雌激素生物合成,这种正反馈机制在EC的发生发展中起到至关重要的作用[20]。这些结果表明,18-HEPE可以通过多种环节影响EC细胞的侵袭。在EC的发生发展机制中,PTEN的突变或者缺失是常见和非常重要的分子事件,PTEN可以通过PIP3-AKT信号通路抑制细胞的生长增殖、黏附侵袭和转移;PTEN还可以通过AKT信号通路抑制NFkB活性,进一步抑制下游炎性基因的表达,从而影响局部组织的炎性反应[21-22]。我们的研究表明,18-HEPE可以上调EC细胞中PTEN的表达。EC细胞中PTEN表达升高可能抑制肿瘤侵袭相关基因MMP-2和MMP-9的表达以及炎症因子IL-6的表达。至于18-HEPE如何上调EC细胞中PTEN的表达需要进一步研究。
采用fat-1转基因小鼠模型研究表明,18-HEPE可以下调肝组织TNF-α水平,抑制肝脏的炎症,从而抑制肝脏肿瘤的发生[23]。我们以前的研究表明,18-HEPE可以直接抑制黑色素瘤细胞CXCR4的表达和炎性反应水平,从而抑制其肺转移[5]。这些研究都表明,18-HEPE在预防肿瘤的发生发展中具有重要作用,是一种重要的omega-3 PUFAs衍生物,将有广阔的临床应用前景。

