双条杉天牛不同虫期体壁碳氢化合物变化规律分析
张时雨,张苏芳,刘 福,马深成,贾春燕,申卫星,张 真,孔祥波*
(1. 中国林业科学研究院森林生态环境与保护研究所,国家林业和草原局森林保护学重点实验室,北京 100091;2. 山东省泰安市泰山风景名胜区管理委员会,山东 泰安 271000)
双条杉天牛(Semanotus bifasciatus Motschulsky)是东亚特有的鞘翅目害虫,广泛分布于中国东北、华北、西北和华东等地区以及朝鲜、韩国和日本等国家。主要危害侧柏(Platycladus orientalis (L.)Franco)、桧柏(Sabina chinensis (L.) Ant. )和罗汉 松 ( Podocarpus macrophyllus ( Thunb.) D.Don)等树种,尤其对我国北方地区的侧柏林构成重大威胁[1]。双条杉天牛成虫倾向于在衰弱树或新伐倒木树皮翘裂缝深处产卵,幼虫可在韧皮部和木质部蛀成不规则坑道,切断和破坏寄主的输导组织,影响养分的运输最终导致寄主死亡[2]。由于幼虫在树皮下隐蔽危害,化学药剂防控困难,目前主要的防治手段是饵木诱杀,虽有效果但耗时耗力、不可持续。
昆虫表皮碳氢化合物是昆虫表皮蜡质层中的主要成分,大多为碳数在20~50、直链或支链、饱和或不饱和的烃类化合物[3]。表皮碳氢化合物在昆虫生存中扮演着重要的角色,能够起到防止水分散失,避免机械擦伤,隔离微生物和化学物质的屏障作用[4-5],同时也能作为昆虫化学分类特征[6-7]。此外,其也能介导物种和性别识别,是雌雄交配信号传递的基础[8-10],在昆虫生殖行为中扮演重要的角色。昆虫体壁碳氢化合物的组成受到多种因素的影响,包括性别、龄期、性成熟度以及社会性昆虫的多态性[11]。Sano等[12]发现铺道蚁(Tetramorium caespitum L.)体壁碳氢化合物中C15~C31之间的单甲基支链烷烃含量为45%~56%、正烷烃含量为16%~40%、烷烯烃含量为10%~20%,相对丰度具有特异性的甲基支链烷烃和烷烯烃在识别同种种群和防止非同巢穴蚁群侵入方面具有信号识别作用。Balbuena等[13]发现无刺蜂(Tetragonisca angustula Latreille)负责守卫的工蜂体壁碳氢化合物中的甲基支链烷烃的相对丰度比巢内工蜂及负责觅食的工蜂高很多,行为试验说明体壁碳氢化合物在种姓识别方面具有重要作用。我们在室内进行双条杉天牛交配行为试验,发现只有在雄虫触角接触到雌虫鞘翅体壁后,才能立即发生交尾行为,这说明体壁碳氢化合物可作为接触性识别信息素在雌雄成虫交配过程中发挥重要作用。本研究对双条杉天牛老熟幼虫、刚羽化的成虫和扬飞期成虫体壁碳氢化合物进行分析,探讨体壁碳氢化合物成分在不同性成熟度的虫期中的变化规律,为进一步研究其在生殖行为中的功能奠定基础。
1 材料与方法
1.1 双条杉天牛的采集
2017年3月上旬在山东省泰安市泰山灵岩寺林区(36°21′46.95″N,116°58′32.29″E)侧柏饵木堆中采集双条杉天牛成虫,此时达到性成熟的成虫被饵木诱集并交配繁殖。雌虫和雄虫分别单独装入4 mL离心管中,带回实验室进行体壁碳氢化合物提取。同时将双条杉天牛已经在其中产卵的饵木截成50 cm左右的木段运回实验室,置于养虫笼内于10月中旬劈开饵木收集老熟幼虫,12月上旬劈开饵木收集羽化不久的成虫进行体壁碳氢化合物的提取。
1.2 化学试剂
十一甲基二十五烷烃(11Me-C25,CAS:5689-71-1)、十一甲基二十六烷烃(11Me-C26,CAS:68547-06-8)和十一甲基二十七烷烃(11Me-C27,CAS:15689-68-6)(纯度≥ 98%)标准品均购自Chemtech MD 公司(8035 Paphos,Cyprus)。C8~C40混合碳标及单一碳标C22和C29(纯度≥99%)均购自美国AccuStandard公司(New Haven,Connecticut,USA)。
1.3 表皮碳氢化合物的提取
1.3.1 固相微萃取法(SPME) 使用Supelco70-μm Carbowax/divinylbenzene(CAR/DVB)纤维头(573360U,Yellow-Green,Supelco Inc.,Bellefonte,PA)提取3月份林间扬飞期采集的雌成虫(n=5)、雄成虫(n=5),饵木木质部刚羽化的雌成虫(n=4)、雄成虫(n=4头)及饵木木质部中的老熟幼虫(n=4)体壁碳氢化合物成分。用镊子夹住试虫,用纤维头单向轻缓地摩擦试虫鞘翅表面30次,每两次摩擦之间均旋转纤维头。取样结束后立即将纤维头进GC-MS进行体壁碳氢化合物成分分析。
1.3.2 溶剂浸提法 使用移液枪取1 mL分析纯正己烷淋洗双条杉天牛扬飞期雌成虫(n=5)和雄成虫(n=5)及木质部中刚羽化的雌成虫(n=6)和雄成虫(n=5)体壁,每头成虫淋洗6次(共计6 mL淋洗液),提取成虫体壁碳氢化合物。用4 mL色谱纯正己烷浸泡双条杉天牛幼虫(n=8)3 min,提取幼虫体壁碳氢化合物成分。成虫体壁淋洗液及幼虫浸提液在微弱的氮气流下浓缩至2 mL,放入-20℃冰箱中保存以备GC-MS分析。
1.4 GC-MS分析
固相微萃取法和溶剂提取法提取的样品以及标准品均在Finnigan Trace DSQ气相色谱-质谱联用仪上分析。气相色谱分析条件:进样口和传输线温度均为220 ℃,氦气为载气(流速1.0 mL·min-1),HP-5MS 毛细管色谱柱(30 m×0.25 mm i.d. × 0.25 μm膜厚,J&W Scientific,Folsom,CA,USA)。色谱升温程序:60 ℃保持1 min,10 ℃·min-1升温至300 ℃,保持10 min。质谱分析条件为:在灯丝电流70 eV的电子轰击源(EI)模式下,离子源温度为220℃。全扫描质量范围是41~560 amu,以获取总离子流色谱图(TIC)进行定性定量分析。固相微萃取CAR/DVB纤维头插入进样口,在无分流模式下热解析1 min,然后开始运行色谱程序。
体壁碳氢化合物的定性鉴定是通过与标准品比较色谱保留时间、特征碎片离子及丰度比以及使用Kováts保留指数和NIST11谱库进行辅助鉴定。体壁碳氢化合物各色谱峰定量方法是与加入的已知含量的C22峰面积进行比较,确定各成分的绝对含量。
1.5 统计分析
C8~C40混合碳标进行GC-MS分析,记录各烷烃的保留时间,根据下面公式对分析样品的Kováts保留指数值进行计算[14]。

“N”和“n”表示分析样品色谱峰前后正烷烃色谱峰具有的碳原子数量,“tR(N)”和“tR(n)”表示分析样品前后正烷烃标准品色谱峰的保留时间,“tR(unknown)”表示待鉴定样品色谱峰保留时间。
SPME分析获得的百分含量数据经过arcsin√p转化后进行单因素方差分析(ANOVA),采用LSD法对处理间平均数进行差异显著性检验(α=0.05和α=0.01,SPSS Statistics17.0)。绝对含量数据进行非参数检验(Nonparametric tests),对同一成分在不同虫期含量数据采用Kruskal-Walls检验分析,组间差异显著的成分再进一步进行两两比较(α=0.05 和 α=0.01,SPSS Statistics17.0)。
2 结果与分析
2.1 SPME提取的双条杉天牛3个虫期体壁碳氢化合物分析
固相微萃取法提取双条杉天牛3个虫期体壁碳氢化合物分析结果表明,体壁碳氢化合物成分主要由正烷烃、烷烯烃和甲基支链烷烃构成(图1,表1)。幼虫体壁碳氢化合物中n-C27、n-C25和角鲨烯(squalene)含量较高,三者占总碳氢化合物含量的61.75%;其次为3Me-C25和n-C29,含量占25.90%。在个别幼虫体壁碳氢化合物中检测出n-C15和n-C16成分,在全部幼虫体壁中未检测出11Me-C25、11Me-C26、11Me-C27和 3Me-C27成分。刚羽化的成虫体壁碳氢化合物中n-C25和n-C27含量较高,未检测到3Me-C27、n-C31和角鲨烯成分,雄成虫比雌成虫多n-C15、n-C16和n-C19,其他成分雌雄一致且3Me-C25、11Me-C27和n-C28在雌雄体壁碳氢化合物中差异显著。扬飞期雌雄成虫体壁碳氢化合物成分一致,n-C25含量最高,其次是 n-C26和 3Me-C25。另外,11Me-C25、3Me-C25、11Me-C26、11,15diMe-C27和n-C285种成分在雌雄成虫体壁中的相对百分含量差异显著。27

图 1 固相微萃取提取双条杉天牛老熟幼虫体壁碳氢化合物的总离子流色谱图Fig. 1 Total ion chromatogram of the cuticular hydrocarbonssampled by SPME from mature larvae of Semanotus bifasciatus
碳氢化合物成分n-C23、n-C24和3Me-C27仅在扬飞期雌雄成虫体壁中检测到,且在雌雄两性成虫中相对含量差异不显著。n-C25在3个虫期体壁中相对百分含量均最高,相互间差异不显著。n-C26在扬飞期雌雄成虫体壁中的含量极显著高于幼虫和刚羽化的雌雄两性成虫(F=33.77,P=0.001)。n-C在3个虫期体壁碳氢化合物中相对百分含量呈下降趋势,且扬飞期雌雄成虫相对百分含量极显著低于幼虫和刚羽化的雌雄成虫(F=9.66,P=0.001)。n-C28在3个虫期中相对百分含量均较低,刚羽化的雌成虫体壁中的含量显著高于其他虫期(F=12.78,P=0.02)。n-C29在幼虫体壁中的含量极显著高于刚羽化的雌雄成虫体壁中的含量(F=42.49,P=0.01),但是在扬飞期雌雄成虫中未检测到该成分。n-C31仅在幼虫体壁碳氢化合物中检测到。
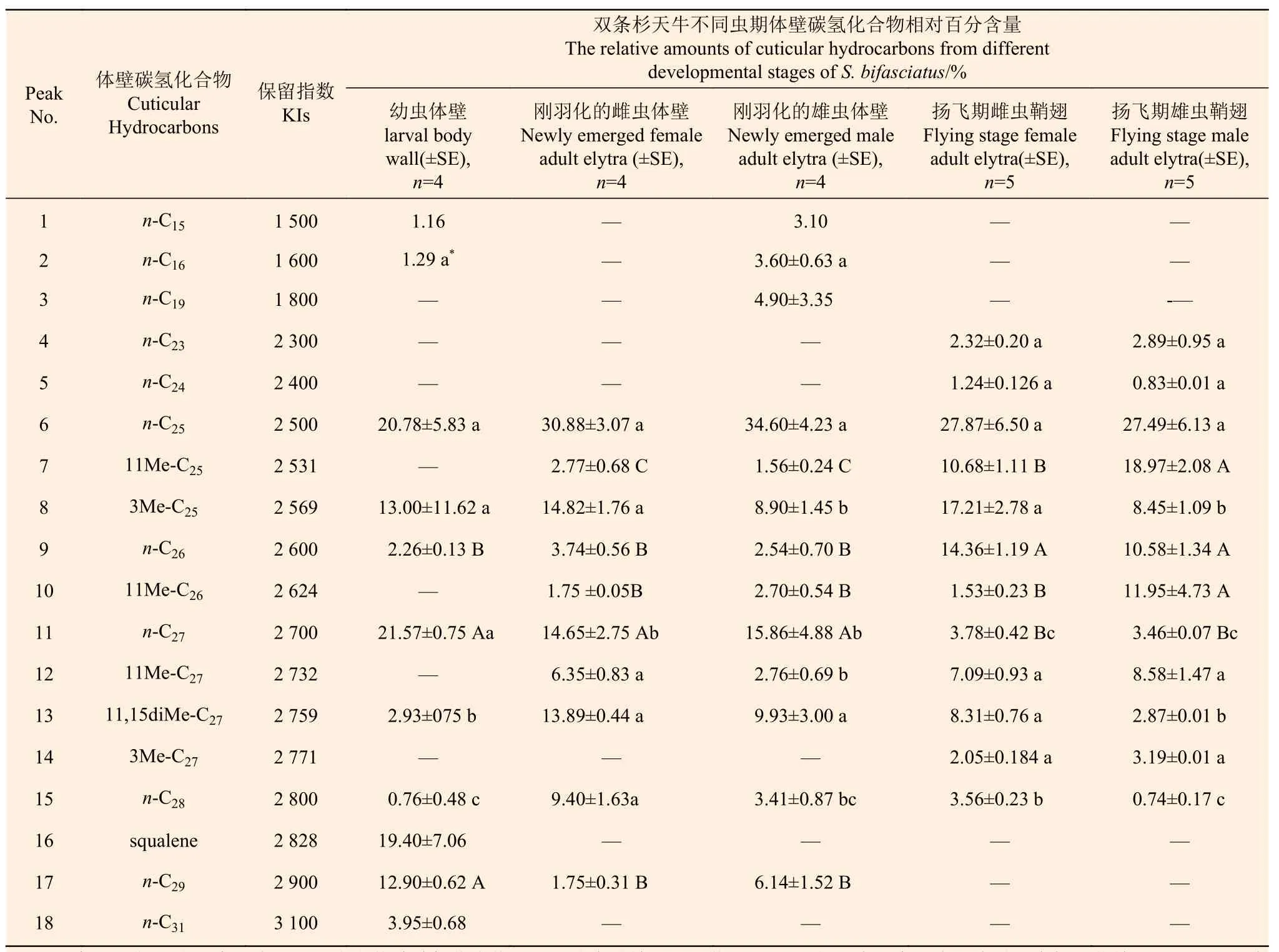
表 1 双条杉天牛不同虫期固相微萃取法提取的体壁碳氢化合物的GC-MS分析结果Table 1 Cuticular hydrocarbons analyzed by SPME-GC-MS from different developmental stages of Semanotus bifasciatus
体壁碳氢化合物中11Me-C25的含量随虫体的发育呈现增长,在扬飞期雌雄两性中占比极显著高于刚羽化的雌雄两性(F=57.32,P=0.001),且在扬飞期雄性成虫体壁中的占比极显著高于雌性(F=12.86,P=0.016)。11Me-C26在扬飞期雄成虫体壁碳氢化合物中的占比高达11.95%,而在其他虫期中该成分的占比仅在1.5%~3.0%之间,极显著高于其他虫期体壁碳氢化合物中的占比(F=56.65,P=0.001)。11Me-C27在扬飞期雌雄两性成虫及刚羽化的雌虫体壁碳氢化合物中所占比例相近且差异不显著,但是显著高于刚羽化的雄成虫(F=6.69,P=0.009)。3Me-C25在雌成虫体壁碳氢化合物中占比显著高于雄成虫(F=5.90,P=0.045)。3Me-C27在扬飞期雌雄两性成虫体壁碳氢化合物中占比差异不显著。11,15diMe-C27在幼虫与扬飞期雄成虫之间占比差异不显著(P>0.05),在刚羽化的雌雄成虫及扬飞期的雌成虫之间差异也不显著。该成分在扬飞期雌雄成虫体壁碳氢化合物相对含量间差异显著(F=12.78,P=0.023)。
2.2 溶剂浸提法提取的3个虫期体壁碳氢化合物分析
幼虫体壁碳氢化合物中n-C31(1.44 ng)是成虫所不具有的,这与SPME分析结果一致;但是没有检测到角鲨烯,这与SPME分析结果相反。在幼虫体壁碳氢化合物中未检测到C15~C24的正烷烃及11Me-C26、11Me-C27和3Me-C27的甲基支链烷烃。刚羽化的雌雄成虫体壁碳氢化合物成分基本一致,且雌雄间含量差异不显著;n-C15和n-C16仅在刚羽化的雄成虫体壁中存在,而n-C18在刚羽化的雌雄成虫体壁中均检测到。在扬飞期性成熟的雌雄成虫体壁碳氢化合物成分一致,但是11Me-C26(χ2=4.50,P=0.034)、11Me-C27(χ2=6.00,P=0.034)、11,15diMe-C27(χ2=5.06,P=0.023)和3Me-C27(χ2=4.50,P=0.034)在雌性成虫体壁中的含量均显著高于雄性成虫体壁中的含量;n-C23、11Me-C26和3Me-C27在幼虫和刚羽化的雌雄成虫体壁中未检测到,在扬飞期雌雄成虫体壁碳氢化合物中含量介于2~13 ng之间。其他成分含量雌雄个体间虽然没有统计差异(例如,3Me-C25,χ2=3.76,P=0.053),但是雌性个体体壁碳氢化合物含量均高于雄性个体(n-C23和n-C24除外)(表2)。

表 2 双条杉天牛不同虫期溶剂浸提法提取的体壁碳氢化合物GC-MS分析结果Table 2 Cuticular hydrocarbons analyzed by hexane extract-GC-MS from different developmental stages of Semanotus bifasciatus
n-C24在雌雄成虫间差异不显著(χ2=6.60,P=0.086),但是刚羽化的雌雄成虫体壁中的含量均低于扬飞期雌雄成虫体壁中的含量。n-C25在幼虫体壁中含量显著低于刚羽化的雌虫(χ2=8.817,P=0.003)、扬飞期雌虫(χ2=6.00,P=0.014)和扬飞期雄虫(χ2=4.50,P=0.034)体壁中的含量;相反n-C27在幼虫体壁中含量显著高于刚羽化的雌虫(χ2=9.60,P=0.002)、雄虫(χ2=7.39,P=0.007);以及扬飞期的雌虫(χ2=8.595,P=0.003)和雄虫(χ2=6.00,P=0.014)体壁中的含量。n-C26在幼虫和刚羽化的雌雄成虫体壁中含量差异不显著,均在2~3 ng之间,而在扬飞期雌雄两性成虫体壁中该成分的含量显著增高(χ2=6.00,P=0.014),达到30~60 ng。n-C28在3个虫期的体壁碳氢化合物中均被检测到,含量在1.5~6.5 ng之间,且各虫期间差异不显著。n-C29在扬飞期成虫体壁中未被发现,在幼虫体壁中的含量显著高于刚羽化的雌雄两性成虫(χ2=2.40,P=0.012)。
11Me-C25在扬飞期雌雄两性成虫体壁碳氢化合物中的含量显著高于刚羽化的雌雄成虫及幼虫。3Me-C25在3个虫期体壁碳氢化合物中含量差异显著(幼虫期:刚羽化成虫期,χ2=9.60,P=0.002;刚羽化成虫:扬飞期成虫,χ2=7.50,P=0.006),且含量随着天牛的发育明显增多,由幼虫期的5.79 ng增长到扬飞期雌性成虫中的67.27 ng。11Me-C27在扬飞期雌性成虫体壁中的含量显著高于刚羽化的雌雄两性成虫和扬飞期雄性成虫体壁中的含量(χ2=6.00,P=0.014),且随着雌雄成虫的发育呈现增长趋势。11,15diMe-C27在幼虫、未成熟两性成虫和成熟雄性体壁中的含量差异不显著,但在扬飞期雌性成虫体壁中的含量显著增高(χ2=7.53,P=0.006)。3Me-C27在扬飞期雌成虫体壁中的含量显著高于雄成虫体壁中的含量(χ2=4.50,P=0.034)。
3 讨论
昆虫体壁碳氢化合物既具有保护昆虫的物理功能,又具有种内化学信息交流和种间物种识别等生物学功能,其种类组成及含量可随着发育阶段的变化而变化。例如,点蜂缘蝽(Riptortus pedestris Fabricius)不同发育阶段体壁碳氢化合物主要成分由27%~63%的正烷烃构成,其次是单甲基支链烷烃和二甲基支链烷烃。若虫期主要碳氢化合物成分是n-C29;刚羽化的成虫主要成分是n-C27,也含有很多甲基支链烷烃;成虫期主要成分是n-C31、n-C27、13,17diMe-C33和 15,19diMe-C33[15]。天牛科昆虫雌雄生殖交流的化学信号多为体壁碳氢化合物中的甲基支链烷烃或者烯烃以及少数正烷烃。例如,厚垫黄带蜂天牛(Megacyllene caryae Gahan)的接触性信息素成分是Z9-C29[16],而南美硬木锯天牛(Mallodon dasystomus Say)的接触性信息素成分是2Me-C26和2Me-C28[17],这2种天牛雌雄体壁碳氢化合物成分及含量均有很大差异。作为介导雌雄识别的化学信号通常是由多种碳氢化合物组成,有的起主导作用,有的起增效作用。例如,黑腹尼虎天牛(Neoclytus acuminatus acuminatus Fabricius)雌成虫具有6种甲基支链的烷烃是雄成虫所不具有的,其中7Me-C27、7Me-C25和9Me-C27占其体壁碳氢化合物总量的40%左右,7Me-C27单独使用就能激起雄成虫的交尾行为,而与7Me-C25和9Me-C27共同使用具有与雌成虫相同的生物活性[18]。
本研究明确了双条杉天牛老熟幼虫、刚羽化的成虫及扬飞期成虫3个发育阶段虫体体壁碳氢化合物的组成及变化规律。不同虫期双条杉天牛体壁碳氢化合物成分主要包括C15~C31之间的正烷烃、5种单甲基支链烷烃和1种二甲基支链烷烃。扬飞期成虫雌雄体壁成分没有质的差异,但是4种甲基支链烷烃在雌虫体壁中含量显著高于雄虫。刚羽化的雌雄成虫体壁碳氢化合物成分没有质和量的差异。n-C23、n-C24、n-C25、11Me-C25、3Me-C25、n-C26、11Me-C26和3Me-C27在双条杉天牛体壁中的含量随着虫龄的增加而显著增高,而n-C15、n-C16、n-C29和n-C31正烷烃含量减少直至消失,体壁碳氢化合物种类及含量随着发育时间的变化而变化可能与不同虫态代谢差异有关[19],同时这几种物质的变化也可能与双条杉天牛发育成熟后物种信息识别和种群繁衍等生物功能相关。双条杉天牛幼虫和扬飞期成虫体壁碳氢化合物比较分析发现,幼虫体壁碳氢化合物中不含有11Me-C26、11Me-C27和3Me-C27;幼虫不具有交配行为,这3种成分的缺失可能意味着其在成虫生殖行为中扮演着重要的生物学功能。11Me-C26、11Me-C27和3Me-C27这3种成分的绝对含量在扬飞期雌雄两性成虫中差异显著,可能暗示着雄成虫是根据这3种成分量的差异来鉴别异性从而顺利完成交配行为。另外,11Me-C25、3Me-C25和11,15diMe-C27在雌雄两性成虫体壁碳氢化合物中的占比差异显著,也不排除其参与雌雄两性配偶识别。一种或多种组分在一定比例下可能作为双条杉天牛的接触性识别信息素或增效剂介导性识别,在将来的研究中需要对双条杉天牛的接触性信息素的存在与否进行验证,并对接触性信息素的具体比例开展进一步研究。
昆虫体壁碳氢化合物既可以作为种间物种鉴别的重要特征,又可以探讨不同地理种群之间的差异,甚至在亲代养育中也发挥重要作用。随着昆虫发育阶段的不同,体壁碳氢化合物处在动态变化的过程中。部分成分随着虫体发育含量显著上升,但是占比不变或者下降,部分成分在同时期雌雄两性间含量和占比差异显著;特别是幼虫和成虫相比体壁碳氢化合物成分及含量存在很大差异。成虫期体壁碳氢化合物稳定,作为种类鉴别特征更具有代表性,而幼虫期体壁碳氢化合物不适合作为种类鉴定的特有特征。在物种鉴别方面,尽管黑山大小蠹(Dendroctonus ponderosae Hopkings)和光背大小蠹(D. jeffreyi Hopkins)体壁碳氢化合物基本一致,但是3,7-二甲基烷烃能够很好的区分这两个近缘种。瘤额大小蠹(D. frontalis Zim.),其特征体壁碳氢化合物是3,X-二甲基二十九烷烃,而西松大小蠹(D. brevicomis LeConte)的特征体壁碳氢化合物是C31~C35的正烷烃。寄主和地理差异没有从本质上改变瘤额大小蠹体壁碳氢化合物的差异,且雌雄虫体壁碳氢化合物也没有质和量的差异[6]。台湾乳白蚁(Coptotermes formosanus Shiraki)4个地理种群工蚁和兵蚁体壁碳氢化合物没有质的差异,但是工蚁7种碳氢化合物含量差异、兵蚁3种碳氢化合物含量差异能够区分不同地理种群,而种群内部不同个体间这几种成分含量差异很小[20]。双条杉天牛体壁碳氢化合物是否存在不同地理种群间的差异,以及与其他天牛种类之间特征体壁碳氢化合物的异同,我们将在今后的工作中开展进一步研究。
4 结论
本研究通过气相色谱-质谱联用仪对3个虫期的双条杉天牛体壁碳氢化合物进行分析,发现不同虫期的双条杉天牛的体壁碳氢化合物存在显著差异。幼虫体壁碳氢化合物主要以C15~C31正烷烃为主,甲基支链烷烃种类和含量较少。随着虫龄的增长和成虫羽化后时间的推移,体壁碳氢化合物中甲基支链烷烃的含量显著增加,而正烷烃在体壁碳氢化合物中的占比呈下降趋势。这对双条杉天牛种间、种内化学信号识别机制研究奠定基础。

