辛二酰苯胺异羟肟酸联合索拉菲尼对人肝癌细胞增殖和凋亡的影响*
蔡爽,韩冰,郑璐,汤雷,马子华,陈雨丝,杨婷,杨勤,谢汝佳
(贵州医科大学 贵州省常见慢性疾病发病机制及药物研究重点实验室 病理生理学教研室,贵州 贵阳 550025)
肝癌是世界上第六大常见癌症,每年约有84.1万新病例和78.2万人死亡[1]。肝癌恶性程度高,复发率高,容易侵袭转移,且大多数患者确诊时已处于中晚期阶段,不适合手术、肝移植或局部消融等治疗方法[2-3],因此非手术治疗在肝癌的治疗中占有重要地位。索拉菲尼(sorafenib,SOR)是美国FDA批准用于晚期肝癌治疗的分子靶向药物[4-5],研究表明,SOR可以通过抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)的表达、从而阻断肿瘤血管生成[6-7];此外,SOR还具有抗丝氨酸(Ser)/苏氨酸(Thr)激酶Raf的活性,从而抑制肿瘤细胞的增殖和信号转导[8]。尽管SOR在临床肝癌的治疗中取得了一定的突破和进展,但总体效果并不十分满意。因此,如何提高SOR的临床疗效成为迫切需要解决的难题。近年来有研究报道,辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA),一种用于临床血液系统恶性肿瘤治疗的新型抗癌药物与SOR联合应用时可显著增强SOR对肝癌细胞增殖的抑制作用,但其具体的作用机制还有待进一步阐明。本研究旨在观察SAHA联合SOR对人肝癌细胞增殖和凋亡的影响,并初步探讨HepG2细胞中葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、蛋白激酶样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)、磷酸化PERK(p-PERK)、及活化转录因子4(activating transcription factor 4,ATF4)蛋白表达的分子机制,为临床肝癌的治疗提供新的实验依据。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2购自中国科学院典型培养物保藏中心上海细胞库(KCB 200507YJ),索拉菲尼由贵州医科大学附属医院肛肠外科詹玮博士惠赠,SAHA购自英国Abcam公司,胎牛血清购自美国ScienCell公司,DMEM培养基购自美国Gibco公司,胰酶购自Biological Industry,彩虹 Marker购自上海爱必信生物科技有限公司,BCA蛋白定量试剂盒和AnnexinV-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物技术有限公司,兔抗GAPDH、兔抗GRP78、兔抗PERK、兔抗ATF4购自英国Abcam公司。
1.2 方法
1.2.1细胞培养 人肝癌细胞株HepG2用含10%胎牛血清,1%双抗(青霉素和链霉素)的DMEM培养基进行培养,培养皿置于37 ℃、5% CO2及饱和湿度的培养箱中,2~3 d换1次液,细胞密度85% 时以1 ∶2传代。本实验所使用细胞均处于对数生长期。
1.2.2细胞活力检测 采用MTT法取对数生长期的HepG2细胞,以104个/孔密度接种于96孔板,放置于37 ℃、5% CO2的培养箱中培养;待细胞贴壁后,分别加入不同浓度的SOR(0.5、1、3、6、12、25、50 μmol/L)、SAHA(0.5、1、3、6、12、25、50 μmol/L)及同剂量的SAHA 联合SOR(剂量同前)处理细胞,同时设置阴性对照组和空白对照组,每个浓度均设5个复孔,继续培养48 h后,每孔加入5 g/L MTT 20 μL培养4 h,小心吸去上清液,加入二甲基亚砜(DMSO)150 μL ,置于摇床上低速震荡10 min 、在酶联免疫检测仪490 nm处测定各孔的吸光度值(OD),计算各组细胞存活率并绘制生长曲线。存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3细胞凋亡 采用流式细胞术检测,随机将对数生长期的HepG2细胞分为对照(control)组、SOR组(12 μmol/L)、SAHA组(6 μmol/L)及SAHA联合SOR组(6 μmol/L+12 μmol/L)。给药48 h后,使用不含EDTA的胰酶消化收集各组细胞,2 000 r/min离心5 min后弃上清,加入的binding buffer液500 μL悬浮细胞,再加入5 μL annexin V-FITC和5 μL碘化丙啶(PI),充分混匀,室温避光反应15 min后用流式细胞仪进行检测。
1.2.4GRP78、PERK、p-PERK及ATF4蛋白水平 采用Western blot法检测,收集各组细胞,用蛋白裂解液提取细胞中的总蛋白,BCA 蛋白定量试剂盒进行蛋白定量。取40 μg总蛋白上样,经10% SDS-PAGE凝胶电泳分离蛋白后,湿转蛋白至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉封闭90 min,加入相应 I 抗,4 ℃ 孵育过夜。第2天用TBST洗膜3次后加入Ⅱ抗,室温孵育90 min,TBST洗膜后ECL发光成像,Bio-Rad凝胶成像仪系统获取图像。用Image Lab图像分析软件对每个条带进行定量分析。
1.3 统计学处理

2 结果
2.1 SAHA联合SOR对HepG2细胞增殖的抑制作用
MTT法结果显示,与对照组比较,不同浓度的SAHA和SOR均能明显抑制HepG2细胞的增殖,且SAHA或SOR对HepG2的抑制作用呈明显的剂量依赖性。与单独的SAHA和SOR组比较,SAHA联合SOR对HepG2细胞增殖的抑制作用更为显著,差异具有统计学意义(P<0.01),见图1。根据MTT结果,后续实验中选择6 μmol/L SAHA、12 μmol/L SOR及6 μmol/L SAHA联合12 μmol/L SOR处理HepG2细胞进行后续实验。

注:(1)与control比较,P<0.01;(2)与SAHA组比较,P<0.01 ;(3)与SOR组比较,P<0.01。图1 SAHA、SOR及两药联合对HepG2细胞存活率的影响Fig.1 Effect of SAHA,SOR and two drugs on survival rate of HepG2 cells
2.2 SAHA联合SOR对HepG2细胞凋亡的影响
流式细胞术检测各组细胞凋亡发现,6 μmol/L SAHA 、12 μmol/L SOR及两药联合均能明显诱导HepG2细胞发生凋亡。6 μmol/L SAHA处理HepG2细胞48 h后的凋亡率为(10.85±0.86)%,12 μmol/L SOR处理HepG2细胞48 h后的凋亡率为(13.57±1.12)%,SAHA联合SOR处理HepG2细胞48 h后的凋亡率为(23.20±1.06)%;上述3组细胞凋亡率均显著高于对照组,其中以联合用药组凋亡率最高,与SOR和SAHA单药组比较,差异有统计学意义(P<0.01)。见图2。
2.3 HepG2细胞中GRP78、PERK、p-PERK及ATF4蛋白表达
与对照组比较,SAHA和SOR单药组可在一定程度上调HepG2细胞GRP78、p-PERK、ATF4蛋白的表达,两药联合上述效应更加显著,差异统计学意义(P<0.05)。而SAHA、SOR及两药联合对PERK蛋白的表达无明显影响,差异无统计学意义(P>0.05)。见图3。
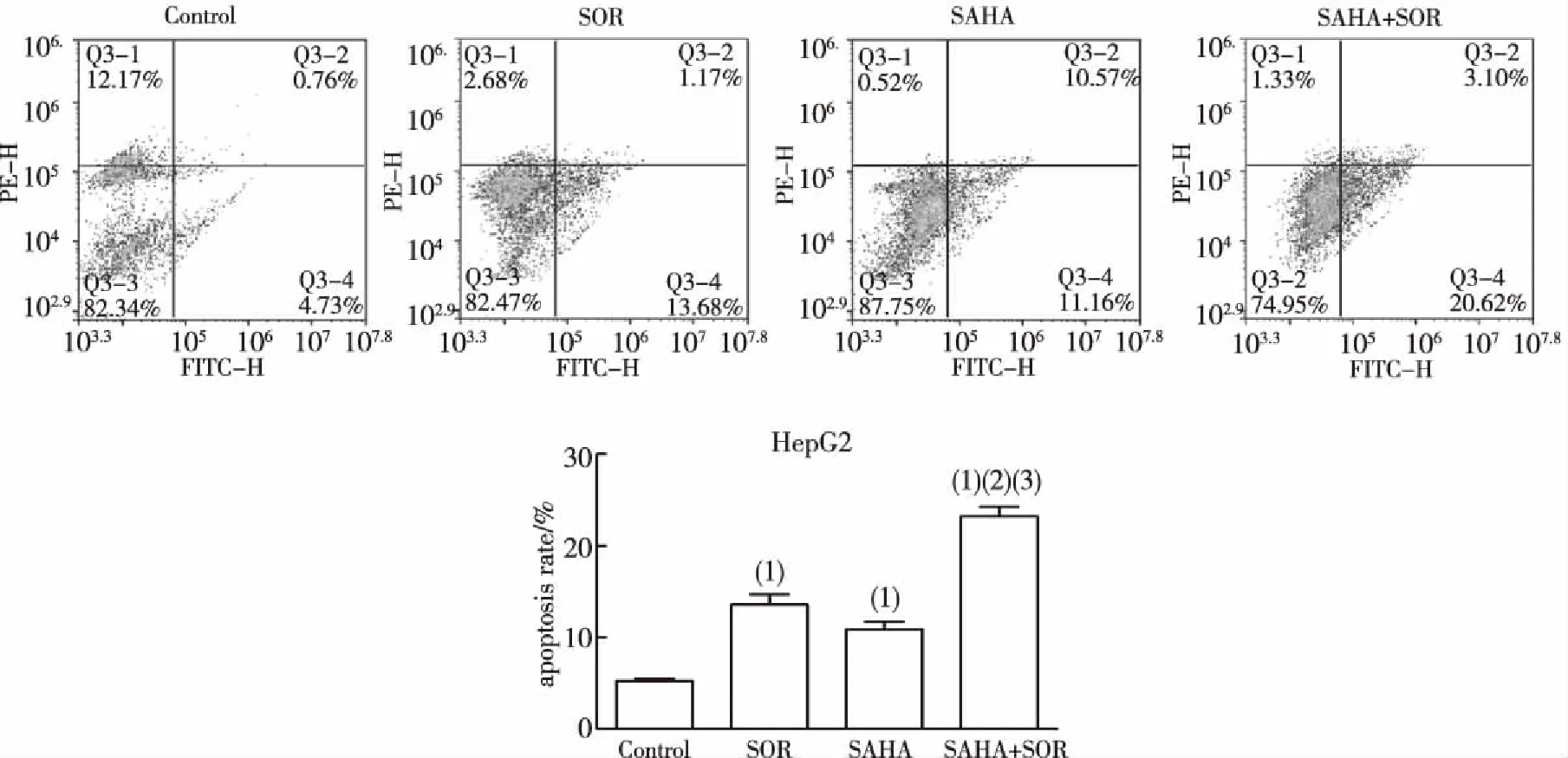
注:(1)与control组比较,P<0.01;(2)与SAHA组比较,P<0.01 ;(3)与SOR组比较,P<0.01。图2 SOR、SAHA及两药联合对HepG2细胞凋亡的影响Fig.2 Effects of SOR,SAHA and two drugs on apoptosis of HepG2 cells

注:(1)与control组比较,P<0.05 ;(2)与SAHA组比较,P<0.05 ;(3)与SOR组比较,P<0.05。图3 SOR、SAHA及两药联合对HepG2细胞中GRP78、PERK、p-PERK及ATF4蛋白表达的影响(Western blot)Fig.3 Effects of SOR,SAHA and two drugs on the expression of GRP78,PERK,p-PERK and ATF4 in HepG2 cells(Western blot)
3 讨论
SOR是一种多靶点口服抗肿瘤药物,也是一种多激酶抑制剂,因其对肾细胞癌和肝细胞癌的疗效,在临床上,已被批准用于治疗晚期肾细胞癌和肝细胞癌[4-5]。SOR具有双重的抗肿瘤作用,一方面它可通过阻断由RAF/MEK/ERK介导的细胞信号传导通路而直接抑制肿瘤细胞的增殖[8-9];另一方面它还可通过抑制VEGFR和PDGFR而阻断肿瘤新生血管的形成,从而间接地抑制肿瘤细胞的生长[6-7]。虽然SOR为临床肝癌的治疗打开了一扇希望之窗,但总体效果并不十分令人满意,因此,如何提高SOR的临床疗效成为迫切需要解决的难题。近年来Yuan H[10]的研究发现,SAHA与SOR联合应用时可显著抑制体外培养肝癌细胞的增殖。本次研究结果也证实了SAHA与SOR联合应用能够显著抑制人肝癌细胞HepG2的增殖,表明两药具有协同效应,因此,两药联合可能为临床上治疗肝癌提供更优的治疗效果。
SAHA是一种广谱组蛋白去乙酰化酶抑制剂,有研究表明,它可通过抑制细胞周期进程、诱导细胞凋亡和分化从而抑制肝癌细胞的生长[11]。课题组前期研究发现SAHA可以激活内质网应激(endoplasmic reticulum stress,ERS)凋亡通路从而诱导HepG2细胞发生凋亡[12]。内质网(endoplasmic reticulum,ER)是真核细胞中重要的细胞器,几乎所有分泌型蛋白(包括膜结合蛋白)都在ER中产生。ER不仅参与了蛋白质的合成和折叠,还参与了钙平衡的调节以及胆固醇和类固醇等脂质的生物合成,以此来调节细胞稳态[13]。而当这些过程受到多种生理性或病理性因素的干扰时,会导致未折叠或错误折叠蛋白质在ER中积累,最终导致ER稳态失去平衡,引发ERS。在ERS条件下,细胞能够激活未折叠蛋白反应(unfolded protein response,UPR),通过一系列信号转导途径以减轻或终止ERS,从而恢复细胞内环境稳态。然而,当刺激因素持续时间过长或强度过大时,UPR也可激活细胞凋亡通路导致细胞死亡[14-15]。ERS介导的细胞凋亡在很多肿瘤的发生、发展中具有重要意义。因此,通过激活ERS凋亡通路促使肿瘤细胞发生凋亡,有望成为肿瘤治疗的新靶点[16-17]。
当前的研究报道可知,UPR信号转导过程主要由以下3种内质网跨膜效应蛋白所启动:活化转录因子6(activating transcription factor 6,ATF6)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)和PERK[14]。正常情况下ATF6、IRE1和PERK与内质网分子伴侣GRP78紧密结合,从而处于无活性状态。发生ERS时,由于内质网腔中积累的未折叠或错误折叠蛋白与GRP78竞争结合,导致GRP78与3种跨膜蛋白发生解离。解离后的PERK、IRE1和ATF6通过各自的途径被激活,例如,与GRP78解离后的PERK可通过自身二聚化和磷酸化被激活,并进一步促进其下游的ATF4及CCAAT/增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)的表达,从而诱导细胞凋亡的发生[18]。在本次研究中,流式细胞术检测结果表明两药联合能显著促进HepG2细胞凋亡,说明两药联合不仅能抑制肝癌细胞的增殖,同时还促进了肝癌细胞的凋亡。进一步通过Western blot检测发现SAHA组和SOR组的GRP78、p-PERK和ATF4表达均较对照组显著上调,说明SAHA、SOR均可通过激活ERS凋亡信号通路促进肝癌细胞凋亡;而SAHA联合SOR能进一步促进上述蛋白的表达,提示ERS凋亡通路可能是SAHA增强SOR促进肝癌细胞凋亡的靶点之一,其机制可能是经SAHA和SOR联合处理肝癌细胞后,通过阻断蛋白质从内质网到高尔基体的运输,诱导了高水平的ERS,从而激活了PERK-ATF4信号通路,启动细胞凋亡信号。
综上所述,SAHA和SOR能够协同增强对肝癌细胞HepG2的增殖抑制作用,且能显著诱导肝癌细胞的凋亡,其协同作用可能与激活ERS凋亡通路有关。
——疾病防治的新靶标

