折溪‘小黄姜’内生细菌初步鉴定
刘青 李悦欣 赵德刚 赵懿琛

摘 要: 为了解贵州省折溪‘小黄姜中内生菌资源,采用涂布法从折溪‘小黄姜中分离、纯化出内生细菌,通过形态学特征结合分子生物学手段确定其分类地位。结果表明,从折溪‘小黄姜中共分离出5株不同的内生菌,命名为GrsB1、GrsB2、GrsB3、GrsB4、GrsB5,其中GrsB1属于芽孢杆菌科、微小杆菌属(Exiguobacterium),其他4株菌属于肠杆菌科,分别属于拉乌尔菌属(Raoultella)、肠杆菌属(Enterobacter)、埃希氏菌属(Escherichia)、沙雷氏菌属(Serratia),肠杆菌科数量最多。虽然分离出的内生菌数量较少,但菌株种属分布范围较大,可以为小黄姜内生菌资源的进一步研究提供理论基础。
关键词: 小黄姜; 内生细菌; 分离; 鉴定
Abstract: In this study, In order to understand the endophyte resources of ‘Small yellow ginger (Zingiber officinale Roscoe) in Zhexi, Guizhou province, a coating method was used to isolate and purify endogenous bacteria from ‘Small yellow ginger , and its classification status was determined by morphological characteristics combined with molecular biological methods. The results showed that five endophytes were isolated from ‘Small yellow ginger, named Grsb1, Grsb2, Grsb3, Grsb4 and Grsb5, Grsb1 belongs to Bacillus , Exiguobacterium. The other four strains belong to raoultella, enterobacter, Escherichia and Serratia in Enterobacteriaceae respectively, the largest number of Enterobacteriaceae. The number of endophytes isolated in this study is small, but the distribution of strains is large, which can provide theoretical basis for further research on the endophyte resources of ‘Small yellow ginger.
植物內生菌是指其生活史的一定阶段或全部阶段生活在健康植物各种组织器官内部或组织间隙中的微生物[1]。Bacon等[2]研究发现,食用有内生菌的高羊茅会使牛、羊中毒,此后,对植物内生菌的研究才引起人们的高度重视。目前在已报道的各种农作物以及经济作物中发现的植物内生细菌已经超过129种,分别属于54个属,主要为假单胞菌属 (Pseudomonas)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、土壤杆菌属 (Agrobacterium)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)、甲基杆菌属(Methylobacterium)等[3]。用于内生菌研究的植物主要是药用植物[4]、经济作物[5-6]、瓜果[7-8]等,研究发现,内生细菌不仅能促进宿主植物的生长,增强宿主植物对环境变化的适应性[9-11],还对植物病原菌有较好的抑制作用[12-13]。
《中药大辞典》记载,姜是重要的药食同源植物,具有消炎、散热、解毒等功效,研究发现姜中含有的姜精油、姜辣素及黄酮类化合物等化学成分具有抗氧化、抗肿瘤、降血糖等作用[14],还由于其独特的辛辣气味而作为调料品广泛应用于食物调味,具有重要的医用价值和经济价值。折溪‘小黄姜(Zingiber officinale Roscoe)是六盘水折溪乡经过长期栽培选育出的优良栽培种,属于姜科姜属姜种。2000年经中科院地理科学与资源研究所鉴定,折溪‘小黄姜为高品质生姜,其姜油含量为0.72%,姜辣素含量为2.85%,有机硒为1.20 mg·kg-1,其中姜油和姜辣素含量分别是国内其他品种姜的2~3倍[15]。目前对小黄姜的研究主要是栽培技术[16-17]和有效成分提取[18],对内生菌的研究比较少。楚敏等[19]从生姜中分离得到23株内生细菌,分为5个属,周宁[20]从新鲜姜块中分离得到47株内生菌,并且发现内生菌对姜瘟病具有一定的抑制作用,但是关于折溪‘小黄姜内生菌资源的研究未见报道。笔者以贵州省六盘水市六枝特区折溪乡‘小黄姜为材料,对其内生菌进行分离、鉴定,为折溪乡‘小黄姜内生菌资源的进一步研究提供理论依据。
1 材料与方法
1.1 材料
试验材料为取自贵州省六盘水市六枝特区折溪乡的折溪‘小黄姜,折溪乡地处东经105°10'~105°15',北纬26°05'~26°11',海拔581~2 900 m,年平均气温和年平均降雨量适合小黄姜生长。试验于2018年10月在贵州大学农业生物工程研究院进行。
1.2 方法
1.2.1 内生细菌的分离 用水将材料表面的泥沙冲洗干净,置于阴凉处自然晾干。把姜组织块切成0.5 cm×0.5 cm的小块,用0.1%多菌灵溶液浸泡5 min,流水冲洗2 h,分别对其进行编号。在超净台进行表面消毒,先用75%的酒精震荡消毒5~7 min,无菌水冲洗3次,再用0.1%升汞消毒5 min,无菌水冲洗3次,用无菌吸水纸吸干水分,放在超净台自然晾干。取100 μL最后一次冲洗的无菌水涂布在LB培养基上,设置3次重复,37 ℃倒置培养3 d,观察平板上是否有菌落出现,若没有则说明组织块表面消毒彻底,后续试验中分离得到的细菌均为内生细菌。
将表面消毒的组织块用无菌刀片去皮后切成碎块,放在无菌研钵中,用无菌的石英砂和质量分数为0.85%的氯化钠溶液充分研磨,用移液枪吸取1 mL上清液进行10倍梯度稀释,稀释后的溶液各取100 μL涂布于LB平板上,30 ℃倒置培养2~3 d。待其长出菌落后,挑取不同形态的菌落分别涂布在新的LB平板上,反复纯化,直到整个平板上菌落的形态完全一致并出现单菌落。挑取单菌落,37 ℃,180 r·min-1过夜摇菌,25%甘油保存。
1.2.2 内生细菌的形态特征与革兰氏染色 将纯化得到的菌株在LB培养基上划板,37 ℃培养12 h,观察并登记单菌落的形态、质地、边缘、颜色、透明度。挑取单菌落革兰氏染色后,在100倍油镜下观察染色情况。
1.2.3 扫描电镜(SEM)观察 参照胡春辉等[21]的方法,将冷冻干燥后的样品进行离子溅射喷金处理后,用扫描电子显微镜拍照。
1.2.4 小黄姜内生细菌16S rRNA扩增及分子鉴定 挑取单菌落在LB液体培养基中37 ℃、180 r·min-1摇床过夜培养,离心收集菌体,用细菌基因组DNA快速抽提试剂盒进行DNA提取。以细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACCTTGTTACGACTT-3')进行16S rRNA序列扩增。PCR扩增体系(10 μL):Premix Taq(Takara Taq)5 μL;引物27F(10 μmol·L-1)和1492R (10 μmol·L-1)各0.3 μL;基因组DNA 1 μL ;无菌ddH2O 3.4 μL。扩增条件:94 ℃预变性3 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸2 min;共30个循环,72 ℃延伸5 min;4 ℃保存,扩增结束后用1%琼脂糖凝膠电泳检测扩增产物。将扩出目的条带的对应模板用高保真酶(Invitrogen)进行扩增,扩增体系(20 μL):包括10× High Fidelity PCR Buffer 2 μL;50 mmol·L-1 MgSO4 0.8 μL;10 mmol·L-1 dNTP 0.4 μL;引物27F(10 μmol·L-1)和1492R (10 μmol·L-1)各0.4 μL;Hatinum Taq 0.08 μL;基因组DNA 1 μL;无菌ddH2O 14.92 μL。扩增条件:94 ℃预变性2 min,94 ℃变性15 s,55 ℃退火30 s;68 ℃延伸2 min;共30个循环,68 ℃延伸5 min;4 ℃保存。PCR产物采用Cycle-Pure Kit(D6492-01)(omega)试剂盒进行纯化,步骤参照说明书。
纯化后的产物送至华大科技(广州)测序,测序结果使用Seqman软件进行序列拼接,在NCBI中进行同源序列比对,用软件MEGA 7.0采用Neighbor-Joining法构建系统发育进化树,初步对细菌进行分子鉴定。
2 结果与分析
2.1 内生细菌的分离与初步鉴定
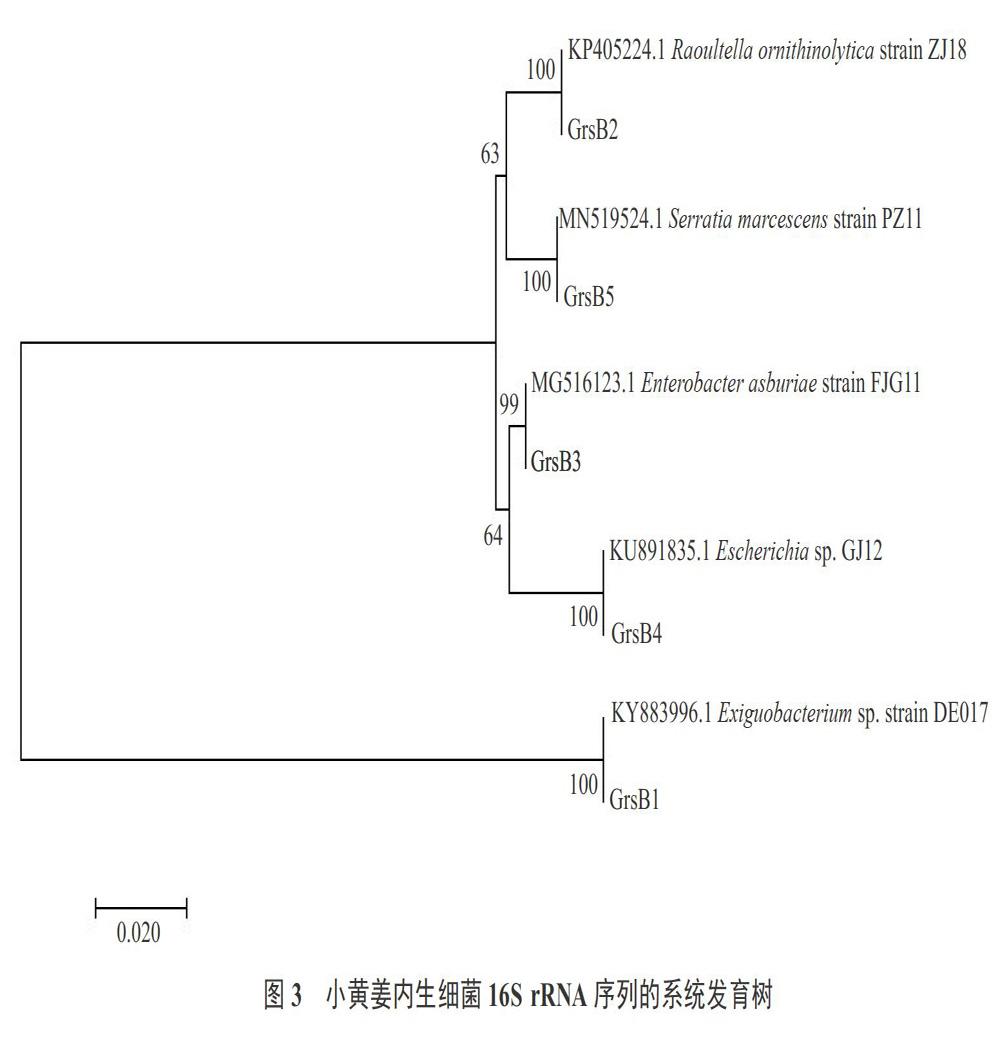
通过革兰氏染色结果可以看出,染色后GrsB1菌体呈紫色,GrsB2、GrsB3、GrsB4、GrsB5菌体均呈红色,因此可以判定GrsB1为阳性菌,其他4株菌均为阴性菌。将分离的菌株在LB固体培养基上划板,37 ℃过夜培养后观察其形态特征,发现5株菌菌落均为圆形,边缘规则,菌落表面湿润,有光泽,GrsB2和GrsB3无色素产生,其他3种有色素,其中GrsB1初培养时菌落表面为淡黄色,随着培养时间的加长,慢慢变为金黄色;GrsB4为淡黄色;GrsB5开始为乳白色,随着培养时间的延长菌落中间变为红色。形态特征见表1。
2.2 小黄姜内生细菌基因组DNA提取与16S rRNA序列扩增
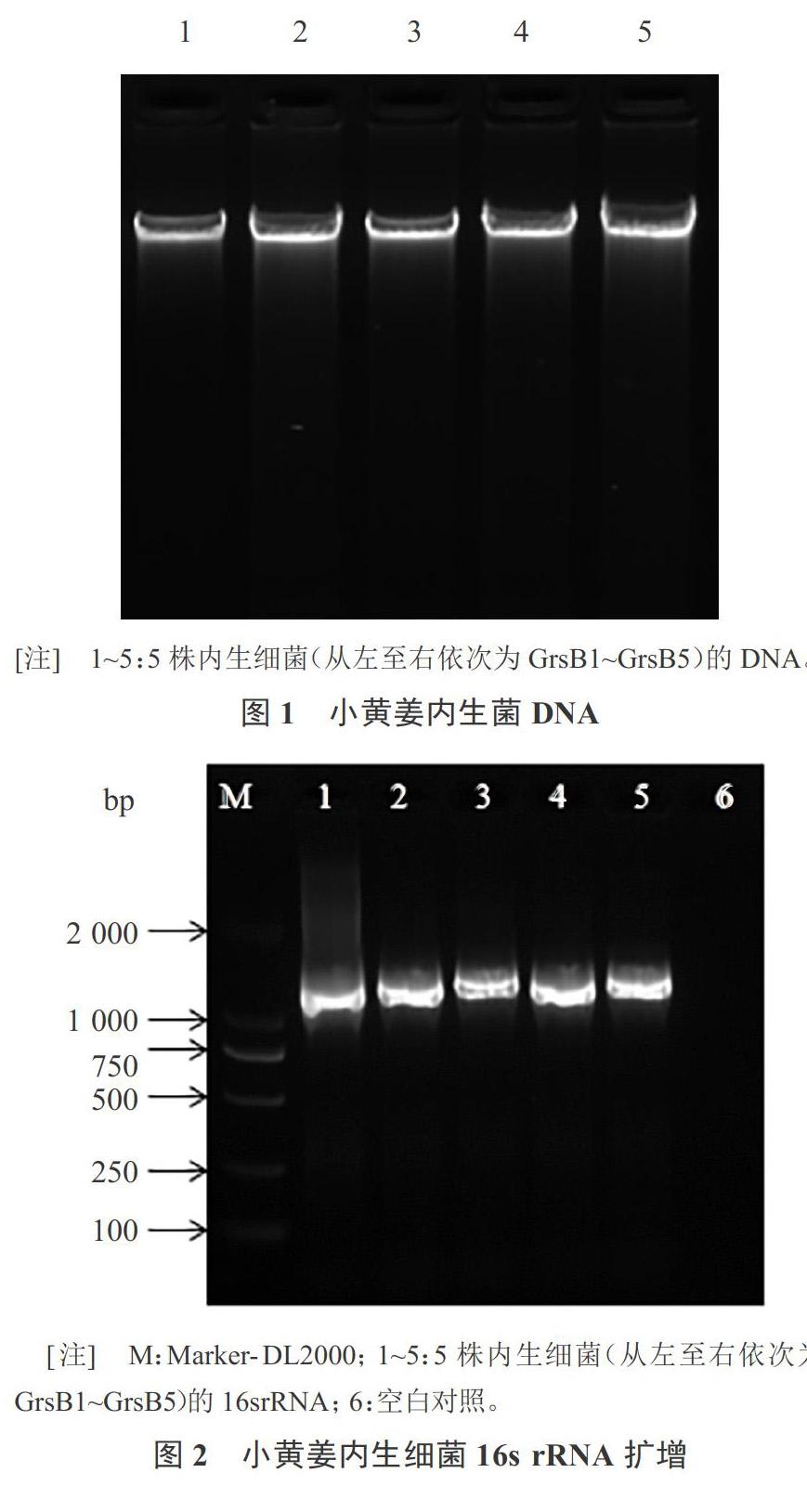
5株菌株均提取出高质量的DNA(图1),以该DNA为模板进行PCR扩增,扩增产物用1%的琼脂糖凝胶进行电泳检测,均扩增出1 500 bp左右的条带(图2),扩增效果较好。
2.3 小黄姜内生细菌16s rRNA序列分析
将测序结果用Blast软件进行比对分析,找出相似度最高的序列作为同源序列(表2),并构建系统发育树(图3)。小黄姜内生菌16S rRNA序列测序比对,结果发现5株菌的16S rRNA与GENEBACK中已知16S rRNA序列最高相似性均在99%以上,其中3株菌的相似度为100%,说明这5株内生菌均为已知菌(表2)。分析发现,5株菌属于2个科5个属,GrsB1属于芽孢杆菌科,GrsB2、GrsB3、GrsB4、GrsB5属于肠杆菌科,数量最多是优势菌株,5株菌分别属于微小杆菌属(Exiguobacterium)、拉乌尔菌属(Raoultella)、肠杆菌属(Enterobacter)、埃希氏菌属(Escherichia)、沙雷氏菌属(Serratia)。从系统发育树可以看出5株菌聚为两个大类,GrsB1属于阳性菌,单独聚为一支,其余4株菌属于阴性菌聚为一支。5株菌都单独聚为一支,说明其遗传关系较近。
3 讨 论
笔者选取贵州省六盘水六枝特区折溪乡‘小黄姜为试验材料,通过严格的消毒过程,从材料组织块中分离得到5株内生细菌,通过形态学鉴定与16s rRNA序列分析,初步鉴定5株内生菌属于2个科5个属,1个属于芽孢杆菌科,微小杆菌属(Exiguobacterium),4个属于肠杆菌科,分别属于拉乌尔菌属(Raoultella)、肠杆菌属(Enterobacter)、埃希氏菌属(Escherichia)、沙雷氏菌属(Serratia),笔者分离得到的5株内生菌中肠杆菌科的最多,这与Rohini S[9]的研究结果一致。笔者在分离内生菌过程中以最后冲洗姜块的无菌水为阴性对照,并未培养出任何细菌,说明操作过程严谨,消毒彻底,分离出的细菌均为内生细菌。本试验所用的培养基为培养细菌的LB培养基,因此只分离出‘小黄姜中的内生细菌,周宁[20]从大姜中分离出的内生菌,除了大量的内生细菌外还包括少量的放线菌和内生真菌,因此后续研究会使用多种培养基,以期将放线菌和内生真菌分离出来,丰富该材料内生菌资源。楚敏[19]从生姜中分离的内生细菌包括了5个属8个种,与本研究的结果有差异,差异的原因可能是本试验与后者使用材料的品种、产地、培养基均不同所导致的,另外,折溪乡‘小黄姜所含的姜精油、姜辣素均高于普通生姜,姜辣素与姜精油都有一定的抑菌效果,对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌等有不同程度的抑制作用[22],这可能也是本次试验中分离得到的内生细菌较少的原因。
贵州省六枝特区种植大量‘小黄姜,但是由于连作和无性繁殖等原因,‘小黄姜体内积累大量的病毒病菌,影响其品质和口感[23]。廖震[24]利用sRNA 高通量序技术对贵州省六盘水市折溪乡的小黄姜进行了病毒预测,首次在小黄姜中发现一个杆状DNA病毒属的新病毒,命名为小黄姜杆状病毒(Zingiber bacilliform virus,ZBV) 。因此,内生菌对‘小黄姜病原菌的抑制作用也是接下来重要的研究方向。芽孢杆菌属在生防菌中有非常大的应用前景[25-26],傅俊范等[27]从土壤中分离出一株枯草芽孢杆菌,对人参锈腐病有较好的抑制作用,未见微小杆菌对植物病原菌抑菌作用的报道,但其对蓝藻具有促生作用[28],还能够降解农药残留,修复环境污染[29]。陈政[30]的研究表明,肠杆菌属能够抑制姜瘟病病原菌的生长,陈涛[31]发现肠杆菌属是生姜内生菌的优势菌株。粘质沙雷氏菌产生的次生代谢物灵菌红素对烟草花叶病毒具有抑制作用,还能诱导寄主植物产生系统抗性(ISR)[32]。因此,笔者后续将针对分离的内生菌对‘小黄姜的致病菌的抑制作用展开研究,以期找到‘小黄姜的优良生防菌株。
另一方面,‘小黄姜是典型的药食同源植物,内生菌与宿主植物共生,能够产生与宿主植物相同的药效[33-35],有文献报道粘质沙雷氏菌产生的灵菌红素对癌细胞有抑制作用[36]。因此后续试验可对内生菌的活性成分进行研究,以期找到对人类健康有益的内生菌。
综上所述,笔者从折溪乡‘小黄姜中分离得到5种内生细菌,属于2个科5个属,数量不多,但其所分离菌株的种属分布范围较大,为后期拮抗菌株的筛选和活性成分研究奠定了良好的理論基础。
参考文献
[1] CHI EUN H C,UK K J,WOO L J,et al.Diversity of bacterial endophytes in Panax ginseng and their protective effects against pathogens[J].Biotech,2018,8(9):1-7.
[2] BACON C W,PORTER J K,ROBBINS J D,et al.Epichlo? typhina from toxic tall fescue grasses[J].Applied & Environmental Microbiology,1977,34(5):576-81.
[3] 方珍娟,张晓霞,马立安,植物内生菌研究进展[J].长江大学学报(自然科学版),2018,15(10):41-45.
[4] 黄磊,高燕燕,许才万,等.药用植物内生菌的多样性及其活性代谢产物功能研究进展[J].贵州林业科技,2019,47(3):59-64.
[5] 夏雨晨,朱永兴,马东方,等.小麦赤霉病菌拮抗菌的分离及鉴定[J].江西农业大学学报,2019,41(1):33-42.
[6] 徐亚军,李珂,刘珂珂,等.大豆根瘤内生菌全细胞可溶性蛋白SDS-PAGE电泳图谱分析[J].食品研究与开发,2019,40(11):159-165.
[7] 金卫华,胡伟,唐红枫.樱树内生菌代谢产物的抗氧化活性研究[J].化学与生物工程,2019,36(10):31-34.
[8] 龙楚媚,付强,王琪,等.罗汉果内生菌的分离及α-淀粉酶抑制剂产生菌的筛选[J].中国酿造,2019,38(1):71-74.
[9] ROHINI S,ASWANI R,KANNAN M,et al.Culturable endophytic bacteria of ginger rhizome and their remarkable multi-trait plant growth-promoting features[J].Current Microbiology,2018,75(4):505-511.
[10] YUAN Z S,LIU F,XIE B G,et al.The growth-promoting effects of endophytic bacteria on Phyllostachys edulis[J].Archives of Microbiology,2018,200(6):921-927.
[11] PURUSHOTHAM N,JONES E,MONK J,et al.Community structure of endophytic actinobacteria in a New Zealand native medicinal plant Pseudowintera colorata (Horopito) and their influence on plant growth[J].Microbial Ecology,2018,76(3):729-740.
[12] 侯晓杰.姜蒜汁液及其可培养内生菌对苹果腐烂病的拮抗筛选研究[J].北方园艺,2014(10):116-119.
[13] 王霞,薛林贵,张晓华,等.菘蓝内生细菌的分离、筛选和鉴定[J].生物技术通报,2018,34(3):163-169.
[14] 吴嘉斓,王笑园,王坤立,等.生姜营养价值及药理作用研究进展[J].食品工业,2019,40(2):237-240.
[15] 周维群.六盘水市生姜产业发展现状及对策[J].耕作与栽培,2008(4):5-6.
[16] 吴芹,张显兵.小黄姜高产栽培技术[J].现代农业科技,2019(18):55.
[17] 李正祥,张天虎,奎志芳.弥渡县小黄姜无公害绿色栽培技术[J].云南农业科技,2018(2):40-42.
[18] 杨瀚,白雪飞,杨娇,等.罗平小黄姜中6-姜辣素含量测定的方法学研究[J].云南中医中药杂志,2019,40(9):65-67.
[19] 楚敏,张志东,王玮,等.生姜内生菌多样性及微生物拮抗作用的初步研究[J].新疆农业科学,2011,48(11):2061-2066.
[20] 周宁.大姜根际及内生益生菌的分离筛选与应用研究[D].济南:齐鲁工业大学,2017.
[21] 胡春辉,徐青,孙璇,等.几种典型扫描电镜生物样本制备[J].湖北农业科学,2016,55(20):5389-5392.
[22] 赵晋.生姜姜辣素的提取及其功能性质研究[D].重庆:西南大学,2008.
[23] 李晋华.小黄姜(Zingiber officainale Rosc.)人工种子技术研究[J].贵阳:贵州大学,2018.
[24] 廖震.利用sRNA序列检测分析小黄姜(Zingiber officainale Rosc.)病毒[D].貴阳:贵州大学,2017.
[25] 周先治,张青文,林营志,等.Bs-8093菌株的鉴定及其对青枯雷尔氏菌的致弱作用[C]//中国植物保护学会.科技创新与绿色植保——中国植物保护学会2006学术年会论文集.2006-10,中国云南昆明:中国农业科学技术出版社,2006:750.
[26] HOBLEY L, OSTROWSKI A,RAO F V,et al.BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm[J].Proceedings of the National Academy of Sciences,2013,110(33):13600-13605.
[27] 傅俊范,史会岩,周如军,等.人参锈腐病生防细菌的分离筛选与鉴定[J].吉林农业大学学报,2010,32(2):136-139.
[28] 史亚萍,张宏,郭道森,等.一种促进蓝藻生长的海洋细菌的分离与鉴定[J].青岛大学学报(工程技术版),2010,25(2):41-46.
[29] 闫艳春,曲杰,史延华,等.乙酰微小杆菌L31及其应用:北京,CN102181386A[P].中国.2011-09-14.
[30] 陈政.连作生姜根际土壤微生物群落结构分析[D].山东泰安:山东农业大学,2013.
[31] 陈涛.熏蒸剂对姜根际细菌群落结构的影响及姜内生细菌的多样性分析[D].山东泰安:山东农业大学,2013.
[32] 毕建华,杨金广,欧阳明安,等.黏质沙雷氏菌次生代谢物对TMV的抑制机理[J].中国农业科学,2014,47(5):912-922.
[33] 顾晓洁,解卓学,吕嘉东,等.白首乌内生细菌分离鉴定及系统发育树分析[J].辽宁中医药大学学报,2018,20(6):52-56.
[34] 靳锦,赵庆,张晓梅,等.植物内生菌活性代谢产物最新研究进展[J].微生物学杂志,2018,38(3):103-113.
[35] 王丽君,马国财,韩爱芝,等.新疆芜菁茎部内生菌的分离鉴定[J].中国瓜菜,2018,31(4):19-23.
[36] 肖丹,杨慧,张冬梅,等.黏质沙雷氏菌灵菌红素对结肠癌细胞的影响[C]//中国畜牧兽医学会动物微生态学分会.中国畜牧兽医学会动物微生态学分会第五届第十三次全国学术研讨会论文集.2018-11,中国广东广州,2018:154.

