补阳还五汤对Cav-1敲除小鼠脑缺血后mTOR通路的影响
陈博威 周胜强 易健 罗琳 刘柏炎 谢勇

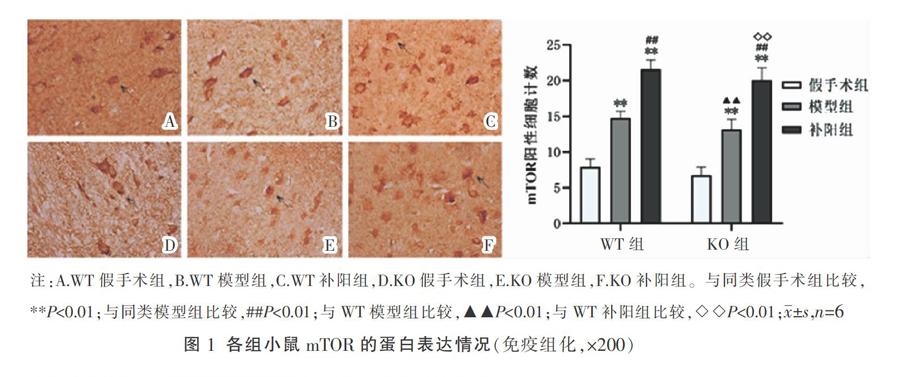
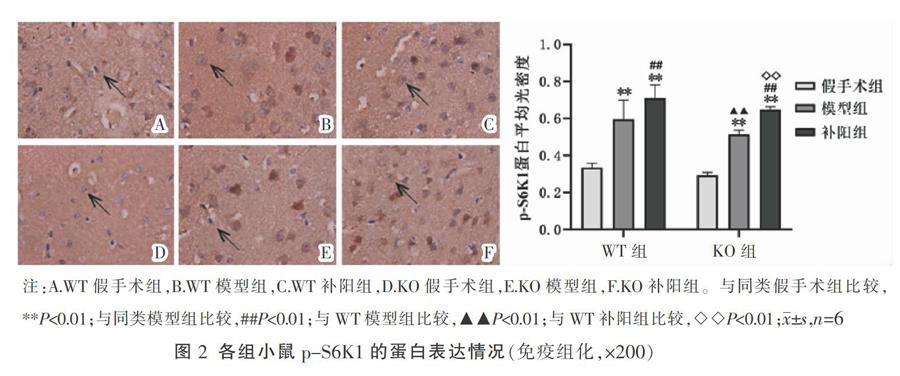
〔摘要〕 目的 探讨小窝蛋白(caveolin-1, Cav-1)对脑缺血后哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路的影响及补阳还五汤抗脑缺血的可能作用机制。方法 将Cav-1基因敲除(knock out, KO)与野生型(wild type, WT)小鼠随机分为KO假手术组、KO模型组、KO补阳还五汤组(补阳组)、WT假手术组、WT模型组及WT补阳组。采用大脑中动脉栓塞法建立脑缺血模型,干预14 d后观察小鼠神经功能评分;免疫组化检测大脑mTOR、磷酸化核糖体S6蛋白激酶(phospho-ribosomal S6 kinase, p-S6K1)、磷酸化真核细胞翻译起始因子4E结合蛋白-1(phospho-eukaryotic initiation factor 4E-binding protein 1, p-4E-BP1)的蛋白表达;qRT-PCR检测大脑mTOR的mRNA水平。结果 与同类假手术组比较,其他4组神经功能评分、mTOR、p-S6K1、p-4E-BP1蛋白表达及mTOR mRNA表达明显上升(P<0.01);与同类模型组比较,KO补阳组、WT补阳组神经功能评分明显下降(P<0.01),各蛋白表达与mRNA表达明显上升(P<0.01);与WT模型组比较,KO模型组神经功能评分上升(P<0.05),各蛋白与mRNA表达明显下降(P<0.01);与WT补阳组比较,KO补阳组神经功能评分明显上升(P<0.01),各蛋白及mRNA明显下降(P<0.01)。结论 Cav-1基因的缺失会导致mTOR通路活性降低并加重脑缺血后神经功能损伤;补阳还五汤可能通过Cav-1调控mTOR信号通路的活性,发挥抗脑缺血损伤的作用。
〔关键词〕 脑缺血;mTOR信号通路;补阳还五汤;Cav-1基因敲除
〔中图分类号〕R285.5;R743.3 〔文献标志码〕A 〔文章編号〕doi:10.3969/j.issn.1674-070X.2020.04.007
Effects of Buyang Huanwu Decoction on mTOR Pathway in Cav-1 Knock Out
Mice after Cerebral Ischemia
CHEN Bowei1, ZHOU Shengqiang2, YI Jian3, LUO Lin1, LIU Baiyan1,4*, XIE Yong5
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The Affiliated Hospital of Hunan Provincial Academy of Traditional Chinese Medicine, Changsha, Hunan 410006, China; 3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 4. Yiyang Medical College, Yiyang, Hunan 413000, China; 5. The Second Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China)
〔Abstract〕 Objective To investigate the effects of caveolin-1 (Cav-1) on mammalian target of rapamycin (mTOR) signaling pathway after cerebral ischemia and the possible mechanism of Buyang Huanwu Decoction (BHD) in anti-cerebral ischemia. Methods Cav-1 knock out mice (KO) and wild type mice (WT) were randomly divided into a KO sham operation group, a KO model group and a KO BHD group, a WT sham operation group, a WT model group, and a WT BHD group. Cerebral ischemia model was established by middle cerebral artery occlusion (MCAO). After 14 days of intervention, the neurological function scores of each group were observed. The protein expression of mTOR, phospho-Ribosomal protein S6 kinase beta-1 (p-S6K1), phospho-eukaryotic initiation factor 4E-binding protein 1 (p-4E-BP1) were detected by immunohistochemical method, and mTOR mRNA was detected by qRT-PCR. Results Compared with the sham group, the neurological function scores, the expression of mTOR, p-S6K1, p-4E-BP1 protein and mTOR mRNA of the other 4 groups were significantly increased (P<0.01). Compared with the similar model group, the neurological function scores of the KO BHD group and the WT BHD group decreased significantly (P<0.01). The expression of each protein and mRNA increased significantly (P<0.01). Compared with the WT model group, the neurological function scores of the KO model group increased (P<0.05), and the expression of each protein and mRNA decreased significantly (P<0.01). Compared with the WT BHD group, the neurological function scores of the KO BHD group increased significantly (P<0.01), and each protein and mRNA decreased significantly (P<0.01). Conclusion The deletion of Cav-1 gene can reduce the activity of mTOR pathway and aggravate the neurological damage after cerebral ischemia; BHD may regulate the activity of mTOR signaling pathway through Cav-1 and play a role in resisting cerebral ischemic injury.
〔Keywords〕 cerebral ischemia; mTOR signaling pathway; Buyang Huanwu Decoction; Cav-1 gene knock out
缺血性脑血管疾病因其高发病率、高死亡率和高致残率给社会、患者家庭及个人带来沉重的痛苦和负担[1]。小窝蛋白(caveolin-1, Cav-1)在脑缺血损伤中具有抑制炎症反应[2]、促进血管新生作用[3],因而改善保护神经。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路是一条能调控细胞生长[4]、蛋白合成及自噬的经典通路[5]。课题组前期研究表明,Cav-1可以通过调控mTOR/失调51样激酶1(uncoordinated 51 like kinase-1, ULK1)通路的活性,抑制脑缺血后半暗带自噬,减轻脑缺血损伤[6]。但是Cav-1是否能在脑缺血后通过mTOR通路调控细胞生长及蛋白质合成来减轻脑损伤,目前还未见报道。补阳还五汤作为治疗缺血性中风气虚血瘀证的经典名方,其疗效已经经过临床证实[7]。本研究以Cav-1基因敲除小鼠作为研究对象,通过观察脑缺血小鼠神经功能评分、mTOR的蛋白与mRNA及其下游效应因子磷酸化核糖体S6蛋白激酶(phospho-ribosomal S6 kinase, p-S6K1)、磷酸化真核细胞翻译起始因子4E結合蛋白-1(phospho-eukaryotic initiation factor 4E-binding protein 1, p-4E-BP1)的蛋白表达,探讨Cav-1对脑缺血后
mTOR通路的影响及补阳还五汤对脑缺血小鼠的疗效机制。
1 材料
1.1 动物
健康雄性Cav-1基因敲除(knock out, KO)小鼠与同源野生型(wild type, WT)C57小鼠,各40只。其中KO小鼠购自美国JacksonLaboratory,批号:2909619,在湖南中医药大学动物中心自行繁衍,均经PCR鉴定为Cav-1基因敲除[8],自由饮水进食,光照规律。
1.2 药物
补阳还五汤按《医林改错》原方组成:黄芪120 g,当归尾6 g,川芎3 g,红花3 g,赤芍4.5 g,桃仁 3 g,地龙3 g,饮片自湖南中医药大学第一附属医院购买。常规煎煮后浓缩至含生药2 g/mL,冷藏备用。
1.3 主要试剂与仪器
mTOR抗体、p-S6K1抗体、p-4E-BP1抗体、SABC-POD试剂盒(武汉博士德公司);TRIzol Reagent(美国Life Technologies公司);RevertAidFirst Strand cDNA合成试剂盒(美国Thermo公司);PCR引物合成(上海生工生物工程公司),引物序列:β-actin-F:5-GCAGATGTGGATCAGCAAGC-3,β-actin-R:5-AGGGTGTAAAACGCAGCTCAG-3,片段长度:102 bp;
mTOR-F:5-GGATGCAGTGGCGACATTTG-3,mTOR-
R:5-TTTCAGCATCGTGGGGTCAG-3,片段长度:79 bp。
EG1150H石蜡包埋机、RM2235切片机(德国莱卡公司);BX71显微镜(日本奥林巴斯公司);PCR扩增仪(美国BioRad公司);核酸水平电泳仪(北京百晶生物技术公司);核酸蛋白浓度测定仪(英国BIO-DROP公司)。
2 方法
2.1 分组造模与干预
将KO小鼠及WT小鼠按照随机数字表法分为KO假手术组、KO模型组、KO补阳还五汤组(补阳组)、WT假手术组、WT模型组及WT补阳组,运用大脑中动脉栓塞法复制脑缺血模型,每组12只。造模方法:将大鼠麻醉后固定,取颈正中切口,游离左侧颈总、颈内、颈外动脉,依次结扎颈总动脉、颈外动脉。于颈总动脉分叉部下方0.2~0.3 cm处剪一小口,将鱼线通过颈总动脉,插入颈内动脉,遇到轻微阻力后停止进线,深度(7.5±0.5) mm,固定鱼线并逐层缝合切口。假手术组仅切开皮肤、分离颈内动脉、颈外动脉后即缝合。术后2 h进行模型评分。参照Longa等[9]报道的5分法进行神经功能评分。分值在1~3分表明造模成功,予以纳入研究。补阳组于术后2 h开始给药,给药剂量为每日18.5 g/kg(按70 kg成人与动物体质量药量折算表换算),模型组和假手术组小鼠均给予等量蒸馏水,每日灌胃1次,持续14 d。
2.2 检测指标
2.2.1 神经功能评分 运用Ayelet Levy 14分评分法评估神经功能[10]。(1)运动试验(正常=0;最大值=3):提住尾巴将大鼠逐渐提高:前肢屈曲计1分,后肢屈曲计1分,30 s内头移动与纵轴形成角度>10°计1分;(2)爬行姿势测试(正常=0;最大值=3):将大鼠置于地面:正常爬行计0分,无法直线爬行计1分,沿患侧转圈计2分,患侧跌倒计3分;(3)梁平衡测试(正常=0;最大值=6):静态姿势下可平衡计0分,抓握梁边计1分,抱住梁,有一肢体掉落计2分,抱住梁,有两肢体掉落,或在梁上旋转(>60 s)计3分,试图在梁上保持平衡但跌落(>40 s)计4分,试图在梁上保持平衡但跌落(>20 s)计5分,跌落且没有试图保持平衡或抓梁(<20 s)计6分;(4)反射缺失或异常动作(正常=0;最大值=2):耳廓反射(当触耳道时摇头)计1分,角膜反射(用棉花丝轻触角膜可闭眼)计1分。4个实验共计14分,分数越高,神经功能损伤越大。
2.2.2 免疫组化检测蛋白表达 小鼠处死后用4%多聚甲醛固定大脑,脱水后常规包埋,切片,厚度约4 μm,依次烤片、脱蜡水化,用3%过氧化氢去离子水灭活,热修复抗原,BSA封闭液封闭,加入适量一抗4 ℃冰箱过夜,PBS冲洗后二抗孵育,再次PBS冲洗滴加增敏液孵育,最后DAB显色并梯度脱水,透明,封片。每只大鼠取5张切片,使用OlympusBX71光学显微镜在200高倍镜下观察,运行Image Pro Plus 6.0图像分析软件计算阳性细胞数。另因一抗特性不同,p-S6K1、p-4E-BP1指标在DAB染色后再用苏木素复染,使用OlympusBX71光学显微镜在200倍高倍镜下观察,运行Image Pro Plus 6.0图像分析软件计算平均光密度。
2.2.3 qRT-PCR检测mRNA表达 从引物银行下载基因序列,用Primer premier 6.0进行引物设计,并由上海生工合成。运用Trizol法提取脑组织总RNA;检测RNA浓度及质量;以Oligo(dT)18为引物采用两步法逆转录cDNA:变性RNA,逆转录成cDNA;PCR反应:预变性温度95 ℃ 2 min,变性温度95 ℃ 15 s,退火温度59.2~60.8 ℃,循环40次。溶解曲线反应程序为95 ℃ 15 s,60 ℃ 15 s,温度缓慢上升(20 min)。内参基因选用β-actin,采用2 -△△Ct进行相对定量,表示该基因的相对表达水平。
△Ct值=基因Ct值-内参Ct值
△△Ct值=实验组△Ct值-对照组△Ct值
2.3 统计学分析
运用SPSS 21.0统计软件以及Graphpad Prism 8作图软件分析并处理。计量资料均以“x±s”进行统计,符合正态性分布的组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠神经功能评分的比较
与同类型小鼠假手术组比较,KO模型组、KO补阳组、WT模型组及WT补阳组神经功能评分明显上升(P<0.01);与同类型小鼠模型组比较,KO补阳组、WT补阳组神经功能评分明显下降(P<0.01);与WT模型组比较,KO模型组神经功能评分增高(P<0.05);与WT补阳组比较,KO补阳神经功能评分明显增高(P<0.01)。见表1。
3.2 各组小鼠mTOR、p-S6K1、p-4E-BP1蛋白表达的比较
与同类假手术组比较,KO模型组、KO补阳组、WT模型组及WT补阳组mTOR、p-S6K、p-4E-BP1蛋白表达升高(P<0.01);与同类模型组比较,KO补阳组、WT补阳组各蛋白表达上升(P<0.01);与WT模型组相比,KO模型组各蛋白表达明显降低(P< 0.01);与WT补阳组比较,KO补阳各蛋白表达明显降低(P<0.01)。详见图1-图3。
3.3 各组小鼠mTOR mRNA表达的比较
与同类假手术组比较,KO模型组、KO补阳组、WT模型组及WT补阳组mTOR mRNA表达升高(P<0.01);与同类模型组比较,KO补阳组、WT补阳组mRNA表达上升(P<0.01);与WT模型组相比,KO模型组mTOR mRNA表达明显下降(P<0.01);与WT补阳组比较,KO补阳mTOR mRNA表达明显降低(P<0.01)。详见图4。
4 讨论
中医学将脑缺血归纳于“中风病”范畴,認为其是在气血阴阳亏损的基础上,加之饮酒饱食或情志刺激等诱因,致人体脏腑阴阳失调,气血运行失约,上冲于脑,而发为中风。补阳还五汤由清代王清任所创,本方重用生黄芪为君药以大补元气;配以当归尾活血和血为臣药;红花、桃仁、川芎、赤芍助当归活血祛瘀,地龙长于行散走窜,通经活络,均为佐药。全方共奏,使气旺促血行,活血而不伤正,则筋肉得养,痿废可愈,临床上常用于治疗缺血性中风气虚血瘀之证。课题组前期研究表明,补阳还五汤能在脑缺血后通过降低炎症反应[11]、抑制细胞凋亡[4]、促进血管新生[3]、减少细胞自噬[12]等途径发挥抗脑缺血损伤作用。
脑缺血的发病机制十分复杂,但不管哪种原因导致的脑缺血,其治疗方法均以改善脑代谢,促进受损脑组织血管重构及诱发神经再生为主。mTOR是细胞生长和增殖的关键调节分子,具有调控细胞生长、蛋白质合成及细胞自噬的作用[13]。活化后的mTOR则进一步使下游底物S6K1、4E-BP1磷酸化,此两者是相互平行的信号分子,其中4E-BP1在正常状态下会与真核细胞翻译启动因子(eukaryotic initiation factor 4E,eIF4E)紧密结合,阻止帽依赖性翻译的开始,当4E-BP1磷酸化时则会与eIF4E分离,启动蛋白质的翻译,促进细胞生长;而p-S6K1可以继续活化细胞底物,促进蛋白翻译,抑制细胞凋亡,对细胞生长同样有着调节作用[14]。因此,通过改善脑缺血后mTOR通路的活性,促进受损脑组织的蛋白合成,可能是治疗脑缺血的潜在靶点,我们推测补阳还五汤可能通过mTOR通路发挥抗脑缺血损伤的作用。
小窝是细胞膜上的特殊凹陷,是各类细胞信号分子的聚集地。Cav-1是小窝中重要的功能结构与核心蛋白,可通过激活下游各类效应因子,广泛参与了细胞生长、分化、凋亡等各个病理生理过程[15],为细胞内信号传导的枢纽。课题组前期研究发现缺血性脑损伤能上调大鼠脑内Cav-1的表达[16],而Cav-1敲除则降低脑缺血早期脑内细胞的增殖并增强胶质活化,加重了脑缺血损伤[17]。随着对Cav-1研究的深入,我们发现Cav-1可以通过降低炎症反应、促进血管新生、抑制细胞自噬与促进神经再生等各种途径[18],对脑缺血后损伤神经有保护作用[19]。那么mTOR作为能够调控细胞生长和增殖的关键信号通路,Cav-1的神经保护作用是否与改善脑缺血后mTOR通路的活性来促进蛋白合成及细胞生长有关呢?
本研究发现脑缺血后小鼠mTOR的蛋白及mRNA表达上升、p-S6K1、p-4E-BP1的蛋白表达同样上升,但整体活化程度有限,无法完全修复受损神经,仍有明显神经功能缺损。补阳还五汤的干预让其调控作用更加明显,并能显著改善神经功能评分,表明补阳还五汤能够调控mTOR通路相关的活性,改善神经功能评分,推测补阳还五汤的抗脑缺血损伤的作用可能与调控mTOR通路,促进损伤神经的蛋白合成及细胞生长相关。值得注意的是,本研究还发现,与WT组小鼠相比,KO组小鼠脑缺血后神经功能评分改善较低,mTOR通路相关因子的活性受损,表明Cav-1的缺失能够影响mTOR通路的活性,加重脑缺血后神经功能损伤。
综上所述,本研究发现Cav-1基因的缺失会导致mTOR通路活性降低并加重脑缺血后神经功能损伤;此外,本研究还初步验证了补阳还五汤的干预可以影响脑缺血后mTOR信号通路的活性,并改善脑缺血损伤,但是目前还无法肯定其作用机制与
mTOR信号通路相关。课题组将从上述思路出发,采取Cav-1敲除及mTOR抑制剂双重阻断Cav1/mTOR信号通路的方式,进一步明确补阳还五汤抗脑缺血损伤的作用机制。
参考文献
[1] BENJAMIN E, BLAHA M, CHIUVE S, et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association[J]. Circulation, 2017,131(4):e29.
[2] 黄素芬,周胜强,罗 东,等.陷窝蛋白-1对永久性大脑中动脉闭塞小鼠缺血皮质白细胞介素-1β和白细胞介素-6表达的影响[J].国际脑血管病杂志,2016,24(11):1022-1027.
[3] 王 华.补阳还五汤对caveolin-1敲除小鼠脑缺血后血管新生的作用及机理研究[D].长沙:湖南中医药大学,2014.
[4] 廖亮英,蔡光先,周赛男.补阳还五汤超微饮片对局灶性脑缺血大鼠神经干细胞移植后Bcl-2、Bax表达的影响[J].湖南中医药大学学报,2018,38(3):257-260.
[5] 匡 巍,余昌胤.磷脂酰肌醇-3磷酸激酶/AKT/雷帕霉素靶蛋白信号通路参与中枢神经损伤保护与修复的研究进展[J].安徽医药,2018,22(2):215-219.
[6] 周胜强.补阳还五汤调控Cav1/mTOR/ULK1通路介导的自噬抗脑缺血损伤机制研究[D].长沙:湖南中医药大学,2017.
[7] HAO C Z, WU F, SHEN J, et al. Clinical efficacy and safety of buyang huanwu decoction for acute ischemic stroke: a systematic review and meta-analysis of 19 randomized controlled trials[J]. Evidence Based Complementary and Alternative Medicine, 2012,
2012(3/4): 630124.
[8] 周胜强,罗 东,黄素芬,等.Caveolin-1基因敲除小鼠子代基因型的鉴定及繁育方法[J].中国实验动物学报,2016,24(3):228-232.
[9] LONGA E, WEINSTEIN P, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84.
[10] 陈博威,贾 平,张文将,等.脑舒明方对局灶性脑缺血大鼠NF-κB,TNF-α和IL-1β表达的影响[J].中南大学学报(医学版),2019,44(11):1222-1229.
[11] 郭 乐,周赛男,蔺晓源,等.补阳还五汤对脑缺血后大鼠NF-κB/p50表達的影响[J].中医药信息,2014,31(4):98-101.
[12] 周胜强,易 健,周赛男,等.补阳还五汤对局灶性脑缺血小鼠半暗带细胞自噬水平的影响[J].湖南中医杂志,2017,33(2):119-123.
[13] LEIGH E, YU K S, SWATHI R, et al. Combinatorial antitumor effect of HDAC and the PI3K-Akt-mTOR pathway inhibition in a Pten defecient model of prostate cancer[J]. Oncotarget, 2014,4: 2225-2236.
[14] 柳望舒,俞 松.PI3K/AKt/mTOR信号通路与肿瘤关系的研究进展[J].实用医院临床杂志,2016,13(4):20-23.
[15] M K W, IZABELA M. Caveolins: structure and function in signal transduction.[J]. Cellular & Molecular Biology Letters, 2004,9(2):195-220.
[16] 刘柏炎,沈剑刚,蔡光先,等.补阳还五汤对局灶性脑缺血大鼠脑内caveolin1、2的影响[J].湖南中医药大学学报,2008,28(1):22-24.
[17] 刘柏炎,易 健,刘富林,等.局灶性脑缺血对caveolin-1敲除小鼠细胞增殖与神经胶质纤维酸性蛋白表达的影响[J].中华行为医学与脑科学杂志,2016,21(3):216-218.
[18] 周胜强,易 健,刘柏炎.补阳还五汤对Cav1/Notch1/Hes1通路在小鼠脑缺血后海马NSCs增殖中的作用[J].中药新药与临床药理,2016,27(6):804-810.
[19] 陈京华,汤 艳,易 健,等.Caveolin1基因敲除对于小鼠脑缺血神经功能及脑梗死面积恢复的影响[J].湖南中医杂志,2014,30(3):112-114.
〔收稿日期〕2019-11-12
〔基金项目〕国家自然科学基金项目(81273989);湖南省自然科学基金项目(2018JJ2413、2018JJ3383);湖南省中医药管理局项目(2015140)。
〔作者简介〕陈博威,男,在读硕士研究生,研究方向:中医药防治心脑血管疾病。
〔通讯作者〕*刘柏炎,男,博士,教授,博士研究生导师,E-mail:liubaiyan@126.com。

