miR-26b-3p靶向调控TRA2B表达抑制神经胶质瘤细胞的增殖和转移
隋锐 张烨 姚冰 孙佩欣 朴浩哲
神经胶质瘤是常见的一类恶性肿瘤,其发病率在我国逐年增加,并且往往伴随着较差的预后,严重威胁人们的身体健康[1-2]。术后肿瘤的复发及转移是限制神经胶质瘤脑移植发展的关键问题[3]。目前治疗的主要方法包括手术切除和介入化疗栓塞等手段,但以上方式的疗效仍有待进一步确证,其临床效果均不理想[4]。因此提早诊断神经胶质瘤的发生和采取相应措施将会极大地改善神经胶质瘤患者的预后情况。微小RNA(miRNAs)是长度为20~22nt 的非编码RNA,miRNAs与目的mRNA 结合从而调控mRNA的表达[5]。miRNAs 具有极其重要的作用,它参与细胞增殖分化、应激及凋亡等一系列生物学过程,因而在肿瘤研究中具有很大意义[6]。miR-26b-3p 在多种恶性肿瘤组织中检测到表达上调,比如宫颈癌、胰腺癌以及肺癌等,在癌症的发生发展以及预后过程中发挥重要作用[7-9]。但是国内关于miR-26b-3p 在神经胶质瘤增殖与转移中的作用研究相对缺乏。我们将利用荧光定量PCR 技术检测胶质瘤患者组织中miR-26b-3p 的表达情况,并运用细胞学实验探究miR-26b-3p 在神经胶质瘤细胞侵袭中起的作用。
1 材料和方法
1.1 标本来源
收集2016年8月至2017年8月来本院肿瘤科就诊的32例神经胶质瘤组织切片和癌旁组织切片(癌组织3~4 cm 处)。入组标准:①不存在其他恶性肿瘤或其他系统性疾病;②属于原发性神经胶质瘤。排除标准:①手术前进行过放疗、化疗以及免疫治疗的患者;②服用抗肿瘤药物或进行放疗等治疗的患者。
1.2 细胞培养与转染
①取出冻存神经胶质瘤细胞SHG-44,水浴锅加温融化(水温37℃),低温低速离心4 分钟,弃上清,加入1 mL RPMI-1640 培养液,再放入培养箱进行培养(5% CO2,温度为37℃)。②在鼎盛生物公司合成miR-26b-3p inhibitor和mimic,取出两组细胞作为miR-26b-3p inhibitor组和miR-26b-3p mimic 进行细胞转染,按Lipofectamine®2000 Transfection Reagent 说明书实行细胞转染操作;阴性对照组不做处理,进行后续实验。
1.3 癌细胞Total RNA的抽提
转染24 h 后,用胰酶对各组SHG-44 细胞消化,收集细胞悬液;离心管进行低速离心3 min,再加入1.5 mL Trizol 裂解液,重悬混匀。取离心之后的水相放在1.5 mL 离心管,加入异丙醇震荡混匀。离心管低速离心12 min 后采用600 μL,75%的酒精洗涤四次RNA 沉淀。加入100 μL RNasefree 溶解RNA,使用NanoDrop 测定RNA 浓度,再放在-20℃冰箱备用。
1.4 miRNA的反转录与定量PCR检测
按照试剂盒说明书进行体外反转录实验得到cDNA 产物,从而获得cDNA 模版。反应体系为TaqMan®Universal PCR Master Mix 20 μL,用ΔCT 表示miR-26b-3p 相对表达量(ΔCT=|CTmiR-26b-3p-CTU6|),以U6 作为内参。以同样的方法检测TRA2B在RNA水平的表达,PCR 扩增引物如表1。

表1 各引物序列信息Table1 Sequence information of each primer
1.5 CCK8 检测细胞增殖活力
转染24 h 后,将SHG-44 细胞接种在96 孔板(6×103细胞/孔),每孔分别加入12 μL CCK-8 溶液,放置在培养箱中。当到达时间节点24、48和72 h,分别检测各组细胞吸光度值(OD450nm)。
1.6 细胞划痕实验
取各组SHG-44 细胞接种6 孔板(5×106个/孔),使用培养箱过夜培养。用无菌枪头进行划痕,采用1xPBS 对各组细胞洗涤5次,加入培养基后拍照为0 h 时细胞的迁移情况。继续进行培养,24 h 后显微镜下拍照,两次拍照之间的划痕距离可衡量各组细胞的迁移能力。
1.7 统计分析
采用SPSS 22.0 软件进行分析,计数资料用n(%)表示,行χ2检验;计量资料用()表示,两组间比较用t检验,多组间比较使用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 组织切片HE 染色结果
对神经胶质瘤组织切片和癌旁组织切片进行HE 染色发现,神经胶质瘤组织组织出现少量点状坏死,细胞间有部分炎性细胞的浸润;而癌旁组织结构完整,无明显细胞坏死(图1)。

图1 脑组织HE 染色结果比较(HE,×200)Figure1 Comparison of HE staining results of brain tissue(HE,×200)
2.2 miR-26b-3p与TRA2B 在神经胶质瘤组织中的表达
通过q-PCR检测癌组织和癌旁组织切片中miR-26b-3p 相对表达量发现,神经胶质瘤组织中其相对表达量显著高于癌旁组织,差异有统计学意义(P<0.05);神经胶质瘤组织中TRA2B相对表达量显著低于癌旁组织,差异有统计学意义(P<0.05),见表2。进一步对患者癌组织中miR-26b-3p与TRA2B相对表达量进行分析发现,miR-26b-3p与TRA2B的表达呈显著负相关(r=-0.550,P<0.05),见图2。
2.3 各组SHG-44 细胞中miR-26b-3p与TRA2B 的相对表达量比较
利用q-PCR检测各组细胞miR-26b-3p 的相对表达量,miR-26b-3p inhibitor组中的miR-26b-3p 的表达显著降低,miR-26b-3p mimic组中miR-26b-3p的表达显著升高,与阴性对照组比较,差异有统计学意义(P<0.05),如表3。
表2 不同脑组织中miR-26b-3p和TRA2B 的相对表达量(±s)Table2 The relative expression of miR-26b-3p and TRA2B in different brain tissues(±s)

表2 不同脑组织中miR-26b-3p和TRA2B 的相对表达量(±s)Table2 The relative expression of miR-26b-3p and TRA2B in different brain tissues(±s)
神经胶质瘤组织癌旁组织t 值P 值n 32 32 miR-26b-3p 相对表达量2.35±0.15 1.57±0.21 6.12<0.001 TRA2B 相对表达量0.69±0.10 1.55±0.12 11.56<0.001
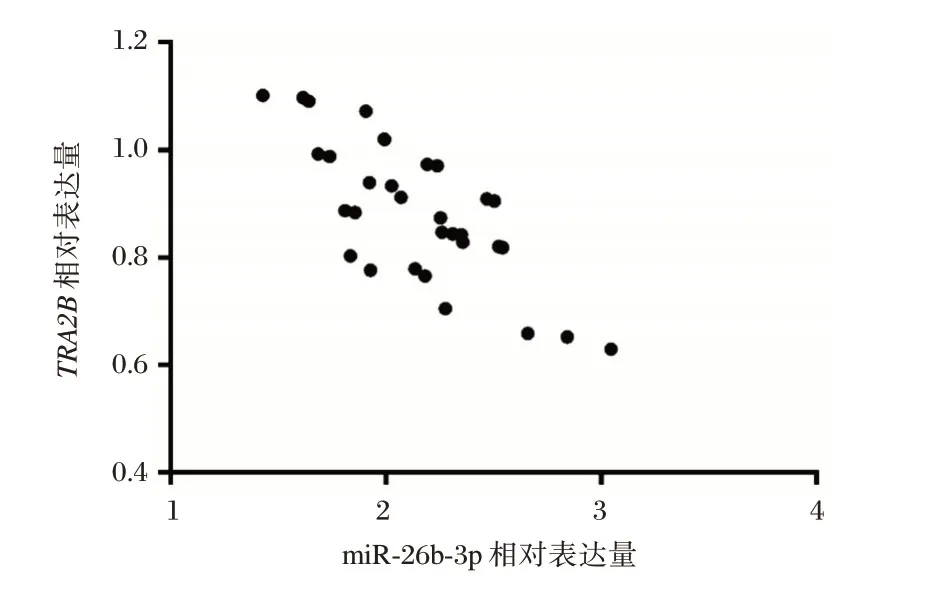
图2 神经胶质瘤组织中miR-26b-3p与TRA2B表达的相关性分析Figure2 Correlation Analysis of the expression of miR-26b-3p and TRA2B in glioma tissues

表3 各组SHG-44 细胞中miR-26b-3p和TRA2B的相对表达量Table3 The relative expression of miR-26b-3p and TRA2B in SHG-44 cells of each group
2.4 miR-26b-3p 对SHG-44 细胞增殖活性的影响
检测转染24、48与72 h 后各组SHG-44 细胞吸光值,miR-26b-3p mimic组的增殖率在转染24、48和72 h 后增值率显著高于阴性对照组(P<0.05);miR-26b-3p inhibitor组的增殖率在各个时间点增值率均低于阴性对照组,均具有统计学意义(P<0.05),如图3。

图3 miR-26b-3p 对SHG-44 细胞增殖活性的影响Figure3 Effect of miR-26b-3p on the proliferation of SHG-44 cells
2.5 miR-26b-3p 对SHG-44 细胞迁移能力的影响
转染24 h 后,利用细胞划痕实验检测各组SHG-44 细胞的迁移能力,miR-26b-3p inhibitor组SHG-44 细胞迁移距离小于阴性对照组(P<0.05);miR-26b-3p mimic组SHG-44 细胞迁移距离显著高于阴性对照组(P<0.05),见图4。

图4 不同组细胞迁移能力的比较(台盼蓝染色,×200)Figure4 Comparison of cell migration in different groups(台盼蓝染色,×200)
3 讨论
目前普遍认为细胞的恶性增殖是癌症发生的必要环节,近年来对神经胶质瘤的研究发现,miRNA 通过其对关键基因表达的调控,比如P53,在癌细胞的增殖、迁移、侵袭以及凋亡过程中起着重要作用[10-11]。在神经胶质瘤细胞中表达上调的miRNA 包括miRNA-183,miRNA-21,miRNA-221 等;在神经胶质瘤细胞中表达下调的miRNA 有miRNA-122,miRNA-145 以及miRNA-26a 等,其表达水平不尽相同,作用机制各不相同[11-12]。
有研究发现,miR-122 在正常脑组织中表达水平较高,占全部miRNAs 表达量的70%,而其表达的下调与癌症的发生发展密切相关,其在神经胶质瘤细胞中的下调会导致其靶基因如脑细胞核因子3A(Hepatocyte nuclear factor 3A,HNF3A)的表达升高,而HNF3A均是脑细胞细胞周期重要的调控蛋白,从而导致细胞周期紊乱,引发癌症的发生[13-14]。Huang 等对SHG-44 细胞系的研究发现,当提高细胞内源miR-122 的表达水平时,细胞中caspase9/3 蛋白的表达水平明显提高,同是细胞凋亡率显著提高;进一步对miR-122 靶基因进行分析发现,其可能是通过抑制内源Bcl-w 蛋白的表达,而实现对细胞凋亡的调控,表明在神经胶质瘤细胞中miR-122 的表达上调,可抑制内源Bcl-w 蛋白表达从而调控神经胶质瘤细胞的凋亡过程,在神经胶质瘤的发生发展中起着重要作用[15]。在癌细胞中对miR-26b-3p 的表达进行研究发现,miR-26b-3p在癌细胞中的表达水平显著高于癌旁组织,而下调miR-26b-3p 在癌细胞系中的表达会明显抑制血细胞的生长增殖;进一步通过流式细胞仪对细胞的凋亡情况进行检测发现,下调癌细胞系Panc-1 内源miR-26b-3p 表达,癌细胞的凋亡率显著提高,集聚能力明显下降,表明miR-26b-3p 在癌症的发生发展中起着癌基因的作用[16]。
本研究在神经胶质瘤细胞中对miR-26b-3p 及其靶基因的进一步探究,发现miR-26b-3p 在神经胶质瘤患者癌组织中表达明显上调;在神经胶质瘤组织中TRA2B的表达水平显著下降。Pearson相关性分析显示,在32例神经胶质瘤患者神经胶质瘤组织中,TRA2B的表达水平与miR-26b-3p 表达呈显著负相关,进一步证实了miR-26b-3p 对TRA2B的靶向调控作用。近来研究发现,TRA2B表达水平降低可导致多种肿瘤细胞的迁移和侵袭能力减弱[17]。这表明miR-26b-3p 通过靶向调控TRA2B的表达,在神经胶质瘤细胞增殖和迁移过程中发挥重要作用。
综上所述,本研究首次在神经胶质瘤中研究miR-26b-3p 的表达,发现在神经胶质瘤癌细胞中,miR-26b-3p 的表达明显上调,而TRA2B的表达被抑制;在神经胶质瘤细胞系中的研究进一步证实,miR-26b-3p 通过靶向调控癌细胞中TRA2B的表达,促进神经胶质瘤细胞的增殖和迁移,与肿瘤的发生发展密切相关。

