1例结肠+胰腺双重癌病例MDT诊治报告
文政琦,许宁,黄鉴,周锐泽,何波,梁进,李荣清,潘国庆,李碧桃,李文亮△
1 昆明医科大学第一附属医院肿瘤外科 云南昆明 650032
2 昆明医科大学第一附属医院影像科 云南昆明 650032
3 昆明医科大学第一附属医院肿瘤内科 云南昆明 650032
4 昆明医科大学第一附属医院肿瘤放疗科 云南昆明 650032
5 昆明医科大学第一附属医院肿病理科 云南昆明 650032
6 昆明医科大学第一附属医院预防保健科 云南昆明 650032
1 初诊情况
患者女性,74 岁,因“间歇性便血1 月”于2017 年8 月30 日门诊收治入院。既往史否认高血压病、糖尿病等基础疾病。
入院查体:双肺呼吸音粗;右下腹可触及一约4 cm×3 cm包块,边界清,活动度差,轻压痛,余无反跳痛及肌卫,移动性浊音(-);胸膝位肛门指检无异常。
实验室检查:血常规、肝肾功能、凝血功能及感染性疾病筛查均无异常,CEA 为2.01 ng/mL,CA19-9为29 U/mL。
器械检查:(1)肠镜提示距肛门70 cm肠管可见占位性病变(图1A),侵及肠腔整圈,内镜能够通过,取材活检提示中分化腺癌。(2)结肠钡灌提示升结肠占位(图1B),病变范围67 mm。(3)双肺CT 平扫未见异常(图1C)。肝胆胰脾MRI 平扫+增强+DWI示升结肠(图2A)、肾上腺(图2B)及胰腺占位(图2C):升结肠不均匀增厚,向上侵犯肝脏S6 段;右侧肾上腺见类圆形占位,边缘轻度强化;胰腺尾部可见不规则团块,增强呈不均匀强化,边界不清。
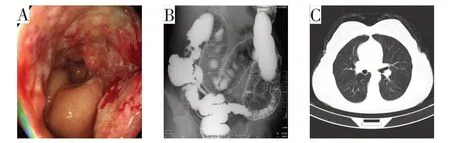
图1 入院肠镜+结肠钡灌+双肺CT检查所见
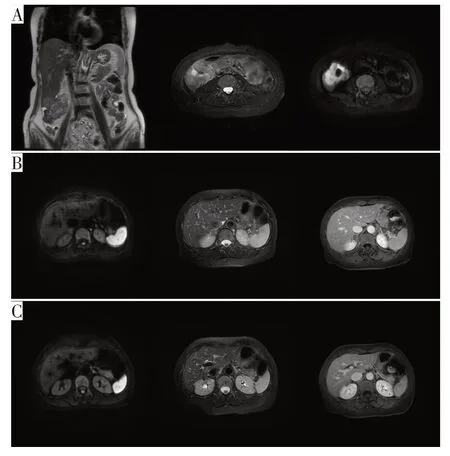
图2 入院肝胆胰脾MRI检查所见
诊断及分期:1.升结肠癌:cT4b?N0M1?肝转移?2.胰腺、右侧肾上腺病灶:转移?原发?
2 诊疗过程
2.1 第1次MDT讨论及治疗情况
2.1.1 第1次MDT讨论
讨论提出:本患者初诊表现为消化道出血症状,肠镜检查并取材已确诊为升结肠腺癌,同时MRI 检查发现胰腺及肾上腺占位,原发性结肠癌合并胰腺、肾上腺转移亦或多原发恶性肿瘤,为进一步明确诊断、评估手术指征及治疗方案提出MDT讨论。
影像科:上腹部MRI 提示升结肠占位,DWI 呈高信号,增强不均匀强化,符合结肠恶性肿瘤征象,肿瘤向上侵犯肝脏S6 段,影像分期cT4bN0Mx;胰腺病灶边界不清,增强有不均匀强化,考虑恶性可能,原发及转移待鉴别;肾上腺占位病变强化不明显,边界清楚,良性可能,不除外转移。
肿瘤外科:考虑升结肠癌侵犯肝脏的诊断,胰腺病灶恶性可能性大,肾上腺病灶不能除外恶性可能,根据目前检查结果,肿瘤可切除,可行根治性右半结肠切除+肝脏区段切除+胰体尾切除+右侧肾上腺占位切除术。
讨论总结:该患者目前考虑升结肠癌侵犯肝脏,胰腺及肾上腺系孤立性病灶,评估提示可切除,故可行手术治疗,术后根据各部位肿瘤病检结果再决定下一步诊疗方案。
2.1.2 治疗情况
患者于2017 年9 月7 日全麻下行“腹腔镜探查+开腹根治性右半结肠切除+肝S6 段切除+胰体尾切除+脾脏切除+右侧肾上腺肿物切除术”,手术顺利,术后恢复良好,无特殊并发症。
术后病检提示:(升结肠)中分化腺癌,癌组织侵犯肠壁全层并浸润肝脏组织,未见脉管、神经侵犯,查见淋巴结16 枚,未见癌转移(0/16),MSH2(+),MSH6(+),PMS2(-),MLH1(+),两侧切缘(-),见图3;(胰腺+脾脏)胰腺中分化腺癌,大小2.0 cm×1.5 cm×1.0 cm,神经侵犯(+),脉管侵犯(-),CK7(+),CD20(-),CDX2(+),CK19(+),见图4;(右侧肾上腺)皮质结节,未见癌组织(图5)。
术后分期:升结肠癌pT4b(G2)N0(0/16)M0ⅡC 期;胰 腺 癌pT1cN0M0ⅠA 期,KRAS、NRAS、BRAF基因均未见突变。

图3 升结肠病理检查结果(HE)

图4 胰腺+脾脏病理检查结果(HE)
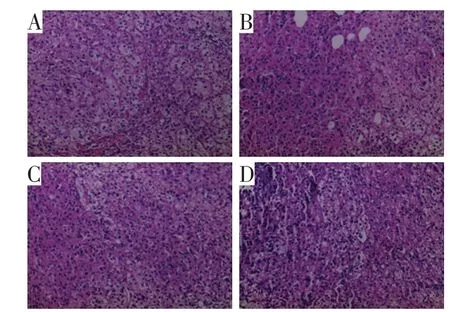
图5 右侧肾上腺病理检查结果(HE,×200)
2.2 第2次MDT讨论及治疗情况
2.2.1 第2次MDT讨论
讨论提出:患者术后恢复良好,术后病检提示多原发癌,为指导下一步诊疗方案,再次提出MDT讨论。
肿瘤外科:患者行“右半结肠+肝脏S6段+胰体尾+脾脏+右侧肾上腺肿物切除”,术中见肿瘤位于结肠肝曲,突破浆膜并浸及肝脏S6段,约5.0 cm×4.0 cm,胰腺尾部见约3.0 cm×2.0 cm 包块,现系术后3 周,恢复良好。
病理科:该患者结肠病灶可见腺癌细胞明显浸润肠壁,正常肠上皮少见,并明显浸润肝脏实质;胰腺占位切片中间高度异性增生,胰管空腔,并向间质浸润,符合胰腺导管腺癌特点;肾上腺病灶未见异性细胞,考虑良性。
肿瘤内科:结合病检结果,该患者为多原发恶性肿瘤,升结肠癌pT4b(G2)N0(0/16)M0ⅡC期、胰腺癌pT1cN0M0ⅠA期,根据NCCN指南均需接受6个月术后辅助治疗,化疗方案需覆盖结肠癌及胰腺癌,可考虑以5-FU 为主方案,患者结肠病灶T分期较晚(T4b),且手术对患者体能影响较大,推荐给予XELOX方案化疗,同时密切监测患者影像学复查结果。
肿瘤放疗科:患者为结肠+胰腺双重癌,目前已R0切除,未见肿瘤残留,目前没有足够证据支持术后放疗有助于改善预后,故患者目前无术后放疗指征,建议以全身辅助化疗为主。
讨论总结:患者术后恢复良好,结合患者术后病理分期且系多原发癌的实际,根据NCCN 指南意见,建议予XELOX方案化疗半年。
2.2.2 治疗情况
根据MDT讨论意见,患者于2017年9月30日至2018年3月30日给予6周期XELOX方案化疗(奥沙利铂130 mg/m2,d1,静脉滴注;卡培他滨1 000 mg/m2,d1~14,口服),期间未出现明显骨髓抑制等不良反应。患者术后CEA及CA19-9水平监测结果提示呈进行性升高(图6)。2018 年4 月1 日复查盆腹腔增强CT检查未见肿瘤复发及转移征象。

图6 术后CEA与CA19-9监测结果
2.3 第3次MDT讨论及治疗情况
2.3.1 第3次MDT讨论
讨论提出:患者已行6 个月XELOX 方案辅助化疗,期间复查CT等未见肿瘤复发及转移,但CEA及CA19-9进行性升高,故提出第三次MDT讨论下阶段诊疗方案。
影像科:阅患者复查盆腹腔增强CT检查及胸部CT资料,均未见确切肿瘤复发及转移征象。
肿瘤外科:患者虽然肿瘤标志物较前进行性升高,但相关影像学检查未见肿瘤确切复发及转移征象,故无外科干预指征。
肿瘤内科:目前不能除外肿瘤复发及微转移可能,建议给予单药卡培他滨维持治疗,规律复查肿瘤标志物波动情况予适时干预,必要时可行PET/CT等进一步检查。
讨论总结:患者已行半年XELOX 方案的术后辅助化疗,根据影像学及CEA、CA19-9监测结果,不能除外肿瘤复发及微转移的可能性,建议给予单药卡培他滨维持治疗,并动态监测肿瘤标志物波动情况,定期影像学复查,严密随访。
2.3.2 治疗情况
患者于2018 年4 月3 日后因无特殊不适等症状,未行规律复查及诊疗,一直失访。
患者于2019年2月3日因“腹胀、腹痛2月”再次门诊收入院。查体:双肺呼吸音粗;腹膨隆,肝脾未触及,右侧腹饱满、压痛,无反跳痛,移动性浊音(-),肠鸣音活跃。
实验室检查:血常规、肝肾功能、凝血功能及感染性疾病筛查均正常,CEA 为30.59 ng/mL,CA19-9为1 000 U/mL。
器械检查:(1)急诊胸腹盆CT平扫提示:结肠吻合口见软组织密度影,考虑复发可能,小肠梗阻,肝内多发低密度影,右侧肾盂输尿管积水,右侧输尿管盆段与吻合口周围软组织分界不清(图7);双肺散在大小不等结节,转移可能(图8)。(2)肠镜提示吻合口及吻合口旁结肠病变性质待查,肿瘤复发可能,取材活检提示:组织部分腺上皮高级别上皮内瘤变(图9)。(3)腹部MRI平扫+增强+DWI 提示:结肠吻合口明显不规则增厚呈肿块状,考虑肿瘤复发,肝内多发转移瘤(图10)。(4)PET/CT 提示吻合口复发并全身广泛转移(图11):升结肠吻合口周围见片状软组织影,边界不清,周围脂肪间隙模糊,糖代谢异常(SUVmax:11.7),考虑肿瘤复发;肠系膜、左侧锁骨上区、肺门及纵膈、右侧内乳淋巴链区、左侧腋窝、胰腺周围、腹主动脉旁、双侧髂血管旁淋巴结糖代谢异常(SUVmax:8.1),考虑转移;双肺多发代谢增高影(SUVmax:2.8),考虑转移;肝脏多发代谢增高影(SUVmax:8.8),考虑转移;T1椎体代谢增高影(SUVmax:6.5),考虑转移。
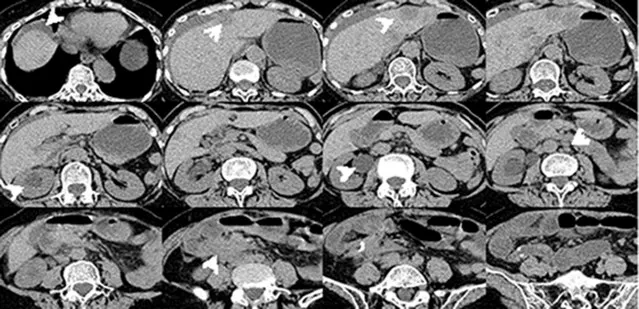
图7 再次入院胸腹盆CT所见

图8 再次入院双肺CT所见
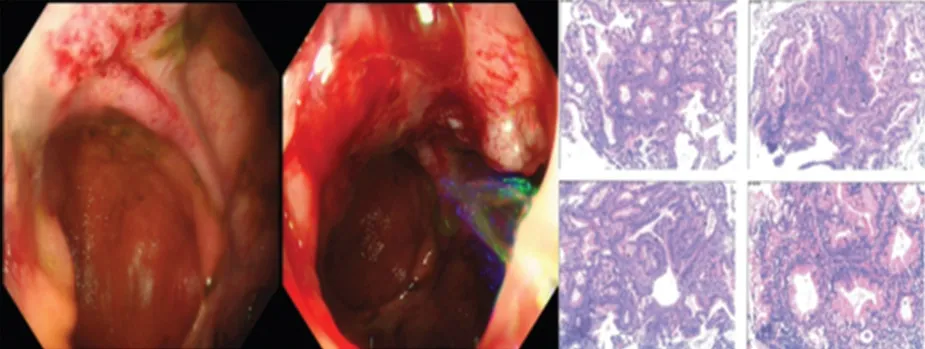
图9 再次入院肠镜检查所见

图10 再次入院腹部MRI所见

图11 再次入院PET/CT所见
2.4 第4次MDT讨论及治疗情况
2.4.1 第4次MDT讨论
讨论提出:患者失访近1年,未行任何进一步检查及维持治疗,现结合目前相关检查,考虑肿瘤全身广泛转移可能,特再次提出MDT 讨论进一步诊疗方案。
肿瘤外科:患者现出现吻合口复发,肝脏、肺、骨及全身多处淋巴结广泛转移,合并不完全性肠梗阻,可给予积极营养支持治疗,无根治性手术指征,考虑患者存在梗阻进行性加重风险,可行姑息性肠造瘘术予解除梗阻。
肿瘤内科:因患者存在双重原发恶性肿瘤,现出现全身广泛转移,可考虑姑息性全身化疗,但需完善肝脏穿刺活检进一步明确转移性病灶来源,明确错配修复基因(MSI) 情况及肿瘤突变负荷(TMB),予定姑息性治疗方案及评估免疫治疗的可能性。若为胰腺转移来源,考虑患者体力情况欠佳,可暂给予单药吉西他滨方案化疗,若耐受性改善可联合治疗。若为结肠癌转移,可考虑给予FOLFIRI联合西妥昔单抗方案化疗。
讨论总结:给予最佳姑息性营养支持治疗,联系肝脏病灶穿刺病检明确转移性病灶来源及MSI、TMB 情况,再决定是否化疗以及联合靶向治疗或免疫治疗的干预。但目前患者为恶性肿瘤晚期,病情进展迅速,治疗效果可能不理想,需再次详细向患者和家属告知病情。
2.4.2 治疗情况
患者于2019年2月17日在局部麻醉下行“CT引导下肝转移性病灶穿刺活检术”,术后病检提示:腺癌,结合免疫组化结果考虑胰腺来源可能(图12)。

图12 肝脏穿刺病理检查所见(HE,×200)
患者于2019年2月27日、3月6日及3月14日给予单药吉西他滨方案化疗(1 000 mg/m2,d1、d8、d15,静脉滴注)。
患者于2019年3月21日出现多器官功能衰竭死亡。
3 讨论
多原发恶性肿瘤(multiple primary malignant neoplasms,MPMNs)指同一患者体内一个或者多个器官、组织同时或先后发生2种或2种以上的原发恶性肿瘤,又称为多原发癌、重复癌等。多原发癌可出现三重癌、四重癌,甚至六重癌[1],其发病率依次呈逐渐降低趋势,二重癌最常见[2]。MPMNs 在临床诊疗中容易被误诊为恶性肿瘤的复发或转移而影响治疗方案的选择及延误最佳的诊疗时机。
多重癌的诊断现多采用Warren等[3]修订的诊断标准:(1)每一肿瘤必须是恶性的;(2)每一肿瘤各自独立存在,彼此无关;(3)癌灶间必须有一定距离的正常组织;(4)一个肿瘤必须排除为其它肿瘤的转移灶。本病例初次入院评估提示结肠、胰腺及肾上腺均有占位性病变,经术后病检证实为双重癌,符合此诊断标准。
MPMNs 的发生与多因素持续作用有关,特别是基因及遗传因素方面,分子遗传学研究为癌基因的遗传提供了证据,其中p53基因是目前研究最深入的癌基因,p53突变导致的细胞周期与细胞凋亡失控是产生绝大多数恶性肿瘤的重要机制之一[4]。PTEN 基因是继p53基因发现的又一在肿瘤中缺失和突变率较高的抑癌基因。Bubien 等[5]研究发现高登综合征(Cowden syndrome)是因PTEN 基因突变导致的常染色体显性遗传病,此类患者常合并甲状腺癌、乳腺癌和子宫内膜癌。加之近年来对于BRCA1-2基因的突变以及ALDH2基因的失活、微卫星不稳定性等方面的研究取得突破[6],为我们进一步研究MPMNs 发病机制及诊断治疗提供了新方向。
MPMNs 预后受各个癌灶病理类型、病理分期及恶性程度等因素影响,重复癌发病时间及位置的不确定性增加了诊断的难度及治疗的复杂性。付金金等[7]研究发现异时性多原发癌比同时性多原发癌的预后好,两原发癌间隔时间越长,预后越好。对于有手术指征的非转移性多原发癌,应尽早手术根治,术后进一步明确诊断及分期。在此病例中,术前经MDT 讨论考虑存在二重癌亦或三重癌,虽无法进一步明确诊断,但经评估三个位置的肿瘤均为可切除,故存在根治性手术指征,通过手术,术后病检进一步证实为结肠+胰腺双重癌,肾上腺病灶则为良性,为后续治疗提供依据。术后辅助化疗方面,应根据术后病理分期对多个癌种分期进行分析,应侧重考虑分期较晚的癌种,在此病例中,经MDT 会诊专家综合胰腺癌及结肠癌诊疗指南及相关临床研究分析,考虑结肠癌分期较晚,且NCCN指南中单药氟尿嘧啶类药物对于胰腺癌亦有作为辅助化疗的推荐,故选用XELOX 方案进行术后辅助治疗。患者曾持续失访一段时间,后于术后1年余检出胰腺癌肝转移及结肠癌局部复发,肿瘤负荷较大,经姑息性治疗无法控制病情进展,患者最终死亡,表明多重癌出现局部复发或远处转移后病情进展迅速,抗肿瘤治疗的权衡难度大,且患者治疗耐受性差,生存期缩短,预后极差。
综上所述,多原发癌的发病率较低,但诊断及治疗难度大,疾病进展迅速,预后差。随着肿瘤诊断及治疗技术水平的提高,加之MDT 的规范实施,有助于提高多重癌患者的诊断准确率。根据患者病情给予积极的手术、放化疗、靶向治疗等抗肿瘤综合干预措施,有望提高疾病治愈率、延长患者的生存时间。