禽多杀性巴氏杆菌PlpE基因的PCR扩增检测
刘永明


摘 要 多杀性巴氏杆菌是一种重要的人畜共患病的病原菌,有许多不同的血清型,可使多种动物感染发病,其中禽霍乱是其中之一,其主要特征为引起家禽发生腹泻、呼吸困难、发热等症状,此病严重危害畜禽养殖业的发展。据报道[1],禽多杀性巴氏杆菌PlpE基因可编码一种具有较好的交叉免疫保护性的外膜脂蛋白抗原。本实验先将目的细菌进行培养增殖,而后提取细菌总DNA并进行琼脂糖凝胶电泳,最后运用核酸PCR扩增技术检测扩增PlpE基因,以确定分离获得细菌株是否具有PlpE基因,从而判定该菌致病性的大小,为禽巴氏杆菌病的快速诊断以及奠定初步的基础。
关键字 多杀性巴氏杆菌,DNA提取,PlpE基因,PCR扩增
1. 引言
多年以来,禽霍乱一直是国内外养殖企业十分重视的畜禽传染病,被列为重点防制的家禽疫病之一。由于该病的病程较短、死亡率较高,这给养殖畜禽业带来了极大的危害,造成了巨大的威胁,特别是对养鸡产业的影响较为严重,现已被人们关注和重视[5]。目前对于禽霍乱的主要防制是有弱毒活疫苗和灭活疫苗,弱毒活疫苗有较好的交叉性,交叉的效果较好,但是在接种后的应激反应较强。灭活疫苗有较好的安全性,但是交叉保护性较差,免疫持续时间不长[8]。禽巴氏杆菌病,又可以称为禽霍乱,是由多杀性巴氏杆菌引起的一种败血性的传染病。禽霍乱的特征主要为发热、腹泻和呼吸困难,最急性病例可以迅速死亡[10]。禽霍乱是可以通过接触就能够传染的一种疾病,它的发病率和死亡率都是比较高的,都是能够危害多种畜禽类,急性败血的过程就是禽霍乱的特征表现。出现慢性的疾病或者是局部性的疾病都是要在感染之后或者是急性发病之后才会发生的[11]。由于禽巴氏杆菌病发病速度比较急和死亡时间比较快,若是不能及时的诊断或是治疗的话会引起畜禽的大部分死亡。据研究报道,该病原菌在世界各地区普遍分布,其类型有发散型或是流行型[6]。一种多杀性巴氏杆菌可以感染多种动物及无宿主特异性,也可以通过呼吸道进行生殖垂直传播和水平传播[4]。不同动物感染后发病的状态和变化情况都不一样。
禽巴氏杆菌病的病原菌为多杀性巴氏杆菌[7],该菌体属于巴氏杆菌科巴氏杆菌属,菌体呈两极着色,单个存在,有时成双排列,是一种革兰氏阴性需氧兼性厌氧菌,是球杆状或者是短杆状的一种细菌,该细菌对营养有较高的要求,其两侧钝圆,中央则是微微突起的,没有芽孢的形成也没有鞭毛,是不运动的一种菌。关于巴氏杆菌属细菌的报道已经有了20多种,一般存在健康动物的咽部黏膜和口腔,是一种条件致病菌。
对致病性以及在宿主体中存活和繁殖有重要作用的是细菌毒力因子[13]。而且部分的毒力因子的免疫原性有比较强,所以对部分的毒力因子进行研究并成此病预防及治疗提供了理论依据。目前确定多杀性巴氏杆菌毒力因子和免疫原主要是有荚膜、外膜蛋白、脂多糖和PMT毒素。荚膜具有细菌的致病性和粘附性,抗干燥,其中主要的成分是透明质酸。荚膜可以用做制备疫苗。其中,脂蛋白E不仅仅是巴氏杆菌的一种膜脂蛋白,其主要作用是具有粘附宿主细胞,经过研究的表明,脂蛋白E也还是一种保护性抗原的因子[12]。
多杀性巴氏杆菌的分型主要采用血清学方法检测荚膜和菌体抗原[2],目前已经发现6个血清群(A、B、C、D、E、F)和16种菌体血清型。许多学者在研究禽霍乱亚单位疫苗是利用了化学的方法提取了禽巴氏杆菌荚膜多糖等物质,这种方法虽然比较好,但是成本较高,随着分子生物学的发展利用在大肠杆菌中成功的表达了禽多杀性巴氏杆菌PlpE蛋白[9],这种蛋白是巴氏杆菌外膜蛋白的其中一种,其免疫学活性可能较强。本次实验的目的是为了探讨不同菌株中PlpE基因的存在情况,以期为探讨PlpE基因在该菌致病作用、PlpE蛋白对疾病的免疫效果乃至为PlpE蛋白检测提供一定的前期基础。
2. 材料与试剂
2.1 菌株
禽巴氏杆菌菌株(由西北民族大学生命科学与工程学院预防兽医学实验室提供)
2.2 主要器皿、设备
玻璃棒、平皿、錐形瓶、烧杯、电子天平秤、电炉、100ml量筒、电热恒温水浴锅、自动高压锅、水平电泳仪、电泳槽、凝胶成像系统、超净工作台、试管、离心机、梯度PCR仪、0.5mLPCR管、各种规格的吸头、微波炉、立式高压蒸汽灭菌器、WJ-3型-160 CO2细胞培养箱、落地式全温振荡器、高速冷冻离心机等
2.3 主要试剂和培养基
培养基:营养肉汤培养基: 100ml的蒸馏水,营养肉汤1.8g,马血清5ml。
LB固体培养基:1%蛋白胨1g,0.5% 酵母0.5g,1%NaCl1g,1.6g琼脂粉,NaOH溶液,马血清5ml,加水到100ml。
试剂:TIANamp Bacteria DAN Kit细菌基因组DNA提取试剂盒、革兰氏染色液试剂盒。
3. 方法
3.1禽巴氏杆菌的纯化培养
3.1.1 培养基的制备
营养肉汤培养基:称量2.2g,放在锥形瓶里,加入100ml的蒸馏水,调PH至7.0,在电炉上加热搅拌溶解至透明,利用记号笔进行标记,在加塞子之后用牛皮纸将其瓶口包裹好。将制作好的液体培养基锥形瓶放在121℃的高压蒸汽灭菌锅中进行高压15min,待高压结束之后,要等到高压锅内的气压放气完后才能打开,取出锥形瓶置于超净工作台上,冷却至45℃左右,即可加入马血清5ml,混匀,然后将混匀好的培养基分别倒入试管内(每支试管不超过1/4),在操作过程的中要一直保持无菌的状态,以防止被其他细菌污染。
LB固体培养基:称量1%胰蛋白胨1g,0.5%酵母0.5g,1%NaCl1g和1.6g的琼脂粉放置在锥形瓶中,蒸馏水加80ml,搅拌溶解,然后再滴加NaOH,利用NaOH将酸碱度调成7.0,最后再加蒸馏水到100ml进行定容,利用电炉加热溶解到透明状,加上塞子之后用牛皮纸将瓶口包装起来。将做好的培养基锥形瓶放置在121℃的高压蒸汽灭菌锅中进行高压15min,高压结束后,注意要等高压锅内的气压为0时才能打开,取出锥形瓶放在超净工作台上,冷却至45℃左右,加入马血清5ml,然后倒入在培养皿上,操作时保持无菌操作。
3.1.2细菌纯化
⑴肉汤培养纯化法
利用移液枪将已准备好的菌种挑出一小部分放置于肉汤中,在落地式全温振荡器内培养24h,取出摇晃时在若肉汤中出现浑浊则说明培养完成。
⑵连续划线法
将准备好的菌种利用连续划线法接种到已经做好的培养基上,放置于37℃的恒温箱中培养24h,若培养基上长出菌落则说明培养完成。
3.2 细菌纯化检验
3.2.1 革兰氏染色[3]
(1)制片:用移液枪在营养肉汤内吸取10μl液体或在培养基内挑出一小部分菌加少量的生理盐水,放在灭菌过的载玻片上搅拌混合。
(2)干燥:为了使水分快速蒸发,即可将玻片放在酒精灯上,距离火焰10cm处加热干燥。
(3)初染:滴加草酸铵结晶紫,染色1min后水洗。
(4)媒染:将载玻片平放在桌面上滴加碘液后,约1min左右进行水洗。
(5)脱色:把载玻片上的水利用吸水纸吸净,然后再滴上乙醇进行脱色,等到30秒之后水洗;或者是可以把乙醇滴满整个玻片,静置到30秒后水洗这样可以不用浪费乙醇。
(6)复染:在进行完脱色之后用吸水纸将玻片上的水吸取干净,若想快速蒸干水分可以在酒精灯上方微微加热或者是自然干燥。在水分蒸干后在载玻片中间滴加上番红染液进行复染,染色到1min左右再进行水洗。
(7)干燥:完成上一步后用吸水纸或者是纸巾吸掉载玻片上周围的水,或者是放在自然条件下干燥,又或者是放在酒精灯的上方烘干。
(8)镜检:将载玻片放置于显微镜上,利用油镜查看同时也要注意其细胞的形态和颜色。
3.2.2 生化实验
将培养的LB培养基培养成液体,利用接种针接種到微生物管中,倒插在泡沫上,搁置在37℃恒温的培养箱中培养24小时之后观察并进行记载。
3.3 DNA的提取
将上述培养的细菌培养物做成菌悬液,按照试剂盒说明进行提取。其中具体步骤如下:
(1)菌悬液1.5ml,10000rpm离心1min弃清液。
(2)沉淀中加200μl GA。
(3)加20μlProteinaseK溶液。
(4)加220μl GB 70℃水浴锅放10min离心除管内水珠。
(5)加220μl无水乙醇离心除管内水珠。
(6)得到沉淀或溶液加到吸附柱中,吸附柱放收集管中,12000rpm离心30秒废液弃去。
(7)加500μl GD, 12000rpm离心30秒倒废液。
(8)加600μl PW,12000rpm离心30秒倒废液吸附柱放到收集管内。
(9)重复操作步骤8。
(10)12000rpm离心2min弃去废液。
(11)加100μl TE室温放2-5min, 12000rpm离心2min。
3.4 基因组DNA的琼脂糖凝胶电泳检测
3.4.1制胶
琼脂糖称取0.24g放到小锥形瓶里,加入30ml的 1×TAE,振荡使琼脂糖和电泳缓冲溶液充分溶解,再将小锥形瓶放入到微波炉里使其加热溶解到透明状态。把电泳槽放在平的桌面上,将梳子垂直插放在电泳槽上固定,梳子的下端要和电泳槽保持有1mm的间隙。取出小锥形瓶后等到胶冷却到60℃左右,在胶液中加入5μl的Goldview染料,加完染料之后要混匀,混匀后要把琼脂糖倒入胶槽内,倒的时候的速度不应太快,否则会产生气泡。等待胶完全凝固后拔出梳子,将胶槽小心放入电泳槽里,样品孔在阴极。向电泳槽中加入1×TAE电泳缓冲溶液覆盖凝胶。
3.4.2 电泳
将5μl的DNA和1μl载样液利用移液枪吹打混匀之后,再将这混合液加入到倒好胶的槽里,加样时一定要注意,在每加完一个样的时候要改换一个枪头,避免污染,使其电泳的效果不太好,加样时也要避免将胶体刺破。在加完样之后把电泳槽的盖子盖上,接通电源,当跑到凝胶的2/3时即可取出。
3.5 PlpE基因的PCR扩增
3.5.1 引物的设计与合成
根据所查阅的文献用Primer premier5.0设计出来的引物预期产物的大小为1008bp,其引物序列为:
将设计好的引物进行短时间的离心,稀释后放置于-20℃的冰箱中保存(引物储存浓度为100μmol/L,使用浓度为10μmol/L)。
3.5.2 PCR扩增反应体系
准备PCR的反应溶液,取0.5mLPCR管,按照下列顺序加入各试剂:
4. 结果
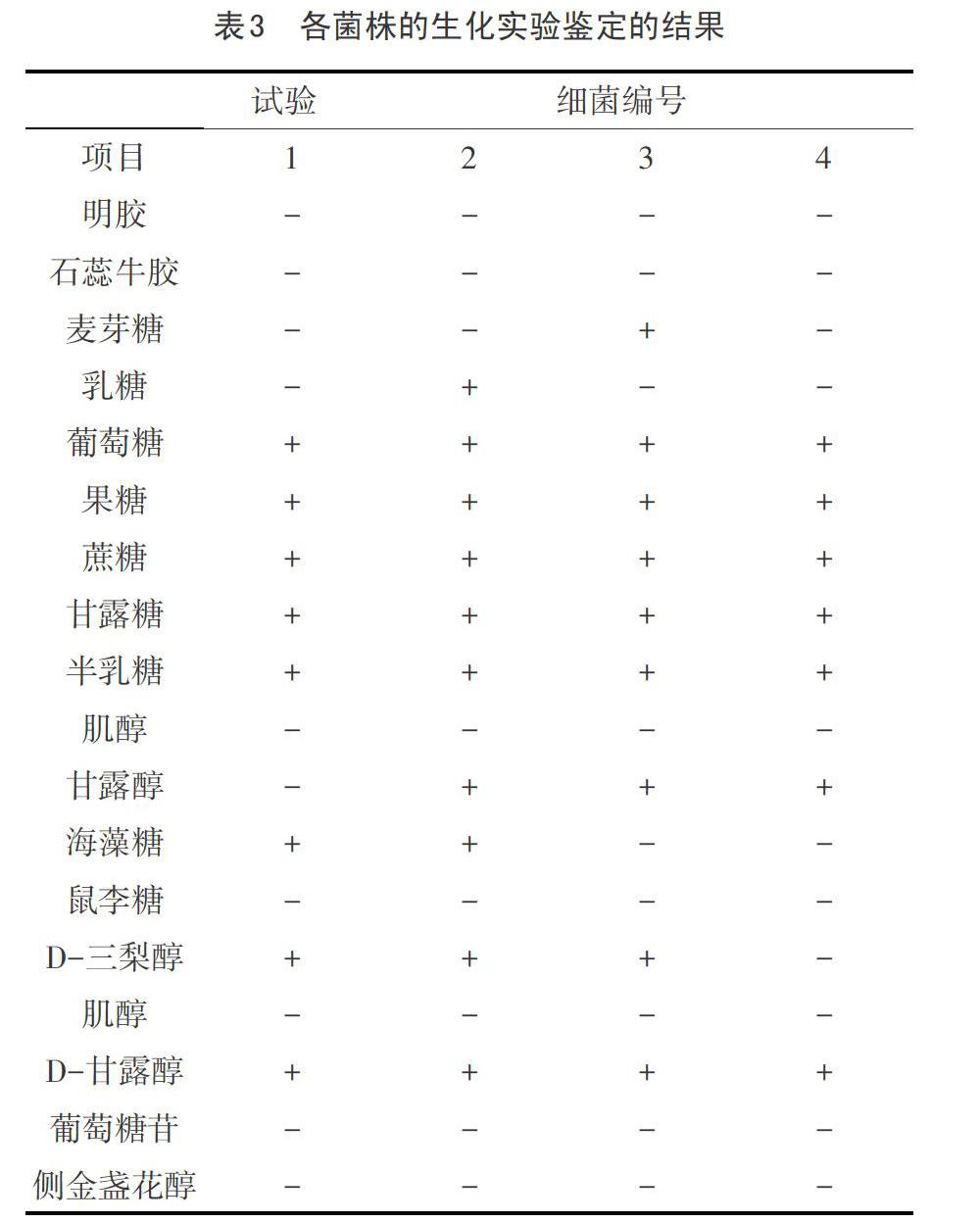
4.1生化试验结果:
取纯化培养的巴氏杆菌的菌株,分别接种生化试验培养基进行生化实验其结果见表1。
经对生化试验结果分析,发现与多杀性巴氏杆菌的生化特性基本一致,可以初步判定该菌是多杀性巴氏杆菌,
4.2 PlpE基因扩增结果:
在提取出来的DNA中加入利用Primer premier5.0设计出来的禽巴氏杆菌PlpE基因的引物,通过PCR技术扩增之后,利用琼脂糖凝胶电泳检测可看出扩增出来有明显清晰的条带,从条带上可以看出杂质较少并且没有明显降解。PlpE基因PCR扩增结果见图1
5. 分析讨论
5.1多杀性巴氏杆菌的血清型是比较复杂的,它们之间没有或者是有比较弱的交叉免疫原性,不同血清型其致病性有很大差异,更为关键的是该病的传播速度也是比较快的,且没有宿主的特异性,因此,传统检测方法的准确性(如细菌的分离培养与鉴定),与诊断人员的实验技能有直接关系,加之血清型不同致病性有很大差异,传统诊断技术的可靠性能也比较差,给疾病的快速准确诊断带来较大挑战,建立准确、快速、稳定的诊断方法十分必要。此次实验我们运用了PCR扩增技术进行PlpE基因检测,目的就是初步探讨该诊断方法的可靠性。通过此次的实验建立了PlpE的PCR扩增,其产物大小为1008bp,通过条件的优化且具有良好的特异性、敏感性,为禽巴氏杆菌的快速检测奠定了一定的条件基础。
5.2试验结果的准确性会受到许多因素的影响,在实际操作中需要注意的具体因素如下:
(1)在做细菌的培养时所有的操作都要在无菌的条件下进行,这是为了避免细菌中掺杂其他菌株,以导致影响下一步的实验顺利进行;在利用划线法时也要小心不要把平板内的琼脂刺破了,会影响细菌的正常生长;染色时要注意水洗的时候不要将细菌冲洗掉了,会影响细菌DNA的的提取,防止在显微镜下观察不到细菌;在进行生化实验过程中不能用手取药品,应该用药匙,若有液体洒出要利用抹布擦去。强酸强碱的废液不能直接倒入水池中,应该倒在废液缸中。过滤是要做好滤纸,以避免有气泡产生。试管加热时不要集中加热,也不能将试管对着人。在硫酸和硝酸等液体弄到身上是要立即使用水洗净,再利用碳酸钠液洗。
(2)细菌基因组DAN的提取是好是坏,主要取决于菌的扩大培养是否纯化,是否存在其他细菌,其他细菌存在的越少,说明细菌越纯。而DNA提取的效果也是直接影响PCR扩增技术以及进一步的实验。DNA提取的方法有很多种,为了确保之后的实验能够顺利进行,在本次实验中运用了DNA试剂盒来提取细菌的DNA,在提取DNA时为了防止DNA降解,操作时应尽量在低温下或者是冰块下进行。
(3)PCR扩增时要在一个没有DNA污染的干净的环境下进行,在操作的过程中都要戴手套,而且所有的试剂都要确保没有核酸和核酸酶的污染,所有的试剂或者是样品在准备的过程中都要使用一次性的灭菌的瓶子和管子,其他的玻璃器皿在洗干净之后都要高压灭菌,做好自我保护的措施。
6. 结论
禽多杀性巴氏杆菌是对畜禽养殖业影响较大的病原菌,尤其对养鸡产业影响十分巨大,如何快速准确诊断十分必要,通过建立PCR技术快速扩增检测PlpE基因,可以实现对禽巴氏杆菌病的快速诊断,同时也对了解细菌菌株对动物体的危害性和对疾病的免疫效果有所帮助。
参考文献
[1]Jin Ru Wu.Jui Hung Shien,Happy K. Shien.Protective immunity conferred by recombinant Pasteurella multocida lipoprotein E(PlpE) [J].Vaccine,2007,25:4140-4148
[2]崔卫涛,胡思顺,王延昭,周晓芬,李自力,肖运才,毕丁仁.《禽多杀性巴氏杆菌脂蛋白E基因的原核表达及其对小鼠的免疫原性》.[J],武汉,华中农业大学动物医学院/农业微生物学国家重点实验室,2011(04),第1-3页
[3]刘用成 .《食品微生物检验技术》.[M ],北京: 中国轻工业出版社,2015,第79-80页
[4]黄海燕.《猪源多杀性巴氏杆菌plpE基因的克隆、原核表达及其免疫原性研究》.[J].四川农业大学,2012,第14-23页
[5]吾鲁木汗·那孜尔别克; 陈亮; 卡马勒别克·吾买尔; 严芳; 恩特马克·布拉提白.《禽多杀性巴氏杆菌P1059成熟黏附蛋白的原核表达、纯化和抗原性检测》 .[J],吉首,中国生物工程杂志,2008(04),第1页
[6]吴清民,主编.《动物传染病学》[M].北京:中国农业出版社,2002.
[7]王帅涛,宫强,彭永刚,程茗,秦翠丽,张敏,牛明福.《禽多杀性巴氏杆菌外膜蛋白和脂多糖的免疫保护效果》.[J],河南,中国预防兽医学报,2011(08)
[8]王娉、张富春.《多杀性巴氏杆菌毒力因子的研究进展》[J],地方病通报,2006(02)
[9]黄园媛.《牛源A型多杀性巴氏杆菌plpE基因的克隆表达及DNA疫苗的研究》.[J],西南大学,2013
[10]石少华.《禽巴氏杆菌病的流行特点及剖检变化》.[J] 《养殖技术顾问》,2011\
[11]宫强.《禽多杀性巴氏杆菌基因组表达文库的构建及其免疫效果》[J] 《中国兽医学报》,2013
[12]牛思博; 姜志剛; 德艳艳; 于力.《重组牛源荚膜A型多杀性巴氏杆菌脂蛋白E的免疫保护性研究》[J],中国预防兽医学报,2013,第2页
[13]龙青山《牛源荚膜血清A型多杀性巴氏杆菌部分毒力相关基因研究》[J],西南大学,2013

