miR-31-5p靶向Notch1调节骨关节炎软骨细胞增殖和凋亡的作用
文良华,陈世华,寿折星
(1.荆州市公安县中医院骨科,湖北 荆州 434300;2.华中科技大学同济医学院附属协和医院中医科,湖北 武汉 430022)
骨关节炎(osteoarthritis,OA)是一种常见的退行性疾病,常伴随疼痛、短暂晨僵和骨擦音,严重影响患者工作和生活[1-2]。目前的研究显示,多种因素参与骨关节炎的发病,如遗传、生物学紊乱和生物力学等,但具体机制尚不明确[2-3]。临床中,骨关节炎的药物主要针对症状进行消炎镇痛等治疗,缓解疾病进展。因此,明确其具体机制有助于针对性治疗。
微小核糖核酸(micro ribonucleic acids,miRNAs)是一组存在于生物体的非编码RNA分子,其长度约22个核苷酸[4]。miRNAs通过结合mRNAs的3'端非翻译区,调节蛋白表达,进而在多种生理和病理过程中发挥作用[5]。研究表明,miRNAs在骨关节炎中存在差异表达,既有上调表达,又有下调表达。最近一项研究显示,miR-31-5p在骨关节炎患者分离的软骨间充质干细胞中显著下调[6]。然而,miR-31-5p在骨关节炎中的作用尚未见报道。本研究旨在明确miR-31-5p对骨关节炎软骨细胞的增殖和凋亡的具体作用。
1 资料与方法
1.1 实验动物 12只雄性Sprahur-Dawley(SD)大鼠(11~12周龄)购买于长江大学医学院科研实验中心,随机分为两组:sham组和OA组,每组各6只。涉及动物的操作遵照长江大学实验动物管理和使用委员会的相关规定。
1.2 试剂与仪器 戊巴比妥钠(全式金生物,中国),苏木素伊红染色试剂盒和改良番红O-固绿染色试剂盒(索莱宝,中国),胰酶和Ⅱ型胶原酶(懋康生物,中国),胎牛血清和DMEM培养基(Gibco,美国),miRNeasy Serum/Plasma试剂盒和miRNeasy Mini试剂盒(Qiagen,德国),TRIzol(Ambion,美国),SYBR Premix Ex Taq Ⅱ试剂盒(Takara,日本),引物、miR-31-5p mimics和inhibitor、Notch1 siRNA、Notch1过表达质粒、载有野生型Notch1和突变型Notch1的载体pGL3(生工,中国),Lipofectamine 3000(Invitrogen,美国),重组大鼠白细胞介素(interleukin,IL)-1β、CCK-8试剂盒、Annexin V-FITC凋亡检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、小鼠抗β-actin一抗和辣根过氧化物酶耦合二抗(碧云天,中国),PVDF膜(Millipore,美国),兔抗Notch1一抗(CST,美国),荧光素酶报告基因检测试剂盒(Promega,美国),倒置显微镜(奥林巴斯,日本),流式细胞仪(Accuri C6,美国),反转录仪、实时定量PCR仪、电泳仪、转膜仪、化学发光仪和酶标仪(Bio-Rad,美国)。
1.3 方法
1.3.1 OA大鼠模型建立 OA大鼠模型的建立主要参照Hulth法[7]。用3%戊巴比妥钠(30 mg/kg)静脉注射麻醉大鼠,常规消毒后,在其两侧后肢行纵向切口2cm,分离并切断交叉韧带和内侧副韧带,完整去除内侧半月板,不损伤关节软骨面,术后不固定伤肢,对大鼠分笼饲养。对照组仅进行皮肤切开术和缝合。
1.3.2 苏木素-伊红染色法 取大鼠关节处组织进行石蜡包埋,切片后常规脱蜡至水;苏木素染色10 min后洗片,0.7%盐酸乙醇分化5 s;洗片后氨水返蓝、水洗,伊红染色5 min;水洗后经乙醇、二甲苯处理,烘干封片。
1.3.3 番红O-固绿染色法 将石蜡包埋的大鼠关节处组织切片进行脱蜡至水;用Weigert染液染色5 min,酸性乙醇分化液分化15 s;洗片后用固绿染液染色5 min;再次洗片后用番红O染液进行染色2 min;最后经洗片、乙醇脱水后,二甲苯透明,树脂封片。
1.3.4 原代细胞分离培养 无菌条件下,关节软骨剪碎,用0.25%胰酶和0.2%Ⅱ型胶原酶消化4 h;用滤网过滤后进行离心(1 000转/min)5 min,含10%胎牛血清的DMEM培养基重悬,常规培养。
1.3.5 实时荧光定量PCR 血清miRNAs的提取用miRNeasy Serum/Plasma试剂盒,细胞微小RNA用miRNeasy Mini试剂盒提取,组织和细胞总RNA用TRIzol提取,经反转录后获得cDNA后,用SYBR Premix Ex Taq Ⅱ试剂盒进行实时荧光定量,程序设定为95℃、10 min,然后40个循环为95℃、30 s,55℃、30 s,72℃、30 s。U6作为微小RNA内参,Gapdh作为mRNA内参,采用2-ΔΔCT方法计算相对表达。rno-miR-31-5p:正义链5'-TATTCATAGGCAAGATGCTGGC-3',反义链5'-TATGGTTGTTCTCGTCTCCTTCTC-3'。U6:正义链5'-AGGGGCCATCCACAGTCTTC-3',反义链5'-AACGCTTCACGAATTTGCGT-3'。IL-6:正义链5'-TGCTCAGAAGGGAGAGTCTGA-3',反义链5'-TTGCTCCAAGCTTACCGTGA-3'。MMP-13:正义链5'-CTGGGCCCTGAATGGGTATG-3',反义链5'-TTGCAAAACCAGTGCAACTAC-3'。Gapdh:正义链5'-GGCGGAGATGATGACCCTTT-3',反义链5'-GCCCAGGGCTGACTACAAAC-3'。
1.3.6 细胞活力测定 原代软骨细胞接种于96孔板,每孔细胞数约5 000个,miR-31-5p mimics(1 μL)、miR-31-5p inhibitor(1μL)、Notch1过表达质粒(1.2 μL)、Notch1 siRNA(1.5 μL)利用Lipofectamine 3000转染至原代软骨细胞48 h后,给予/不给与IL-1β(5 ng/mL)刺激24 h,然后更换培养,每孔100 μL培养基加入10 μLCCK-8反应液,培养2 h后于酶标仪测定,波长设定450 nm。
1.3.7 细胞凋亡测定 原代软骨细胞接种于6孔板,当细胞密度约为40%,将miR-31-5p inhibitor(10 μL)或inhibitor NC(10μL)利用Lipofectamine 3000转染至原代软骨细胞;48 h后收集细胞,离心后PBS重悬;加入5 μL Annexin V-FITC,轻轻混匀,避光孵育10 min;再加入10 μL碘化丙啶染液,避光孵育15min,随后在流式细胞仪进行样本分析。
1.3.8 荧光素酶报告基因实验 荧光素酶报告基因实验在HEK-293T细胞中进行。HEK-293T细胞接种于96孔板,约5 000个/孔,将载有野生型Notch1的pGL3(1μL)与miR-31-5p mimics(1μL)、载有突变型Notch1 pGL3(1μL)与miR-31-5p mimics(1μL)、载有野生型Notch1 pGL3(1μL)与mimics NC(1μL)、载有突变型Notch1 pGL3(1μL)与mimics NC(1μL)分别利用Lipofectamine 3000共转染至HEK-293T细胞内,48h后用Bio-GloTM Luciferase Assay System检测,分析数值。
1.3.9 蛋白免疫印迹 收集处理过的原代软骨细胞,用RIPA裂解,BCA法蛋白浓度定量;蛋白样品用SDS-PAGE凝胶分离,然后转至PVDF膜;PVDF膜用5%脱脂奶粉封闭2 h;抗Notch1和β-actin一抗在4度过夜孵育;TBST洗膜后,用辣根过氧化物酶耦合的二抗在室温孵育PVDF膜2 h;ChemDocTM XRS+System仪器进行发光成像,并用Image Lab软件进行灰度分析。

2 结 果
2.1 miR-31-5p在OA下调表达 在大鼠术后6周,我们取大鼠关节软骨,明显观察到软骨面异常损伤(见图1a)。我们对sham组和OA组软骨组织进行苏木素-伊红染色,发现OA模型组软骨细胞明显肥大,并且排列紊乱(见图1b)。此外,番红O-固绿染色的结果显示,OA模型组大鼠的关节软骨面出现侵蚀现象(见图1c)。随后,我们检测大鼠血清的miR-31-5p表达水平,qRT-PCR结果显示,OA模型大鼠血清的miR-31-5p含量低于对照组(见图1d)。在软骨分离的原代细胞中,OA模型组miR-31-5p的表达水平同样低于对照组(见图1e)。此外,IL-1β刺激的正常原代软骨细胞导致miR-31-5p的表达显著下调(见图1f)。体内体外实验结果提示,miR-31-5p可能在骨关节炎软骨细胞的生物学行为中发挥重要作用。

a 大鼠OA造模的关节大体形态学改变 b 大鼠OA造模的HE组织染色(HE,×200) c 大鼠OA造模的番红O-固绿染色(番红O-固绿,×200)

d miR-31-5p在大鼠血清中的表达 e miR-31-5p在造模后分离的原代软骨细胞中的表达 f IL-1β刺激正常原代软骨细胞后的miR-31-5p表达
注:*P<0.01;**P<0.05;***P<0.001
图1 miR-31-5p在OA下调表达结果
2.2 miR-31-5p调节软骨细胞生物学功能 将miR-31-5p mimics转染至正常原代软骨细胞,其活力高于转染mimics NC的细胞(图2a);与之相反,miR-31-5p inhibitor导致细胞活力显著降低(图2b)。这些结果提示miR-31-5p调节软骨细胞的增值能力。流式细胞术的结果显示,miR-31-5p inhibitor增加了细胞凋亡率(图2c)。此外,IL-1β抑制软骨细胞活力,当同时转染了miR-31-5p mimics后,细胞活力增加(图2d)。而miR-31-5p inhibitor会进一步增加IL-1β的抑制作用(图2e)。此外,我们观察到OA模型组关节软骨组织的IL-6和MMP-13表达显著升高(图2f~g)。在正常原代软骨细胞中转染miR-31-5p inhibitor后,其IL-6和MMP-13的mRNA水平增加(图2h~i)。这些结果表明,miR-31-5p不仅影响软骨细胞活力,还参与调节炎症因子和基质金属蛋白酶的表达。

a 原代软骨细胞转染miR-31-5p mimics后的细胞活力变化 b 原代软骨细胞转染miR-31-5 pinhibitor后的细胞活力变化 c 转染miR-31-5 pinhibitor的原代软骨细胞的凋亡率

d IL-1β刺激下,正常原代软骨细胞转染miR-31-5p mimics的活力变化 e IL-1β刺激下,正常原代软骨细胞转染miR-31-5 pinhibitor的活力变化 f 对照组和OA组关节软骨组织IL-6的mRNA表达

g 对照组和OA组关节软骨组织MMP-13的mRNA表达 h 转染miR-31-5p inhibitor的原代软骨细胞中IL-6的mRNA表达 i 转染miR-31-5p inhibitor的原代软骨细胞中MMP-13的mRNA表达
注:*P<0.05;**P<0.001;***P<0.01
图2 miR-31-5p调节软骨细胞生物学功能
2.3 Notch1是miR-31-5p的直接靶点 我们通过TargetScanHuman7.2(http://www.targetscan.org/vert_72/)预测发现,Notch1是miR-31-5p的潜在靶点,而且其结合位点在脊椎动物中高度保守。荧光素酶报告基因实验证实,共转染野生型Notch1和miR-31-5p mimics的荧光素酶活性显著减低(图3a)。蛋白免疫印迹证实,转染了miR-31-5p mimics的正常软骨细胞,其Notch1的蛋白水平降低(图3b)。为了证实Notch1在miR-31-5p下游发挥作用,我们进行如下实验。图3c的结果显示,在IL-1β的作用下,miR-31-5p mimics诱导的细胞活力增加被共转染的Notch1过表达质粒抑制。同样,在IL-1β的作用下,miR-31-5p inhibitor致使细胞活力进一步降低,可被Notch1 siRNA部分恢复(图3d)。
3 讨 论
软骨细胞是软骨组织中特有细胞,有助于维持关节软骨的稳态。大量研究表明,软骨细胞过度凋亡是OA进展的关键因素[8-11]。OA常高发于老年人和关节创伤人群[2-3,12]。尽管目前已经证实多种因素,如非编码RNA、分子信号通路异常和遗传等参与OA的发生发展,但其具体机制仍然不明确,为OA的治疗带来极大不便。miRNAs属于内源性非编码RNA分子,具有调控蛋白表达的作用,进而影响细胞的增殖、凋亡等生物学功能,可作为多种疾病的靶点[5,13]。最近大量研究证实,不同的miRNAs在骨关节炎的发病机制中具有双向调节作用。Chen等[14]发现,miR-103在OA患者中显著高表达;离体实验结果表明,miR-103抑制软骨细胞的增殖和成熟,提示miR-103促进OA进展。另有研究显示,miR-495在OA患者软骨中上调,通过抑制AKT1/mTOR信号通路的激活而促进软骨细胞凋亡和老化,进而导致OA加重[15]。除了上调表达,有些miRNAs在OA中出现低表达。最近的一项研究揭示,miR-27a在膝关节骨关节炎中呈现下调,并且与Polo样激酶2(Polo like kinase 2,PLK2)的表达负相关;增加miR-27a水平可明显降低PLK2表达,从而抑制滑膜血管生成和软骨细胞凋亡,缓解OA[16]。Guan等[12]发现,低表达的miR-146a与年龄相关性骨关节炎和创伤性骨关节炎相关,过表达miR-146a明显抑制OA的炎性指标,并缓解病情加重。而我们的研究表明,OA大鼠模型和IL-1β诱导的细胞模型均显示miR-31-5p的表达下降,抑制miR-31-5p导致软骨细胞凋亡增加。此外,我们还发现,OA模型组和转染miR-31-5p inhibitor的原代软骨细胞中均出现炎症因子IL-6和基质金属蛋白酶MMP-13的表达上调。MMP-13促进胶原蛋白Ⅱ的降解,加速骨关节炎进展。这些结果提示,miR-31-5p调节软骨细胞的生物学功能。同时,我们证实Notch1在miR-31-5p的下游发挥作用。
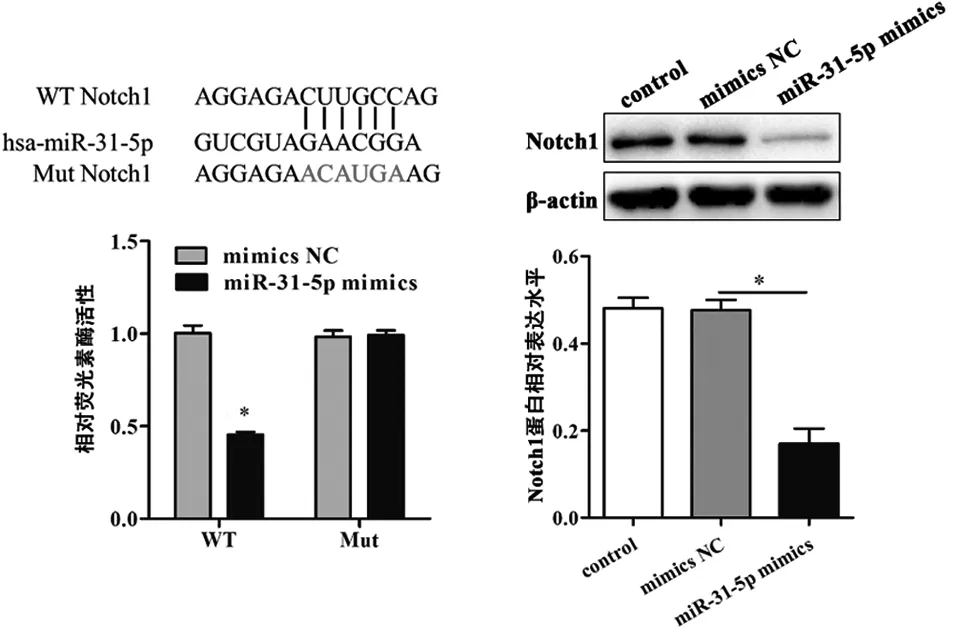
a 荧光素酶报告基因实验验证Notch1是miR-31-5p直接靶点 b 转染miR-31-5p mimics后原代软骨细胞Notch1的蛋白表达及灰度分析
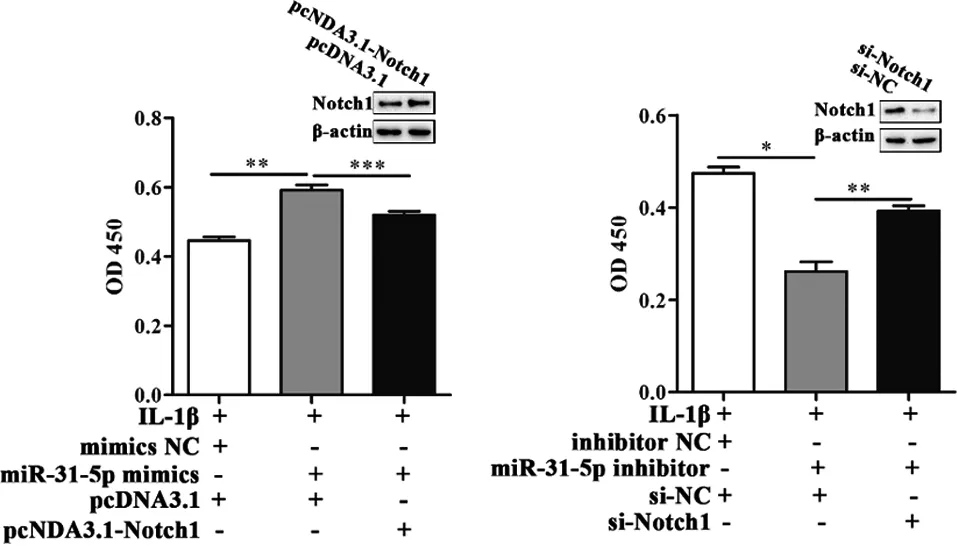
c IL-1β刺激下,正常原代软骨细胞共转染miR-31-5p mimics和Notch1过表达质粒后的活力变化 d IL-1β刺激下,正常原代软骨细胞共转染miR-31-5p inhibitor和Notch1 siRNA后的活力变化
注:*P<0.001;**P<0.01;***P<0.05
图3 Notch1在miR-31-5p下游调节软骨细胞生物学行为
Notch1是调节细胞增殖、分化、凋亡的重要分子。兔OA模型中,Notch1在关节软骨组织中表达增加,同时伴有促凋亡分子Bax上调;抑制Notch1可激活抗凋亡分子Bcl-2[17]。此外,Notch1信号通路与骨关节炎软骨细胞去分化相关[18]。Mead等的研究提示,Notch1信号失活有助于软骨细胞增殖,而适度Notch1信号对于正常软骨细胞祖细胞的增殖和肥大软骨细胞向骨分化的正常进展至关重要[19]。抑制Notch1导致NF-κB p65向细胞核转位减少,以此降低炎症因子的表达;同时,抑制Notch1可拮抗IL-1β诱导的炎症反应,保护软骨细胞不被损伤[20]。我们发现,Notch1是miR-31-5p的直接靶点,miR-31-5p mimics对软骨细胞的促增殖作用被Notch1过表达逆转。
综上所述,我们通过体内外实验明确miR-31-5p在OA中显著下调表达,细胞学实验证实增加miR-31-5p具有保护软骨细胞的作用,进一步发现了miR-31-5p通过抑制Notch1实现其促增殖和抗凋亡的功能。这些结果初步探讨了miR-31-5p在OA进展中发挥重要作用,为进一步明确OA的发病机制提供理论依据。

