健骨颗粒含药血清调控miR-141对小鼠骨髓间充质干细胞成骨分化的影响
张楚天 张文明,2 林燕萍* 魏振朴 杨娟 张志恒 孙攀 王志强
1.福建中医药大学中西医结合研究院,福建 福州 350122 2.河南省洛阳正骨医院郑州院区,河南 郑州 450016 3.福建中医药大学针灸学院,福建 福州 350122
骨质疏松症是一种发病广泛而又隐蔽的退行性疾病,我国骨质疏松患者近九千余万,其发病诱因多样而绝经后骨质疏松症是最常见的病型,所占比例高达80%[1-2]。骨质疏松症的病理机制是骨骼吸收-重建动态平衡失调引起全身骨量降低和骨骼细微结构恶化[3],骨髓间充质干细胞(BMSCs)是骨髓基质内具有多种分化潜能的干细胞,作为成骨细胞的来源细胞之一,是影响骨骼吸收-重建动态平衡的重要因素。MiRNA是细胞内普遍存在的小分子RNA,在基因表达和传递中有着广泛作用,当敲除小鼠BMSCs内一个miRNA合成必需的核酸内切酶后,BMSCs失去成骨分化功能[4],这一实验提示miRNA与成骨分化有着相关性,进一步研究发现miRNA在BMSCs分化的各个阶段均有着不同的影响[5]。Runx2是BMP信号通路中的关键成骨转录因子,其表达量被Dlx5及其同源异形基因Msx2共同调控,同时Runx2可以直接调控BMSCs细胞成骨分化[6]。课题组前期研究结果显示:miR-141通过对Dlx5/Msx2/Runx2信号通路的负性调控作用来影响BMSCs的成骨分化。本文基于以上基础,使用传统补肾健脾方剂健骨颗粒提取含药血清干预去卵巢模型小鼠BMSCs,从miR-141及其下游Dlx5/Msx2/Runx2信号通路的角度出发,探究健骨颗粒影响BMSCs成骨分化的可能机制。
1 材料和方法
1.1实验药物
健骨颗粒组方:煅狗骨、山茱萸、淫羊藿等药物。药物原材料福建省药材公司,成药由福建中医药研究院中试车间加工制备,颗粒剂含原生药比率2.9∶1。
1.2实验细胞及动物
雌性C57小鼠10只(清洁级),4周龄,体重23±2 g,购至中科院动物实验中心(上海),动物合格证编码:SCXK(沪)2013-0005,用于BMSCs细胞提取。雌性SD大鼠30只(SPF级),3月龄,体重265±20 g,购至中科院动物实验中心(上海),动物合格证编码:SCXK(沪)2012-0002,用于含药血清制备。以上动物均饲养及实验于福建中医药大学动物实验中心SPF级实验室(合格证编码:闽SYXK 2009-0001)。
1.3主要实验材料和试剂
青/链霉素、胰蛋白酶、PBS缓冲液由Hyclone公司提供,胎牛血清、α-MEM培养基由Gibco公司提供,CD29、CD34、CD44、CD45单克隆抗体由Abcam公司提供,茜素红由Sigma公司提供,ALP检测试剂盒由南京建成公司提供,Dlx5、Msx2、Runx2抗体由Santa Cruz公司提供,β-actin、鼠二抗、兔二抗、TRIZOL由北京全氏金生物技术有限公司提供,封闭液、5×蛋白上样缓冲液、一抗稀释液、SDS-PAGE凝胶试剂盒、SDS-PAGE电泳缓冲液、BCA蛋白浓度测定试剂盒、PMSF、RIPA、 Beyo plus超敏化学发光试剂盒由碧云天生物技术研究所提供,反转录试剂盒,SYBR Premix Ex TaqTM PCR Kit由大连宝生物公司提供。
1.4主要实验仪器
倒置相差显微镜由TKO光学仪器株式会社提供,流式细胞仪由BD公司提供,Q-PCR仪由美国ABI公司提供。
1.5实验方法
1.5.1含药血清制备:30只三月龄大鼠,分别健骨颗粒和生理盐水灌胃1周,通过大鼠体重按2 g/kg计算药量,生理盐水每日灌服量为2 mL。腹主动脉采全血后3 000 r/min离心15 min取上层血清,56 ℃水浴30 min,过滤除菌,-20 ℃冷冻备用。
1.5.2BMSCs细胞的培养和鉴定:卵巢切除法造摸,microCT三维图像采集分析骨质疏松指标数据确认小鼠建模成功后取双侧股骨,α-MEM培养基(10% FBS)冲出骨髓,制备单细胞悬液置于37 ℃,5% CO2的培养箱培养10 d,待细胞铺满瓶底后弃培养液以1.25%胰酶消化传代,镜下观察BMSCs形态变化。取第三代BMSCs制成单细胞悬液,加入抗体上流式细胞仪检测。
1.5.3含药血清诱导BMSCs分化情况:取第3代BMSCs加入成骨诱导培养液(β-磷酸甘油10 μmol/L、地塞米松10 μmol/L、维生素C 50 μmol/L、10% FBS)和10%浓度的含药血清和空白血清成骨诱导,分别在诱导后第3、8、13天镜下观察两组细胞形态变化;第8天,行ALP染色及定量;第13天,茜素红染色检测钙盐结节分布情况。
1.5.4实时荧光定量PCR检测miR-141及DLx5、Msx2、Runx2的基因表达情况:成骨诱导第3代BMSCs,第13天提取总RNA,反转录后与相应的引物(如表1)结合,上机,反应均为20 μL体系。以U6作为miR-141的内参,β-actin作为Runx2、Dlx5、Msx2 mRNA的内参,校正各组样品后对基因相对表达量进行计算。

表1 引物序列表Table 1 Primer sequence table
1.5.5Western blot检测DLx5、Msx2、Runx2的蛋白表达情况:提取BMSCs总蛋白并用BCA法测取蛋白浓度,每泳道上样蛋白样品和预染蛋白标准品,电泳,电泳结束后湿转法转移胶上蛋白到PVDF膜。转膜后将膜浸入封闭液,摇床上孵育2 h。加入一抗4 ℃过夜,取出PVDF膜,浸入TBST摇洗3次。加入二抗室温下孵育1 h,取出PVDF膜,浸入TBST摇洗3次。显影,使用Image Pro-plus program version 5.0图象分析系统分析条带。
1.6统计学处理
2 结果
2.1细胞表型鉴定
BMSCs表型鉴定结果(见图1):CD29(88.8%)、CD44(94.3%)表达阳性;CD34(1.54%)、CD45(1.04%)表达阴性。
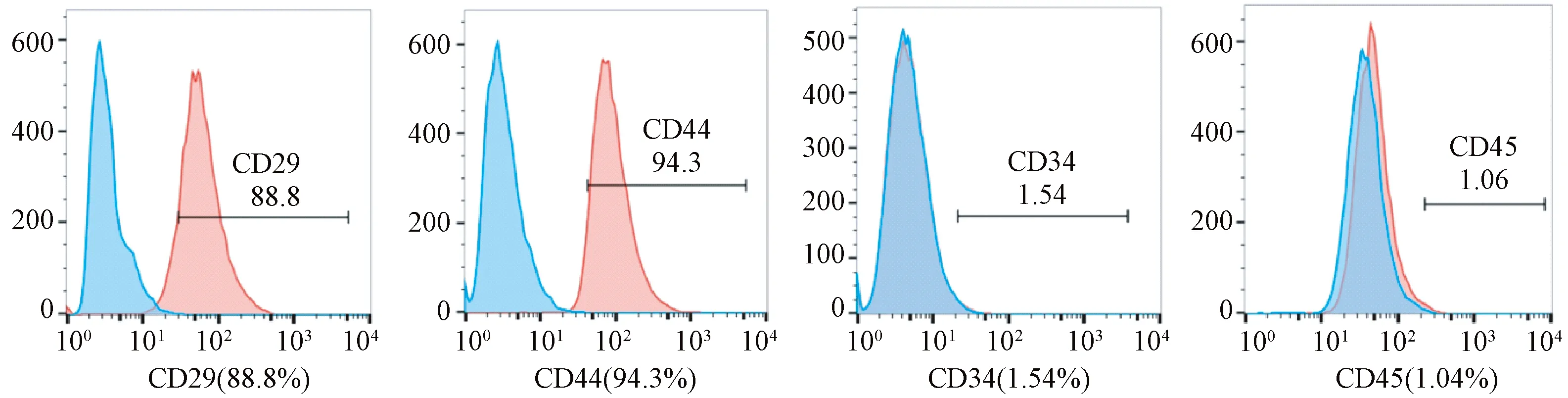
图1 BMSCs细胞表型鉴定结果Fig.1 BMSCs cell phenotypic identification results
2.2BMSCs成骨分化结果
第2天,两组细胞数量均稀少且无明显差异,细胞形状呈梭形或不规则形;第4天,两组细胞数量有所增加,且些许细胞出现成对核,细胞形状为圆形或不规则形的多核细胞出现,空白血清组多核细胞出现较少;第6天,细胞数量密集,含药血清现成群的细胞开始聚集且在群落中散布有结晶颗粒,而空白血清组细胞数量明显低于含药血清组,且细胞群落间结晶群稀疏(见图2)。

图2 BMSCs成骨分化结果Fig.2 BMSCs osteogenic differentiation results
成骨诱导后第8天进行ALP染色,空白血清为浅蓝色,含药血清组显示蓝紫色(见图3)。ALP定量检测显示,含药血清组的ALP定量结果显著高于空白血清组(P<0.05)。第13天行茜素红染色,染色后有深红色钙化结节散布,但空白血清组钙化结节较少,呈点状分布,无大的钙化结节;含药血清组钙化结节明显增多,呈珠状广泛分布,有大面积的甚至成片连接的钙化结节出现(见图4)。
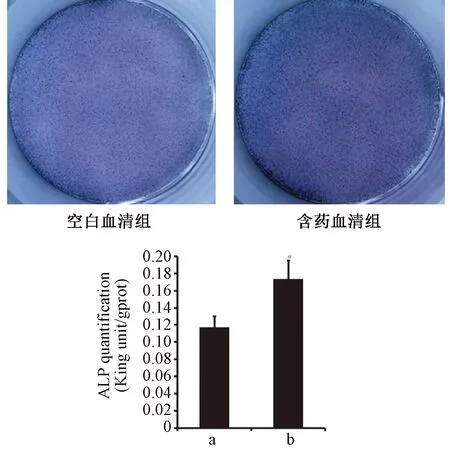
图3 ALP染色及定量结果注: a 空白血清组; b 含药血清组;与空白血清组比较,*P<0.05。Fig.3 ALP staining and quantitative results
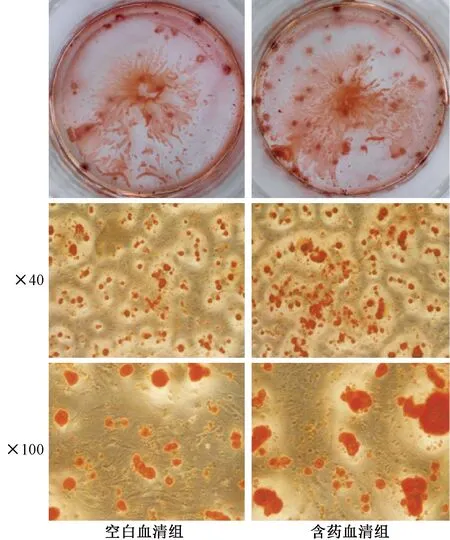
图4 茜素红染色结果Fig.4 Alizarin red staining results
2.3RT-PCR检测成骨基因表达结果
RT-PCR检测miR-141及Dlx5、Msx2、Runx2的基因表达情况(见表2):含药血清组和空白血清组比较,含药血清组miR-141及Msx2的基因表达较空白血清组明显下降(P<0.01),Dlx5、Runx2的基因表达显著升高(P<0.01)。
表2RT-PCR检测成骨基因表达结果
Table2Detection of osteogenic gene expression results by RT-PCR

组别miRNA-141Dlx5Msx2Runx2空白血清组1.0001.0001.0001.000含药血清组0.500±0.021∗∗2.390±0.106∗∗0.330±0.014∗∗3.620±0.241∗∗
注:与空白血清组比较:*P<0.05,**P<0.01。
2.4Western blot检测成骨蛋白表达结果
Western blot检测成骨诱导第13天DLx5、Msx2和Runx2蛋白表达情况:含药血清组Msx2较空白血清组稍有下降(P<0.05),而Dlx5和Runx2的蛋白表达相对升高(P<0.01),三者的蛋白变化情况与RT-PCR结果基本一致(见图5,表3)。

图5 Western blot检测成骨蛋白表达结果Fig.5 Western blot analysis of osteogenic protein expression results
表3Western blot检测成骨蛋白表达结果
Table3Western blot analysis of osteogenic protein expression results

组别Dlx5Msx2Runx2空白血清组0.330±0.0120.800±0.0250.532±0.046含药血清组0.430±0.019∗∗0.498±0.096∗0.830±0.043∗∗
注:与空白血清组比较:*P<0.05,**P<0.01。
3 讨论
BMSCs作为成骨细胞的主要来源细胞之一在骨质疏松的研究中有着至关重要的地位,雌激素降低影响着BMSCs的命运,其成骨分化降低导致骨量丢失是绝经后骨质疏松的病理机制,因此BMSCs可以作为阐释补肾健脾类中药治疗绝经后骨质疏松机理的切入点[7]。中药或复方水提取液干预体外细胞是中药研究的常用方法,但是这种方法的严谨性目前存在争议,主要矛盾集中于药物在体内代谢后的产物不确定性和药物成分自身的复杂性,这两点的存在会一定程度上影响实验结果的准确性[8]。含药血清就是对以上不足的改进,通过模拟体内代谢的方法减少了实验的误差,使实验更加科学[9]。miRNA是维持干细胞特征和特性的关键遗传因子[10],对干细胞生长和分化的各个阶段有着综合性的调节作用[11]。研究发现miR-141-3P作为Wnt靶基因通过Wnt通路抑制人间充质干细胞的增殖和成骨分化[12],同时课题组前期研究也明确了miR-141与BMP/Smad信号通路及骨代谢中间的关联[13]。因此,以miRNA为“钥匙”来揭示中医药抗绝经后骨质疏松症的机理成为了当前研究的重心[14]。
流式细胞计数法鉴定提取的BMSCs细胞显示:造血干细胞及白细胞表型的CD 34、CD 45表达为阴性,细胞间充质干细胞表型的CD 29、CD 44表达均呈阳性,既全骨髓培养法提取的细胞满足实验需要。课题组前期研究表明,健骨颗粒有促进成骨分化的功效,且含药血清浓度为10%时干预效果最佳,该功效归因于健骨颗粒的类植物雌激素样作用[15]。此类作用在成骨分化的多个阶段均有体现,ALP染色及定量的实验中含药血清组明显优于空白血清组,同时茜素红染色结果同ALP染色结果一致,进一步印证健骨颗粒的促成骨分化作用。该作用可能归功于健骨颗粒组方中淫羊藿、煅狗骨、山茱萸等补肾壮骨中药,朱晓峰等[16]通过研究传统补肾阳中药淫羊藿发现,其主要药理成分淫羊藿苷在体内可代谢为淫羊藿素,淫羊藿素可以发挥类雌激素样作用激活BMP/Smad信号通路促进成骨细胞分化。Smads蛋白作为胞内信号传递的中介因子,是BMP 信号传动及转导的关键一环,Smads蛋白整合多种不同信号进而转换成一种总的效应来调节目标靶基因的转录[17]。BMP与细胞表面受体结合后,细胞内Co-Smad与Phosho-R-Smad形成复合物后进入细胞核内结合于DNA序列上,协同其他转录因子相互作用,促进Dlx5表达,而Dlx5增高可以激活Runx2的表达[18],而这一系列反应中的共激活因子可能就是miR-141类的短基因片段[19]。RT-PCR结果显示,含药血清组miR-141及Msx2的基因表达量明显低于空白血清组,而Dlx5、Runx2的基因表达结果刚好相反,Western blot检测结果同RT-PCR结果一致,说明健骨颗粒可以通过影响miR-141表达水平来调节BMSCs成骨分化,即健骨颗粒的类雌激素作用可以抑制miR-141的表达,从而降低miR-141对Dlx5表达的抑制,高表达的Dlx5竞争结合能力增强,相对地降低了其同源异形基因Msx2对Runx2表达的抑制作用,Runx2表达水平升高促进BMSCs成骨分化。
总之,健骨颗粒可以通过抑制BMSCs中miR-141的内源性表达水平来缓解去卵巢早期雌激素急剧下降导致的Dlx5/Msx2降低,进而调高的Runx2表达,促进成骨分化,达到防治绝经后骨质疏松的目的。

