大肠杆菌菌毛基因多重PCR 检测方法的建立与初步应用
孙思萌,侯美佳,冯启峥,石 博,刘嘉利,师东方
(东北农业大学 动物医学学院,黑龙江 哈尔滨 150030)
感染性腹泻是引起幼畜死亡的主要疾病,由产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)引起的仔猪黄痢和仔猪白痢、产志贺毒素大肠杆菌(Shiga toxin-producing Escherichia coli,STEC)引起的猪水肿病和断奶仔猪腹泻严重影响仔猪健康[1-2]。ETEC 和STEC 通过菌毛(也称为黏附素)黏附在宿主小肠绒毛上皮细胞,增殖并产生肠毒素(ST、LT)和志贺毒素变异体(Shiga toxin variantsⅡ,Stx2e),引发腹泻、肠毒血症,水肿和神经症状[3-4]。菌毛能够与宿主肠黏膜中的特异性受体结合使细菌能够抵御肠道蠕动引发的冲刷作用,这是ETEC 致病的先决条件[5-6]。流行病学调查结果显示,大肠杆菌(E.coli)携带的黏附素基因与毒素基因呈正相关性,60%带有毒素基因的E.coli 菌株均表达黏附素基因[7]。除黏附作用外,菌毛还具有其它生物学功能。研究表明,F4 菌毛蛋白可诱导Th17 相关基因的表达上调和B 细胞类别转换,其主要亚基faeG 参与细菌生物膜的形成和细胞间的信号传导——群体感应(Quorum sensing,QS)[8-9]。因此,对幼畜腹泻物中分离的E.coli 鉴定时,除检测肠毒素基因外,同时也要对分离菌的菌毛基因进行检测,有助于较全面地了解致病菌的生物学特性和流行病学溯源,对其致病机制和免疫机制研究也具有重要意义。
目前检测E.coli 菌毛的方法有电子显微镜检查法、D-甘露糖抵抗血凝与血凝抑制试验、棉籽糖发酵试验、细胞黏附试验和免疫血清学技术及核酸探针技术[10]。由于菌毛分型较多,同型菌毛中还存在不同亚型,因此难以进行快速鉴别[11]。上述方法均存在费时费力、特异性低等缺陷,而且需要进行菌毛化培养。多重PCR 能够通过一个反应同时检测多种微生物或检测一种微生物的多个基因片段,具有成本低、操作简单、灵敏度高、特异性强等优点,被广泛应用。张兴民等建立的检测致山羊腹泻的4种病原菌的多重PCR 方法,孟相秋等建立的检测ETEC 4 种肠毒素基因的多重PCR 方法[12-13],显著提高了对目的基因的检测效率。
本研究建立了可同时检测ETEC 常见的F 抗原(菌毛)F4(K88)、F5(K99)、F6(987P)、F41 和STEC 常见的F18 等5 种菌毛基因的多重PCR 方法,为ETEC 和STEC 菌毛的鉴定提供一种有效的检测技术。
1 材料与方法
1.1 主要实验材料 大肠杆菌参考菌株C83903(O141∶K85,K88ab)、C83915(O9∶K103,987P)、C83920(O101∶K30,K99、F41)、C83684(O139,F18)购自中国兽医药品监察所;E. coli DN48A(F17)、DN77C(F18ac)以及90 株E.coli 由东北农业大学动物医学学院兽医传染病学教研室从犊牛粪便中分离鉴定并保存;参考菌株猪霍乱沙门氏菌CVCC503、猪丹毒杆菌CVCC124、巴氏杆菌CVCC430 由东北农业大学动物医学学院药理与毒理学教研室张秀英教授提供。Trans 2k Plus ⅡMolecularMarker、10×loading buffer、EasyTaqDNA 聚合酶(5 U/μL)、10×EasyTaq buffer(含Mg2+)、dNTPs(2.5 mmol/mL)购自北京全式金生物技术有限公司。
1.2 引物的设计与合成 参照GenBank 中E.coli 菌毛基因保守序列设计5 对分别扩增E. coli F4、F5、F6、F41、F18 菌毛保守基因的特异性引物,由哈尔滨新海工程技术服务有限公司合成(表1),各引物工作液浓度为20 μmol/L。
1.3 多重PCR反应条件的优化 采用煮沸法提取1.1中所有细菌的DNA[13],-20 ℃保存备用。采用25 μL反应体系进行PCR 扩增,以E. coli 参考菌株C83903、C83915、C83920、C83684 的DNA 及其等比例混合物为模板,无菌去离子水为阴性对照,对影响PCR 的EasyTaq 聚合酶浓度、dNTPs 浓度、退火温度以及延伸时间等因素进行优化。扩增产物经2%琼脂糖凝胶电泳检测,以电泳条带特异、清晰,引物二聚体最少的反应条件为优化的反应条件。

表1 多重PCR 引物序列与靶基因扩增长度Table 1 Multiplex PCR primer sequencesand the length of the target genes
1.4 特异性试验 取参考菌株E. coli C83903、C83915、C83920、C83684 及其混合物、E. coli 分离菌株DN48A、猪霍乱沙门氏菌CVCC503、猪丹毒杆菌CVCC124 以及巴氏杆菌CVCC430 的DNA 作为模板进行多重PCR 扩增,扩增产物经2%琼脂糖凝胶电泳检测,评估该多重PCR 的特异性。
1.5 敏感性试验 取37 ℃振摇过夜的参考菌株E. coli C83903、C83915、C83920、C83684 分别用灭菌生理盐水做10-1~10-8连续稀释,然后取各参考菌株不同稀释度的菌液100 μL 涂布于LB 琼脂平板上,37 ℃培养16 h 后进行菌落计数。同时取上述不同稀释度的菌液各1 mL 制备DNA 模板,检测多重PCR 的敏感性,并与常规PCR 敏感性相比较。常规PCR 反应体系和反应条件如下:反应体系为25 μL,其中10×EasyTaq buffer(含Mg2+)2.5 μL、2.5 mmol/mL dNTPs 2.0 μL、不同菌毛基因的上下游引物(20 μmol/L)各1 μL 共2 μL、5 U/μL EasyTaq DNA 聚合酶0.5 μL、DNA 模板各1 μL。用灭菌去离子水补足至25 μL。反应条件为:94 ℃5 min;94 ℃30 s、55 ℃30 s、72 ℃45 s、30 个循环;72 ℃7 min。PCR 扩增产物经2%琼脂糖凝胶电泳检测,以检测出菌毛基因所需的最低活菌数即为多重PCR 的检测限。
1.6 重复性试验 分别用3 个批次的EasyTaq buffer(含Mg2+)、dNTPs、EasyTaq DNA 聚合酶和上下游引物对参考菌株E. coli C83903、C83915、C83920、C83684 DNA 混合物进行多重PCR 检测,每个批次做3 个重复,PCR 扩增产物经2 %琼脂糖凝胶电泳检测,确定多重PCR 方法的批内和批间重复性。
1.7 临床样品检测 实验室前期以犊牛腹泻粪便为样品,于麦康凯琼脂平板划线分离E.coli,37 ℃培养过夜,随机挑取10~15 个粉红色、表面光滑的圆形可疑菌落在麦康凯平板划线纯培养后,再经生化鉴定和E.coli 持家基因(phoA)PCR 检测,最终分离获得90株E.coli。取上述90株E.coli分离株分别接种LB液体培养基,37 ℃振荡培养16 h 后取1 mL 菌液用煮沸法制备DNA 作为模板,利用本试验建立的多重PCR 检测E.coli 菌毛基因,并用常规PCR 检测验证。PCR 扩增产物经2%琼脂糖凝胶电泳检测。
2 结 果
2.1 优化的多重PCR 反应条件 经优化后的多重PCR 反应体系和反应条件如下:反应体系为25 μL,其中10×EasyTaq buffer(含Mg2+)2.5 μL、2.5 mmol/mL dNTPs 2.0 μL、5种菌毛基因的上下游引物(20 μmol/L)各1 μL 共10 μL、5 U/μL EasyTaq DNA 聚合酶1 μL、提取的4 株E.coli 参考菌株的DNA 模板各1 μL。用灭菌去离子水补足至25 μL。反应条件为:94 ℃5 min;94 ℃30 s、60 ℃35 s、72 ℃90 s、30 个循环;72 ℃7 min。扩增产物经2 %琼脂糖凝胶电泳检测,结果显示,扩增产物电泳条带清晰,大小分别为770 bp(F4)、533 bp(F5)、422 bp(F6)、643 bp(F41)、1 140 bp(F18),与预期大小一致。表明优化后的反应条件可同时扩增出5 种菌毛的特异性基因片段。
2.2 特异性试验 特异性试验结果显示,本实验建立的多重PCR 仅从E. coli 参考菌株C83903、C83920、C83915、C83684、DN77C的DNA模板中扩增出770 bp、533 bp 和643 bp、422 bp、1 140 bp、1 140 bp 的目的条带,大小与预期一致,而从E.coli DN48A、猪霍乱沙门氏菌CVCC503、猪丹毒杆菌CVCC124、巴氏杆菌CVCC430 的DNA 模板中未扩增到目的条带(图1)。表明该多重PCR 具有较强的特异性。
2.3 敏感性试验 对参考菌株E.coli C83903(F4)、C83915(F6)、C83920(F5、F41)、C83684(F18)不同菌液不同稀释度菌落数在30~300 之间的平板进行菌落计数,当C83903、C83915菌液稀释度为10-5时结果为53 cfu、31 cfu,当C83920、C83684 菌液稀释度为10-6时结果为37 cfu、69 cfu,由此计算,各菌液中的活菌数分别为C83903:5.3×107cfu/mL、C83915:3.1×107cfu/mL、C83920:3.7×108cfu/mL、C83684:6.9×108cfu/mL。敏感性试验结果显示,本实验建立的多重PCR 在5 种菌毛基因同时存在时对F41 基因的最小检出活菌数为3.7×107cfu/mL;对F4、F5、F6和F18 基因的最小检出活菌数分别为5.3×105cfu/mL、3.7×106cfu/mL、3.1×105cfu/mL、6.9×105cfu/mL(图2,表2)。

图1 多重PCR 特异性试验结果Fig.1 The result of specificity test for the multiplex PCR method
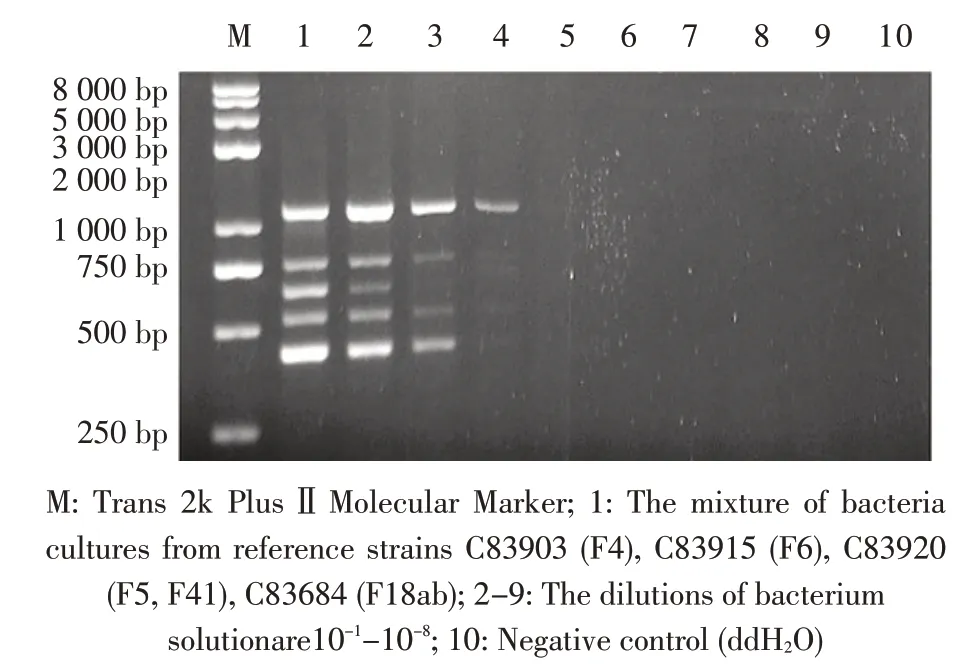
图2 多重PCR 敏感性试验结果Fig.2 The result of sensitivity test for the multiplex PCR method
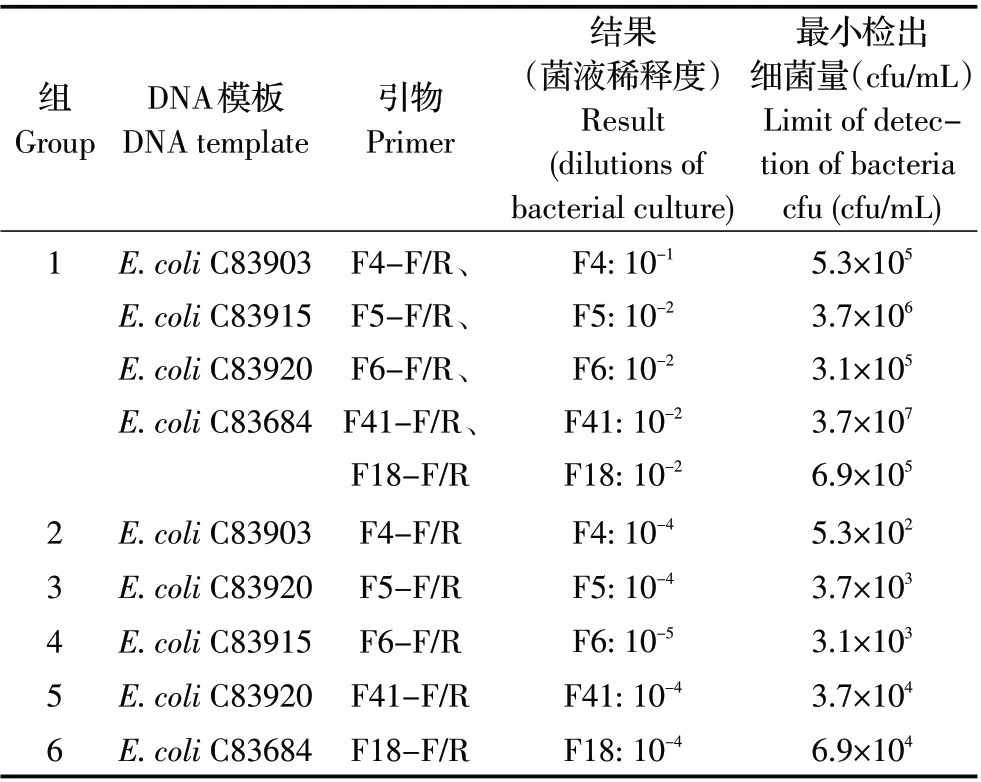
表2 多重PCR 敏感性试验分组及结果Table 2 The groupings and results of sensitivity test for multiplex PCR system
常规PCR对F4、F5、F6、F41和F18菌毛基因的最小检出活菌数分别为5.3×102cfu/mL、3.7×103cfu/mL、3.1 × 103cfu/mL、 3.7 × 104cfu/mL 和6.9 × 104cfu/mL(图3)。上述结果表明本实验建立的多重PCR 方法同时检出5 种菌毛基因所需的活菌数最小为3.7×107cfu/mL。

图3 常规PCR 敏感性试验结果Fig.3 The results of sensitivity test for conventional PCR system
2.4 重复性试验 利用同一批次和不同批次的引物和试剂对4 种参考菌株DNA 混合物的多重PCR 检测结果显示,均能扩增出与预期相符的特异性条带(图4),表明该检测方法有很好的批内重复性和批间重复性。
2.5 临床样本检测 采用建立的多重PCR 方法对90 株E.coli 分离株进行检测,结果显示,其中F4 阳性率为3.33%(3/90),F5 阳性率为2.22%(2/90),未检测到F6、F41 和F18 阳性菌株,其试验结果与常规PCR 检测结果一致,表明该方法可用于E.coli 分离株菌毛基因的检测。

图4 多重PCR 重复性试验结果Fig.4 The results of reproducibility test for the multiplex PCR method
3 讨 论
多重PCR 是在常规PCR 基础上发展而来的一种可同时检测多个目基因的方法,与常规PCR 技术相比,多重PCR 具有一次检出多个目的基因、节约时间及实验成本的优点,但其体系更加复杂,可能存在多对引物之间形成引物二聚体;引物与非目的基因序列的结合产生非特异性扩增;延伸时间不足导致目的片段得不到充分的扩增;多重PCR 反应产物在低浓度凝胶中电泳难以分离等问题[14]。本实验通过BLAST 和GenBank 序列数据库确定每条引物(共10 条)的特异性,通过梯度PCR 确定最适退火温度使不同的目的基因片段均能被较好的扩增,同时延长延伸时间并增加体系内DNA 聚合酶的量以确保充分扩增目的基因。F4 菌毛的引物在50 ℃~60 ℃时均能扩增出特异性条带,而F5、F6、F41、F18 的引物在55 ℃~65 ℃能产生特异且单一的条带,因此将多重PCR 退火温度设定于60 ℃,与Casey 等检测9种大肠杆菌毒力因子时所用延伸时间相同,退火时间略短,退火温度高于其选择的55 ℃以保证所有基因的特异性扩增[15]。段新华等建立的4 重PCR 方法,扩增的菌毛基因片段大小仅相差66 bp[16],结果不易分辨,本实验中各目的片段大小相差均超过100 bp,易于通过电泳分离。此外,通过序列比对发现,组成K88 菌毛的faeG 基因1 bp~86 bp 的序列与F41 基因58 bp~146 bp 的序列相似性可达85%,段新华等设计的F41 上游引物即处于这段区域,本实验设计引物时避开了这段序列,避免在多个模板同时存在时对引物产生干扰,发生非特异性扩增[16]。本实验建立的多重PCR 方法检测F41 菌毛基因的最小活菌数为3.7×107cfu/mL,敏感性明显低于常规PCR,然而,经37 ℃200 r/min 振荡培养16 h 的E.coli菌液浓度即可达108cfu/mL,完全能够满足多重PCR的检测要求。本实验建立的E.coli 菌毛基因5 重PCR检测方法的敏感性与华荣虹等建立的E.coli 菌毛基因4 重PCR 检测方法的敏感性基本一致[17]。初步应用本实验建立的多重PCR 检测方法对本实验室前期从犊牛腹泻粪便样品中分离的90 株E.coli 分离株的菌毛基因进行了检测,仅检测到3 株E.coli 携带F4基因,2 株E.coli 携带F5 基因,没有检测到F6、F41和F18 基因。引起犊牛腹泻的病因较多,仅病原微生物就有病毒、细菌和寄生虫,从检测结果分析,虽然E.coli 分离株均来自犊牛腹泻粪便,但引起腹泻的主要病原可能是病毒或寄生虫。另外,携带F6基因的ETEC 主要引起仔猪腹泻,携带F18 基因的STEC 主要引起仔猪水肿病和断奶仔猪腹泻,在犊牛腹泻粪便中常检测不到。
E.coli 菌毛种类繁多,某些菌毛又包含不同的亚型,因此用血清学方法鉴别较为困难。F18 菌毛由FedA、FedB、FedC、FedE、FedF 亚单位组成,该菌毛有两种亚型,分别为F18ab 和F18ac。对F18ab 和F18ac 菌株fedE、fedF 基因的多样性分析显示,fedE 基因的序列具有高度保守性,fedF 基因在289 bp~518 bp 碱基序列之间具有高度保守性[18-19],因此本研究根据fedE 和fedF 基因保守序列设计了引物,试验证明所设计的引物对F18ab 和F18ac 型菌毛基因均能检出。F4 菌毛由FaeA、FaeB、FaeC、FaeD、FaeE、FaeF、FaeG、FaeH、FaeI、FaeJ 共10 个亚单位组成,其可分为3 种亚型:F4ab、F4ac、F4ad。faeG 基因是F4 菌毛的主要结构蛋白亚单位基因,直接参与和易感宿主肠上皮细胞大分子受体的特异性结合,任士飞等人对faeG 基因克隆分析后发现F4ab、F4ac 和F4ad 的faeG 序列存在2 处主要碱基序列差异,第1 处在304 bp~306 bp 碱基序列中,第2处在491 bp~499 bp 碱基序列之间[20]。本实验在设计引物时避开了这两处序列,而在faeG 基因两端最保守的部分设计特异性引物,并利用Primer5 软件和BLAST 比对GenBank 数据库中大量菌毛基因的参考序列,证实了引物区的序列保守性以确保该引物能检测F4 菌毛所有亚型的基因。
本实验建立的多重PCR 方法能特异性扩增目的基因,并产生彼此差异超过100 bp 的扩增产物,可通过2%琼脂糖凝胶电泳分离,所有的阴性对照均未扩增出任何条带,同时也表现出很好的敏感性和重复性。对90 株从犊牛粪便中分离的E.coli 的检测表明该多重PCR 的检测结果与常规PCR 的检测结果完全相同,且该方法明显提高了检测效率,可以用于临床检测。该多重PCR 方法具有较好的特异性和敏感性,希望能在E.coli 快速分离鉴定、流行病学调查和疾病诊断中发挥作用。

