木通皂苷D促进糖皮质激素环境下小鼠骨髓间充质干细胞成骨分化
张志达 沈耿杨 任辉 余翔 尚奇 黄锦菁 招文华 余佩沅 詹玫琦 梁德 杨志东 江晓兵*
1.广州中医药大学第一临床医学院,广东 广州 510405 2. 广州中医药大学第一附属医院脊柱骨科,广东 广州 510405 3. 广州中医药大学岭南医学研究中心,广东 广州 510405
糖皮质激素(glucocorticoids,GCs)具有良好的抗炎、抗过敏、抑制免疫等作用,广泛应用于临床。但长期、超生理剂量摄入GCs可引发骨质疏松。GCs摄入是导致继发性骨质疏松最常见的因素[1]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)可向成骨细胞、脂肪细胞等多方向分化,直接影响骨形成,调节骨量。GCs可抑制BMSC成骨分化、促进BMSCs成脂分化[2]。木通皂苷D(akebia saponin D,ASD)又称川续断皂苷VI,是川续断的主要活性成分[3],研究显示ASD可促进BMSCs向成骨细胞分化[4]。BMP/Smad信号通路可调控成骨细胞的全部过程,其功能障碍可引起骨形成减少[5]。因此,本研究拟通过研究ASD对在GC环境下小鼠BMSC成骨分化的影响,为今后ASD在防治GIOP中的开发应用提供实验依据。
1 材料和方法
1.1细胞提取、培养与传代
8周龄健康C57BL/6小鼠脱颈法处死,70%酒精浸泡消毒5 min,切开髋关节周围的皮肤,用无菌的解剖剪刀和镊子从每只小鼠后肢分离出股骨和胫骨,去除皮肤、肌肉肌腱等软组织,将干净的骨头放在培养皿中。无菌剪刀剪除每根骨的两端,暴露骨髓腔,用1 mL注射器抽取冲洗培养基(49 mL α-MEM+1 mL FBS+0.5 mL P/S)冲出骨髓至15 mL离心管。室温下以1 000 r/min离心10 min,弃上清液,室温下将细胞悬浮于5 mL红细胞裂解缓冲液中5 min。用10 mL冲洗培养基再洗细胞1次并离心,用1 mL冲洗培养基重新悬浮细胞,计算细胞数量。细胞至于体积分数5% CO2、37 ℃、湿度75%的培养箱中恒温培养。72 h更换生长培养基(45 mL α-MEM+5 mL FBS+0.5 mL P/S),之后每3 d更换1次培养基,待细胞80%~90%融合后传代,用胰蛋白酶消化细胞至大部分细胞重新悬浮,再加入培养基终止胰蛋白酶消化作用,1 000 r/min离心5 min;弃上清,用培养基重悬细胞后移至新的培养瓶中培养。传至第3代后进行成骨诱导。
1.2主要仪器、试剂及药物
研究型正置荧光生物显微镜(OLYPUS公司,日本)、T100梯度PCR仪、CFX96实时荧光定量PCR仪(Bio-Rad,美国),全波长酶标仪(Thermo,美国)、电泳仪(BIO-RAD,美国)、垂直板电泳装置(BIO-RAD,美国)、Tanon-2500R型全自动数码凝胶成像系统(Bio-Rad,美国)等。
α-MEM培养基(Gibco公司,美国),胎牛血清(FBS;Gibco公司,美国),胰蛋白酶(Gibco公司,美国),C57BL/6小鼠BMSCs成骨诱导分化培养基[α-MEM基础上含10% FBS+1% Penicillin-Streptomycin双抗+50 μg/mL抗坏血酸+10 mmol/L β-甘油磷酸钠;赛业(苏州)生物科技有限公司,中国],碱性磷酸酶(ALP)活性检测试剂盒(Roche公司,瑞士),茜素红S(Roche公司,瑞士),Trizol (Invitrogen公司,美国),RNA提取试剂盒、反转录试剂盒PrimeScriptTM RT Master Mix、荧光定量SYBR© Premix ExTaq TMⅡ试剂盒(TAKARA,日本),Runx2、OCN、Smad1、Smad5引物(Life公司,美国),抗-Smad1/5/8抗体(1∶500;CST公司,美国),抗磷酸化Smad1/5(pSmad1/5)抗体(1∶500;CST公司,美国);醋酸地塞米松片(Sigma公司,美国);ASD(Sigma公司,美国)等。
1.3实验方法
1.3.1药物干预:细胞分别用成骨诱导培养基(OBI)、OBI+DEXA(0.1 μmol/L)、OBI+DEXA(0.1 μmol/L)+ASD(10 μmol/L)干预,分别进行碱性磷酸酶(ALP)活性测定,茜素红染色检测成骨早期矿化情况;定量实时荧光PCR(qRT-PCR)检测成骨因子骨钙素(osteocalcin, OCN)、Runx2以及Smad信号通路Smad1、Smad5的表达,Western blot检测Smad信号通路Smad1/5磷酸化水平和Smad1/5/8总蛋白水平。
1.3.2ALP活性检测:药物干预5 d后收集细胞培养液上清,测定ALP活性,具体步骤方法参照试剂盒操作。
1.3.3茜素红染色检测成骨矿化情况:药物干预14 d后取出1块12孔板,吸去培养基,PBS(1×)清洗2遍,加入95%戊二醛溶液固定,4°过夜,40 mmol/L茜素红染色15 min,水洗3次,PBS(1×)洗涤15 min后,拍照洗脱茜素红测OD值。
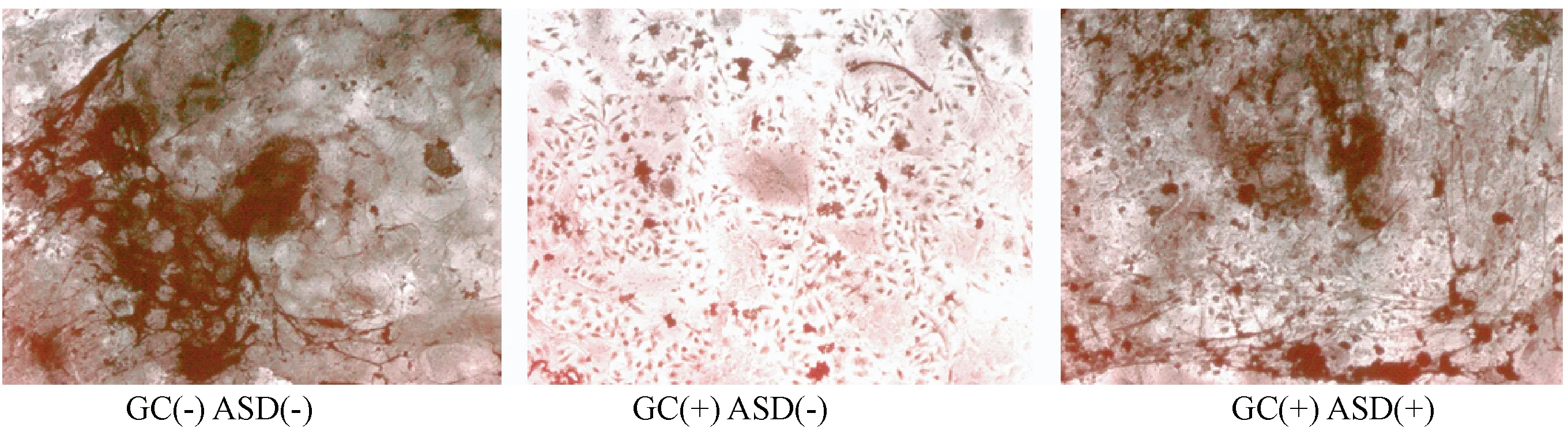
图2 不同干预诱导成骨矿化情况Fig.2 Osteogenic mineralization in different treatments
1.3.4qRT-PCR检测续断皂苷对DEXA环境下成骨因子mRNA表达的影响:药物干预5 d后,用异硫氰酸胍(Trizol)法提取细胞总RNA,RNA酶消化并反转录,qRT-PCR反应引物:Runx2:GACCAGTC TTACCCCTCCTA和GDEXAAGTGTCATCATCTGAAA;OCN:CTCTCTCTDEXATCACTCTDEXAT和GACTGA GDEXATCCAAGGTAG;Smad1:DEXATTCGTGAA GGGTTGGGG和CGGATGAAATAGGATTGTGGGG;Smad5:TTGTTCAGAGTAGGAACTDEXAAAC和GAADEXATGADEXAAAACTCCTGAT。反应条件:95 ℃,3 min变性;95 ℃,30 s;60 ℃,40 s,共40个循环。
1.3.5Western blot检测ASD对DEXA环境下Smad信号蛋白表达的影响:药物干预14 d后,加入RIPA细胞裂解液300 μL,冰上裂解30 min,12 000 r/min离心10 min,检测蛋白浓度,用等量2-上样缓冲液(2-SDS-PAGE Sample/Loading Buffer)混匀煮沸10 min,提取20 μg的蛋白行SDS-PAGE电泳,将蛋白转至PVDF膜上,室温下封闭1 h,一抗室温孵育2 h后,TBST洗膜3次(10 min/次),二抗室温孵育1 h,TBST洗膜3次(10 min/次),DAB试剂盒显色曝光拍照。
1.4统计学处理
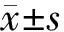
2 结果
2.1ALP活性
ALP活性见图1。DEXA环境下,小鼠BMSCs ALP活性明显降低(P<0.001),ASD明显增加了DEXA干预下BMSCs的成骨活性(P<0.01)。

图1 不同干预BMSCs ALP活性Fig.1 ALP activity of BMSCs treated with different methods
2.2茜素红染色
茜素红染色见图2。与单纯成骨诱导比较,BMSCs在DEXA干预下,成骨矿化结节明显减少;与DEXA干预比较,DEXA+ASD干预明显增加了矿化。
2.3不同干预下Runx2、OCN、Smad1、Smad5 mRNA表达水平
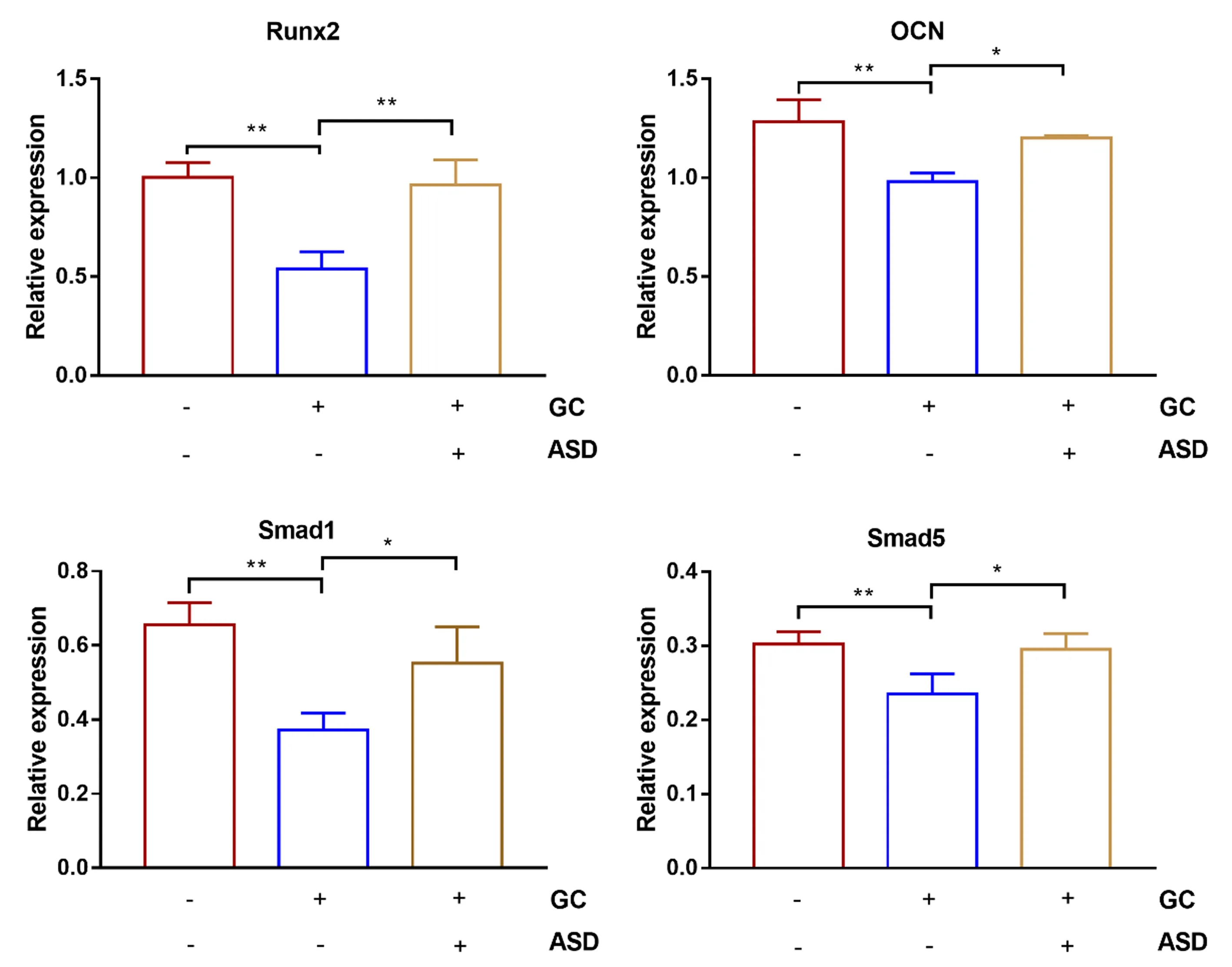
图3 mRNA相对表达水平Fig.3 Relative expression levels of mRNAs
不同干预下Runx2、OCN、Smad1、Smad5 mRNA表达水平见图3。与OBI比较,OBI + DEXA干预组Runx2、OCN、Smad1和Smad5 mRNA表达均明显下调(P<0.01),OBI + DEXA+ASD干预组Runx2、OCN、Smad1和Smad5 mRNA表达差异无统计学意义(P>0.05);OBI +DEXA+ASD干预组较OBI +DEXA干预组Runx2、OCN、Smad1和Smad5 mRNA表达明显上调(P<0.01和P<0.05)。
2.4不同干预下Smad1/5蛋白磷酸化水平
不同干预下Smad1/5蛋白磷酸化水平见图4。与OBI组比较,OBI + DEXA干预、OBI + DEXA + ASD干预小鼠BMSCs后Smad1/5/8总蛋白表达无明显变化;OBI + DEXA干预后磷酸化Smad1/5(pSmad1/5)蛋白表达明显降低,ASD可增加DEXA环境下Smad1/5蛋白的磷酸化水平。

图4 Smad1/5/8和pSmad1/5蛋白表达情况Fig.4 Expression of Smad1/5/8 and pSmad1/5 proteins
3 讨论
糖皮质激素性骨质疏松(glucocorticoid-induced osteoporosis, GIOP)是目前最常见的继发性骨质疏松[1]。其发病机制仍未完全清楚,近期发现DEXA可增加破骨细胞活性,抑制成骨细胞增殖,诱导成骨细胞和骨细胞凋亡,降低骨量[6]。有研究也发现DEXA可抑制大鼠BMSC增殖和成骨分化[7],这与本研究的结果一致。需要指出,虽然低剂量(或浓度)DEXA可促进成骨分化——在含维生素C(或称抗坏血酸)、β-甘油磷酸盐的成骨诱导剂基础上添加微量DEXA是诱导成骨分化常用的方法,亦有众多研究在诱导成骨分化时未添加DEXA而只添加维生素C、β-甘油磷酸盐[8-10],本研究中诱导成骨的方法正是参照这些研究。
木通皂苷D(akebia saponin D,ASD)又称川续断皂苷VI,是川续断的主要活性成分,具有治疗抗骨质疏松、糖尿病、高脂血症等药理作用[11],具有很高的研究和开发价值。虽然已有研究发现ASD可促进BMSCs成骨分化[4, 12-13],但相关研究仍较少,且ASD对DEXA环境下BMSCs成骨分化的影响及其机制仍未见报道。ALP主要分布在细胞膜,是膜结合胞外酶[14],协助转运钙,参与细胞成熟、钙化[15], 是成骨细胞分化早期标志物[16]。本研究中,ASD干预DEXA环境下小鼠BMSCs,可明显增强ALP活性,证实了ASD的促成骨分化的作用,与上述既往研究结果类似。
OCN是成骨细胞分化中期的重要标志物[17],也是调节骨质钙化的重要因子,参与骨组织的正常矿化[18]。Runx2是BMSCs向成骨方向分化的首要决定因子,是成骨细胞分化早期主要骨基质基因表达的启动子[19]。我们的研究结果显示,ASD上调了被DEXA抑制的OCN和Runx2表达,进一步证实了ASD促进成骨分化,提示其机制可能与靶向调控OCN和Runx2的表达有关。
BMP/Smad信号通路是调控成骨的重要通路。BMP受体介导BMP/Smad信号通路转导:磷酸化Smad1、Smad5和Smad8,使其形成复合物并与Smad4结合,转移入核,与其他转录因子如Runx2相互作用,启动成骨相关基因的转录[20]。本研究中,DEXA干预下,Smad1、Smad5 mRNA表达均明显下调,而ASD可上调被DEXA抑制的Smad1、Smad5表达,提示ASD可靶向上调BMP/Smad信号通路中Smad1、Smad5元件表达;另外,DEXA或DEXA+ASD干预,Smad1/5/8总蛋白表达均无明显变化,而DEXA降低了pSmad1/5蛋白水平,ASD增加了被DEXA抑制的pSmad1/5表达,证实ASD可激活被DEXA抑制的BMP/Smad信号通路。
综上所述,ASD可促进DEXA环境下小鼠BMSCs成骨分化,其机制可能与激活BMP/Smad信号通路有关。

