鸡κ干扰素在家蚕杆状病毒表达系统中的表达及其抗病毒活性检测
杨鑫, 宋浩志, 刘兴健, 李轶女, 张志芳
中国农业科学院生物技术研究所, 北京 100081
干扰素(IFN)是一类在抗肿瘤、细胞抗病毒、免疫调节活性中起核心作用的细胞因子家族[1-3]。根据其结构和功能特点,IFN被分为三种亚型,分别是结合IFNαR1和IFNαR2受体的Ⅰ型干扰素,与IFNγR1、IFNγR2受体结合的Ⅱ型干扰素,以及与IL-28Rα、IL-10Rβ异二聚体受体结合的Ⅲ型干扰素。其中Ⅰ型和Ⅲ型干扰素之间在功能和信号转导等方面有很多相似之处。在禽类中干扰素的功能与它们在哺乳动物中的同源物有诸多相似之处,但是在不同物种间每种亚型的干扰素的基因序列都存在着巨大的差异。目前在哺乳动物中至少有9种Ⅰ型IFN被报道,这些IFN对于启动先天免疫至关重要[4]。Ⅰ型IFN具有保守的无内含子结构,位于染色体的特定基因座中,并被认为具有高度同源性[5-6]。在哺乳动物中发现的几种Ⅰ型干扰素(IFN-α、IFN-β、IFN-ω、IFN-γ、IFN-κ、IFN-δ、IFN-ζ和IFN-τ)都具有独特的组织分布和功能[7]。但是,在鸡和其他鸟类成员中仅鉴定出了两种Ⅰ型IFN(IFN-α和IFN-β)。而关于Ⅰ型IFN在先天性和适应性免疫中的多种功能的研究大多数都集中在IFN-α和IFN-β上[8-9]。由于鸡具有类似于哺乳动物的强效抗病毒应答反应,因此研究鸡基因组中携带的类似哺乳动物的Ⅰ型IFN基因的抗病毒活性具有重要意义。
鸡κ干扰素(chIFN-κ)作为一种在鸡中新报道的具有生物学活性的Ⅰ型干扰素,在抗禽流感等众多禽类传染病实验中都表现出了较好的效果[10]。研究表明,chIFN-κ可能与其他物种的相应IFN-κ蛋白具有功能相似性。与其他Ⅰ型IFN相似,在chIFN-κ的近端启动子区域中发现了包括IRF、ISRE和NF-κB结合位点在内的众多转录因子。此外,还发现了GAAANN元件,这些元件是病毒诱导的IFNs表达的基础[11-12]。但是由于在基因组中所处的位置不同,chIFN-κ在组织或抗病毒特异性上不同于其他Ⅰ型IFN。因此,chIFN-κ具有能够在组织特异性、抗病毒等方面发挥出更多的不同于传统Ⅰ型IFN作用的潜力。
本研究通过对最新报道的chIFN-κ序列进行家蚕密码子优化,利用BmBacmid家蚕杆状病毒表达系统对其进行表达[13],并对表达产物的生物学活性进行系统检测,以期获得一种能够大量表达具有高抗病毒活性的鸡κ干扰素,并为chIFN-κ之后的系统研究提供实验基础。
1 材料与方法
1.1 实验材料
chIFN-κ干扰素基因由南京金斯瑞生物科技有限公司优化合成;杆状病毒转移载体pVL1393、失活拯救型穿梭质粒、家蚕卵巢传代细胞(Bm-N)、重组表达绿色荧光蛋白的水疱型口炎病毒(VSV-GFP)均由本实验室传代保存;大肠杆菌感受态Trans 1、表达感受态BL21(DE3)购自北京全式金公司;昆虫细胞培养基(TC-100)购自AppliChem公司;实验用家蚕为江苏科技大学蚕业研究所提供的JY1品种;哺乳动物细胞培养基和胎牛血清(FBS)购自Gibco公司;BALB/c雌性小鼠购自北京维通利华实验动物技术有限公司;SPF鸡蛋(8~11日龄)购自北京梅里亚维通实验动物技术有限公司;小鼠抗体制备佐剂QuickAntibody-Mouse5W购自北京博奥龙免疫技术有限公司;HRP标记的山羊抗小鼠IgG购自MBL。
1.2 实验方法
1.2.1 chIFN-κ的优化及合成 查找GenBank公布的鸡κ干扰素氨基酸序列,在得到的多条结果中用序列比对软件进行比对选择共有序列,最终确定登录号为ADU04501.1的氨基酸序列,将此序列在不改变氨基酸的前提下根据家蚕密码子的偏好性进行优化,替换易使mRNA形成发夹结构的密码子,提高CAI值,调整GC含量,以增加其在家蚕杆状病毒表达系统中的表达效率。在去除常用酶切位点后,于其两端分别加入BamHⅠ和EcoRⅠ酶切位点,在起始密码子ATG前加入Kozak序列(AAC),交由南京金斯瑞公司使用化学合成法合成优化后的基因,将此基因命名为:chIFN-κ(570 bp)。
1.2.2 表达载体pET-28a-chIFN-κ及转移载体pVL1393-chIFN-κ的构建 公司合成的基因chIFN-κ已经构建在pUC57载体上,用BamHⅠ和EcoRⅠ内切酶酶切后进行核酸凝胶电泳,并对目的大小的片段进行胶回收,将回收下来的片段分别与已用BamHⅠ和EcoRⅠ内切酶切好的pVL1393载体片段在T4 DNA连接酶的催化下22℃连接3 h。将连接产物转化至大肠杆菌Trans 1感受态内,在氨苄固体选择培养基中挑选出连接成功的转移载体pVL1393-chIFN-κ。同时将上述片段与BamHⅠ和EcoRⅠ内切酶处理的pET-28a载体片段在T4 DNA连接酶的催化下22℃连接3 h。将连接产物转化至大肠杆菌Trans 1感受态内,在卡那固体选择培养基中挑选出连接成功的转移载体pET-28a-chIFN-κ。
1.2.3 重组病毒的获得和在家蚕中的表达 将转移载体pVL1393-chIFN-κ与杆状病毒穿梭载体reBmBac DNA在脂质体的介导下共转染家蚕卵巢传代细胞Bm-N,在27℃培养4~5 d后收集病变细胞培养基上清,离心去除细胞碎片后,对培养基上清进行PCR鉴定,验证重组病毒中含有chIFN-κ基因片段后,将病毒液按照105pfu每头的含量注射5龄起家蚕,同时设置阴性对照组,饲养96~120 h根据家蚕发病情况收集蚕血淋巴,加入抗氧化剂后于-80 ℃保存。
1.2.4 小鼠抗体制备 将测序正确的pET-28a-chIFN-κ质粒转化至BL21/DE3表达感受态中,利用IPTG诱导法获得大肠杆菌的重组蛋白,并利用Ni亲和层析柱法对目的蛋白进行纯化。依照QuickAntibody-Mouse5W产品指南,利用BALB/c小鼠进行chIFN-κ多克隆抗体的制备。
1.2.5 目的蛋白的Western blot 将收集的蚕血淋巴利用PBS稀释10倍后进行超声破碎,离心去除细胞碎片及其他杂质,将上清液进行SDS-PAGE后将蛋白电转至甲醇活化的PVDF膜上,3%BSA封闭后依次使用制备的抗chIFN-γ鼠多抗为一抗(1∶1 000稀释)和HRP标记的山羊抗小鼠IgG为二抗(1∶5 000稀释)孵育,使用ECL发光液进行显色成像。
1.2.6 表达产物抗病毒活性检测 用PBS将含有chIFN-γ的蚕血淋巴稀释10倍,超声破碎,10 000 g离心10 min后将上清用0.22 μm膜过滤除菌。将鸡成纤维细胞(CEF)按照105个·mL-1的浓度,按每孔100 μL加入96孔板,在37 ℃、5%CO2培养24 h,将干扰素样品稀释1 000倍后按照10倍梯度稀释,按每孔100 μL加入96孔板,每个稀释度设置8个复孔为1列,另设1列病毒对照和1列空白对照。37 ℃、5%CO2培养24 h后用100 TCID50的VSV-GFP病毒攻毒。24 h后利用绿色荧光来判断细胞病变情况,根据观察结果,采用微量细胞病变抑制法测定干扰素表达产物的抗病毒活性[14],在CEF中检测其对VSV-GFP的抗病毒作用,使用Reed-muench方法来计算干扰素的抗病毒效价。
2 结果与分析
2.1 转移载体及表达载体的酶切鉴定
利用BamHⅠ和EcoRⅠ对构建好的载体pVL1393-chIFN-κ及pET-28a-chIFN-κ进行酶切鉴定,并将酶切产物于1%琼脂糖凝胶电泳中进行检测,目的基因大小为570 bp,pVL1393载体大小为9 607 bp,pET-28a载体大小为5 369 bp,电泳结果与预期一致。在对酶切鉴定成功的载体进行测序后,发现其测序结果与目的基因片段序列完全一致,证明转移载体pVL1393-chIFN-κ和表达载体pET-28a-chIFN-κ构建成功。

A:M—DNA maker, 1— pVL1393-chIFN-κ重组质粒;B:M—DNA maker, 1—pET-28a-chIFN-κ表达载体。图1 pVL1393-chIFN-κ重组质粒及pET-28a-chIFN-κ表达载体的酶切鉴定Fig.1 Identification of recombinant transfer vector >pVL1393-chIFN-κ and restriction enzyme analysis of >pET-28a-chIFN-κ
2.2 chIFN-κ在蚕血淋巴中的表达鉴定
对家蚕血淋巴表达产物超声破碎处理后,进行Western blot检测,结果(图2)显示,相较于对照组,转化组reBm-chIFN-κ在22 kDa左右有明显的特异性杂交条带,大小与预期相符,证明成功利用家蚕杆状病毒表达系统表达了鸡κ干扰素。

注:1, 2—表达chIFN-κ蚕血淋巴; 3—表达荧光素酶蚕血淋巴对照; WT—BmNPV感染的蚕血淋巴对照。图2 表达产物chIFN-κ的Western blot检测Fig.2 Western blot of expression product chIFN-κ
2.3 chIFN-κ表达产物的抗病毒活性检测
在利用细胞病变抑制法对表达产物chIFN-κ进行抗病毒活性检测的实验中,以表达产物稀释103~108倍(10倍递增),确定干扰素精确活性范围后再进行精确区间3倍递增的活性检测,利用VSV-GFP在495 nm处有吸收峰的特点,在荧光显微镜下对处理后的细胞进行观察,出现绿色荧光代表病毒大量复制。将观察结果分为有绿色荧光(标记为“+”)和无绿色荧光(标记为“-”),以病毒对照组半数发病为起始,对细胞发病情况进行记录,结果如表1所示,使用Reed-Muench法计算干扰素抗病毒效价,多次重复后得到其抗病毒效价为(1.04±0.23)×107U·mL-1的血淋巴。
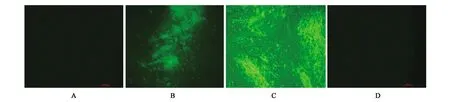
A:干扰素完全抑制VSV-GFP复制;B:低浓度干扰素对细胞部分保护;C:病毒对照组;D:细胞空白对照图3 不同组别鸡成纤维细胞(CEF)感染VSV-GFP后的发病情况Fig.3 The morbidity of different CEF cells infected with VSV-GFP

表1 家蚕幼虫血淋巴中chIFN-κ的抗病毒活性Table 1 Antiviral activity assays of recombinant chIFN-κ in haemolymph of silkworm larvae
注:“-”表示无绿色荧光;“+”表示有细胞显示绿色荧光;病毒对照:鸡成纤维细胞+VSV-GFP;细胞对照:仅鸡成纤维细胞。
3 讨论
IFN-κ代表一种新的Ⅰ型干扰素亚类,与其他Ⅰ型干扰素家族成员具有30%的相似性。基因的位置和结构表明,IFN-κ与其他Ⅰ型干扰素存在明显的进化差异[1]。与其他Ⅰ型干扰素相比,IFN-κ的表达存在细胞特异性,并且仅由模式识别受体途径适度诱导表达[5,15-17]。禽类的IFN-κ目前研究较少,本研究成功地利用家蚕杆状病毒表达系统高效的表达具有生物学活性的chIFN-κ,该系统经过基因改造,具有重组率高(理论接近100%)、可在大肠杆菌中进行操作等优势[13]。同时,相比于原核表达系统,真核表达系统具有更为完善的糖基化、乙酰化等翻译后加工过程,产物结构与天然蛋白更为接近,更适合进行外源蛋白的活性研究。杆状病毒不能在脊椎动物体内复制,具有非常好的生物安全性。利用该系统成功表达的其他种类脊椎动物干扰素均具有良好的生物学活性[13,18-19]。
通过利用Western blotting实验进行验证,相比于野生型BmNPV对照,重组病毒感染的表达产物中检测到了与目的蛋白大小一致的特异性条带。在对VSV-GFP抗病毒活性检测的结果进行分析后,我们发现chIFN-κ在抗VSV-GFP检测中表现出了相比于同系统表达的chIFN-α和chIFN-γ更高的抗病毒活性[20]。尽管Ⅰ型干扰素介导许多相似的生物学活性,但它们的活性相对效力和某些不同的免疫调节作用确实表现出了统计学差异[1,3,21-24]。同时其他Ⅰ型IFN缺少IFN-κ启动子中存在的CpG岛,而这种结构可能与病毒感染后IFN-κ的快速诱导有关[15]。因此,IFN-κ与其他干扰素存在不同的调控方式,具有独立的功能。此外,尽管所有Ⅰ型IFN都结合相同的受体复合物,但是与受体的相互作用及信号转导途径的诱导可能仍然不同,从而影响后续的抗病毒反应[25]。IFN-κ被认为在病毒感染后期发挥着至关重要的作用[26]。
现有的Ⅰ型IFN已经成功用于治疗多种疾病,并在畜牧业生产中有了广泛的应用。但是,现有IFN在使用过程中容易引起动物发热、疲倦等影响生长的副作用,同时它们的功效可能受到中和抗体及病毒感染时相的影响[27-29]。而本研究利用家蚕杆状病毒所表达的IFN-κ有希望成为一种新的治疗手段,以其生产成本低、活性好、生物安全性高等优点成为生产中现有的Ⅰ型干扰素产品的补充,用于抗病毒药物及疫苗增强剂的开发。同时利用IFN-κ与其他Ⅰ型干扰素的不同点,对复合干扰素的应用进行研究,为进一步研发畜牧业抗病毒制剂提供了理论依据。

