FGFR3 基因R248C 突变致不成比例矮小伴特殊面容和黑棘皮病一例及文献复习
张娟娟,张婉玉,韩晓伟,肖 园,陆文丽,吕 圣
(上海交通大学医学院附属瑞金医院儿内科,上海 200025)
成纤维细胞生长因子受体 (fibroblast growth factor receptor,FGFR)参与了胚胎发生、血管生成和组织内环境平衡[1]。在FGFR 家族中,与身材矮小相关的基因是FGFR3 基因。FGFR3 基因的致病基因变异与许多表型相关,包括软骨发育不全症、软骨发育不良、致死性骨发育不全(thanatophoric dysplasia,TD)、克鲁宗综合征合并黑棘皮病(Crouzon syndrome with acanthosis nigricans,CAN)、Muenke综合征和严重的软骨发育不全伴生长迟滞及黑棘皮病[2-5],这些综合征共同的特征是矮小并伴有不同的其他特征。
本研究报道了1例由于经典型FGFR3 R248C突变而表现为非经典TD 1 型表型的患者,即患者表现出类克鲁宗综合征(Crouzon 综合征)面容、轻微骨骼发育不良和进行性加重的黑棘皮病,并分析其临床表型与基因型的相关性。
资料与方法
一、资料
2017 年,上海交通大学医学院附属瑞金医院儿科内分泌门诊收治了1例13岁余10个月的男性患儿。患儿患有进行性黑棘皮病12 年,身材矮小(发现了10 年),详细询问其病史,并进行体格检查。本研究经本院医学伦理委员会批准,研究过程符合伦理要求。本例患儿及其父母均签署知情同意书,准予患儿相关资料发表,过程符合当地和国家研究伦理委员会制定的协议。
二、方法
1.体检:检查和记录患儿的生长速率、身高、体重、体质量指数,头围、指距、上下部量比、第二性征发育(Tanner 分期)。
2.实验室及影像学检查: 予患儿行糖脂代谢、肝肾功能、电解质检测,计算稳态模型评估的胰岛素抵抗指数,用精氨酸和胰岛素进行生长激素激发试验,行甲状腺功能、性激素、肾上腺皮质功能、染色体核型检测,同时行B 超(甲状腺、甲状旁腺)、肾及肾上腺CT、垂体增强MRI、骨骼X 线片、骨龄等检查。骨龄评估按Greulih.Pyle 图谱法。
3.DNA 测序: 经本例患者及其亲属知情同意后,采集血液样本,用标准方法从白细胞中提取基因组DNA。根据共分离、蛋白质功能预测、公共数据库中的信息,对变异体进行筛选。用迈基诺GenCap 平台技术捕获外显子,然后进行Illumina配对末端测序 (2×100 bp),平均覆盖率至少为200×。将通过全外显子测序发现的变异体,经Sanger 测序进行证实。
结果
一、病史分析
分析患儿病史,发现其身材矮小,生长速率为每年2~3 cm,睡时有轻微打鼾,没有颅缝早闭和听力、视力损害史,发育过程正常,伴轻度多动症,学习成绩落后。患儿为足月顺产儿,出生体重为3 750 g,出生身长为50 cm。母亲和父亲的身高分别为150 cm和171 cm,靶身高计算为167 cm。患者的姐姐身体健康,身材正常。患者无明显遗传性疾病家族史。
二、临床表现
查体显示,患儿的身高为142.6 cm[-3.05 SD],体重为44.0 kg(+1.04 SD),体质量指数为21.8 kg/m2(+1.55 SD),显示为不成比例的身材矮小(上部量/下部量=1.5),头围正常(55.5 cm),指距为140.0 cm(小于身高5 cm)(见图1);阴茎长为G2 期,阴毛分期1;双侧睾丸体积均为6 mL;有轻微面部畸形特征(见图2),如额骨前凸和鼻梁塌陷、眼睑裂下斜、耳向后旋转、齿错位咬合,没有鼻后孔闭锁。

图1 患者表现出不成比例的矮小身材(上部量/下部量=1.5)(患儿父母同意公布这些照片)
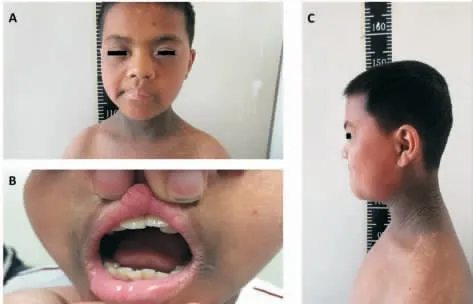
图2 轻微面部畸形
患儿皮肤病学表现为弥漫性黑棘皮病,皮损处为棕色至黑色,界限不清,呈天鹅绒状色素沉着,主要位于身体褶皱处,如颈部、腋窝和腹股沟(见图3),眼眶周围及口周也有所累及,但掌跖及黏膜未受累。患儿有广泛的皮肤增厚,特别是在躯干。此外,患者脸部和上躯干可见数个小疣棘皮瘤及黑素细胞痣。

图3 严重黑棘皮病
三、实验室检查
患儿的胰岛素抵抗指数为2.80,表明其存在胰岛素抵抗;其他评估代谢水平的检验包括葡萄糖水平、糖化血红蛋白、脂代谢和肝肾功能检测,结果均正常。
生长激素激发试验显示,患儿的生长激素峰值(12.65 ng/mL)及胰岛素样生长因子1(334 ng/mL)、胰岛素样生长因子结合蛋白3(4.76 μg/mL)水平均正常。甲状腺功能检查显示,患儿的甲状腺总三碘甲状腺原氨酸(2.62 nmol/L)、游离三碘甲状腺原氨酸 (5.90 pmol/L)、反式三碘甲状腺原氨酸(131.9 ng/dL)及降钙素水平(13.32 pg/mL)均升高,而其促甲状腺激素、甲状腺抗体和甲状旁腺激素水平正常。患儿的性激素包括促卵泡激素、黄体生成激素、血清总睾酮和催乳素水平均正常。肾上腺功能检测显示,其促肾上腺皮质激素正常,而早晨8 点的游离皮质醇水平处于正常范围的低限(6.55 μg/dL)(1 L=10 dL)。
四、影像学及病理检查
甲状腺超声检查显示,患儿双侧甲状腺的两极有数个明显的低回声实性结节,边缘光滑,内有胶质,甲状腺影像报告和数据系统 (thyroid imaging reporting and data system,TI-RADS)分级为2 级,甲状旁腺显像正常。垂体增强MRI 检查(见图4)和肾脏及肾上腺CT 检查结果均显示正常。骨骼X 线摄片显示患者有轻度的脊柱侧凸,但没有面中部发育不良、短头畸形和软骨发育不全的证据(见图5)。

图4 矢状面MRI 显示小脑扁桃体大小正常且无脑室肿大

图5 患儿的骨骼X 线片未提示影像学异常
患者的骨龄检测结果为13岁;染色体核型为46,XY;皮肤病理活检提示为表皮乳头瘤样增生,符合黑棘皮病病理表现。
五、DNA 测序
患儿的全外显子测序结果显示,其存在FGFR3基因散发突变(NM_00142:c.742C>T;Chr4:1 803564;p.R248C)(见图6)。对患儿父母的DNA 进行Sanger测序,检测结果为阴性,表明患儿的该突变为新发突变。该突变经美国医学遗传学与基因组学学会指南(2015)证实为致病突变(证据PS2+PS3+PM2+PP4)。

图6 测序图
讨论
FGFR 家族包括4 种主要的跨膜受体酪氨酸激酶(FGFR1~FGFR4),参与了胚胎发生、血管生成和组织内环境平衡[1]。FGFR3 基因含有19个外显子,编码由3个Ig 样结构域、1个疏水性跨膜结构域和2个细胞质酪氨酸激酶结构域组成的配体结合胞外区[6]。FGFR3 基因激活突变可导致长骨骺板软骨细胞生长的负调控,引发侏儒症[7]。
生殖系FGFR3 突变会导致不成比例的身材矮小和颅缝早闭综合征,患者有时还可伴发黑棘皮病。1995 年,Tavormina 等[8]首次报道了在TD 中发现的经典型胚系FGFR3 R248C 突变,所有TD 病例中约50%存在该突变,而TD 1 型病例中有60%存在该突变[9]。在长期存活的TD 1 型患者皮肤中还发现了相同FGFR3 R248C 突变导致的黑棘皮病[5]。本例报道的患儿,下肢短伴进行性加重的黑棘皮病,与经典型TD 表型部分一致。此外,TD 通常表现为新生儿致死性骨骼发育不良,其特征是四肢短小、胸腺发育不全和巨颅。TD 1 型是最常见的亚型,以弯曲的股骨和偶发的三叶草头骨为特征,而三叶草头骨和短而直的股骨是TD 2 型的特征。受累的病例通常在出生几分钟或几天内死亡,且大多死于呼吸衰竭[8]。然而,本研究的该例患儿没有观察到头颅骨的影像学阳性表现,且该患儿为青少年,因此本病例与经典型TD 表型并不完全相符。
本研究的该例患儿其临床特征也与CAN 患者非常相似。CAN 的特征包括特殊颅面畸形,表现为眼睑裂下斜、后旋耳和齿错位咬合以及儿童早期发生的重度黑棘皮病,患者也可表现出轻微和多变的骨骼异常,与本研究患儿的表现一致。然而,本研究的该例患儿缺乏其他特殊颅面表型,尤其是颅缝早闭(双冠)和面中部发育不全,提示其为特殊表型。此外,FGFR3 基因Ala391Glu 突变是迄今为止所发现唯一能导致CAN 的突变[10]。因此,结合以上不完全相符的临床表型和不一致的突变位点,本研究的该例患儿并不能诊断为CAN。
本研究的该例患儿基因型与TD 1 型的临床表型存在一定差异,可能的解释是由于FGFR3 基因中相同突变的不同嵌合体水平所致。因此,由于R248C 突变的体细胞嵌合现象,该患儿突变等位基因的表达水平降低可能是导致其表型减弱的原因。事实上,人类R248C 突变似乎具有广泛的临床谱系[11],包括以下几项。①仅限于皮肤角蛋白细胞的嵌合现象;②除皮肤外,涉及其他器官系统的更广泛的嵌合现象,如大脑或骨骼(本病例)[12-13];③生殖系突变导致的TD 1 型。对于本研究的该例患儿,由于其存在生殖系嵌合,因此其后代的R248C 突变都将表现为非嵌合,从而表现为致死性TD 1 表型。本研究通过进一步比较原始数据突变碱基与野生型比例(17/50),初步证实该突变为嵌合,解释了该病例患者携带致死性FGFR3 R248C 突变但临床表型相对较轻的原因。
所有已知FGFR3 突变的致病机制都与促进FGFR3 的二聚化相关,但具体机制取决于突变位点。TD 1 型相关的FGFR3(R248C)蛋白通过形成共价结合的二聚体激活,该二聚体由FGFR3(R248C) 蛋白的细胞外结构域IgⅡ、IgⅢ与游离半胱氨酸残基通过二硫键结合组成,从而形成BsiHKA I 限制性位点[14-15]。FGFR3 除了表达于软骨,还表达于脑、肺、脊髓[16-17],但其主要生理功能仍为调节软骨生长,FGFR3 是骨骼生长的生理性负调控因子,可通过抑制软骨细胞增殖限制长骨长度。
皮肤细胞过度增殖都是由FGFR3 突变引起,这表明FGFR3 对包括角蛋白细胞、黑素细胞、上皮细胞、淋巴细胞和精母细胞在内的多种细胞类型具有促有丝分裂作用。多发性骨髓瘤相关研究结果支持这一假设,其中携带TD 相关突变的FGFR3 突变被作为真正的癌基因,其可促进肿瘤细胞的增殖和存活,以及减少其对外部有丝分裂刺激的生长依赖性,为肿瘤细胞生长提供了优势。各细胞类型有不同的信号通路,如Ras/MAPK 和STAT,其通过不同的修饰作用,作用于FGFR3 依赖的细胞特异性第二受体(如EphA4)[18],从而决定了FGFR3 细胞特异性的突变表型[1]。
本研究首次报道了由经典型FGFR3 R248C 突变而表现出类克鲁宗综合征面容、轻微骨骼发育不良和进行性加重的黑棘皮病的特殊表型,并观察到该患儿TD 表型的缺失(特别是骨骼)为细胞嵌合现象所致的结果,提示如果患者表现为不成比例的矮小和(或)眼睑裂下斜、耳向后旋转、齿错位咬合,则需要排除FGFR3(嵌合)突变,尤其是伴有早期发病的黑棘皮病时,则高度提示其可能存在FGFR3突变。

