SARS-CoV-2抗体检测在新型冠状病毒肺炎诊断中的应用价值
汪建茹, 杨进波, 张 驰
(1.湖北医药学院附属襄阳市第一人民医院检验科,湖北 襄阳 441000;2.华中科技大学同济医学院附属同济医院检验科,湖北 武汉 430030)
2019年12月底以来,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[1]感染引发的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)在全球范围内迅速蔓延。SARSCoV-2具有较强的传染性,并多呈家庭聚集性,给疾病的诊断和治疗带来较大压力。目前,在国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中,将SARS-CoV-2核酸阳性作为COVID-19的确诊依据[2]。但SARSCoV-2核酸检测对于实验室条件、检测人员素质和样本采集及运输要求较高,且在疫情暴发流行初期存在试剂盒质量参差不齐、供应不足、检验人员易感染、检测通量较低等缺点[3-4]。另外,SARS-CoV-2在引物设计上可参考的序列有限,且会出现变异,采样人员培训不到位导致采样不合格,采样部位不同(肺泡灌洗液、痰液、鼻咽拭子)会导致敏感性出现差异[5-7],这些因素都会导致SARS-CoV-2核酸检测的假阴性结果的增多,使部分疑似患者不能及时确诊。人体在感染病原体后,免疫系统会针对病原体抗原产生特异性抗体,因此检测患者血液中的特异性抗体也是一种常用的病原体快速诊断方法。基于胶体金免疫层析法(colloidal gold immunochromatography assay,CGIA)开发的SARS-CoV-2抗体检测试剂盒具有操作简单,无需设备,对检测人员和环境无特殊要求等优点,可用于COVID-19的快速筛查。本研究采用CGIA检测血清SARS-CoV-2 IgM和IgG抗体,评估其在COVID-19诊断中的价值。
1 材料和方法
1.1 研究对象
选取2020年1月28日—2月29日湖北医药学院附属襄阳市第一人民医院COVID-19患者173例,其中男83例、女90例,年龄(57.4±15.4)岁。173例患者中有140例为首次SARS-CoV-2核酸检测阳性,有33例首次SARS-CoV-2核酸检测为阴性,连续追踪后检测结果由阴性转阳性,最终确诊。COVID-19诊断符合国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[2]:(1)发病前2周内有武汉市旅行史或居住史;或发病前14 d内曾接触过来自武汉市的发热伴有呼吸道症状,或有聚集性发病;(2)发热,肺部影像学检查结果异常(呈斑片状、亚段或节段性磨玻璃影或病灶实变,磨玻璃影与实变影或条索影共存,累及多个肺叶;或双肺弥漫性病变,少数呈“白肺”表现),初期血象白细胞、淋巴细胞降低等;(3)痰液、咽拭子、下呼吸道分泌物等样本SARSCoV-2核酸检测阳性;满足(3)以及(1)或(2)中的任意一条即可确诊。选取同期湖北医药学院附属襄阳市第一人民医院排除COVID-19的疑似患者101例(对照组),其中男59例、女42例,年龄(57.9±14.7)岁。对照组均有发热、咳嗽等症状,但痰液、咽拭子、下呼吸道分泌物等样本多次SARS-CoV-2核酸检测为阴性,血象和肺部影像学特征不符,伴或不伴甲型/乙型流感病毒、呼吸道合胞病毒、腺病毒等阳性。本研究经湖北医药学院附属襄阳市第一人民医院伦理委员会审查批准(批件号:2020GCP018),并通过知情同意的豁免申请。
1.2 方法
1.2.1 样本采集 采用含分离胶的黄头真空采血管采集所有对象空腹静脉血5 mL,室温下静置,待血液完全凝固后1 260×g离心5 min,分离血清,2~8 ℃保存,5 d内完成检测。如5 d内无法完成,则需将样本-20 ℃保存,冻融不超过3次。含悬浮纤维蛋白或聚合物的血清样本离心后取上清液进行检测,溶血及其他微生物污染样本不可进行检测。依据标准操作程序采集所有对象的鼻咽拭子样本,用于SARS-CoV-2核酸检测。所有样本均用密封袋单个密封,并使用带有醒目生物危害标识的专业转运箱转运,从密封袋取出样本进行操作前须用75%乙醇喷雾消毒采样容器外壁。
1.2.2 SARS-CoV-2 IgM和IgG抗体检测 采用CGIA检测SARS-CoV-2 IgM和IgG抗体,试剂盒由北京新兴四寰生物技术有限公司生产,严格按试剂说明书操作。基本原理:IgM抗体检测卡在金标垫上包被胶体金标记的鼠抗人IgM单克隆抗体胶体金标记物,在硝酸纤维素膜上检测线(T线)位置包被重组SARS-CoV-2 Np抗原,质控线(C线)位置包被山羊抗小鼠IgG多克隆抗体;IgG抗体检测卡在金标垫上包被胶体金标记的鼠抗人IgG(γ链)单克隆抗体,在硝酸纤维素膜上检测线(T线)位置包被重组SARSCoV-2 S蛋白抗原,质控线(C线)位置包被山羊抗小鼠IgG多克隆抗体。将适量的待检血清样本加入检测卡的加样孔,血清会在层析作用下向前移动,当血清中含有SARS-CoV-2 IgM/IgG抗体时,该抗体就会与相应的金标抗体结合,形成金标抗体+抗体免疫复合物,该免疫复合物在层析作用下继续在硝酸纤维素膜上向前流动。当该免疫复合物经过T线时与包被的重组SARSCoV-2 Np抗原/S蛋白抗原结合,形成复合物而凝集显色,游离的金标鼠抗人IgM单克隆抗体/IgG(γ链)抗体则与C线处包被的羊抗鼠IgG多克隆抗体结合而凝集显色。判断标准:T线和C线处均显色判定为阳性,仅C线处显色判定为阴性。如C线未显色,则表明检测结果无效。
1.2.3 SARS-CoV-2核酸检测 选取SARSCoV-2 RNA基因序列中开放读码框1ab(open reading frame 1ab,ORF1ab)和核壳蛋白(nucleocapsid protein,N)作为扩增靶区域,采用荧光定量聚合酶链反应(polymerase chain reaction,PCR)进行检测。SMART32自动核酸提取仪、AGS4800型荧光PCR仪、SARS-CoV-2ORF1ab/N基因双重核酸检测试剂盒均购自中山大学达安基因股份有限公司。循环阈值(cycle threshold,Ct)的判读标准参照试剂盒说明书,出现可疑结果重新采样复查。以同一份样本中SARS-CoV-2的ORF1ab和N基因至少1个靶标检测结果阳性判定为SARS-CoV-2核酸阳性。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,多组间比较采用非参数Kruskal-WallisH检验,两两比较采用Dunn's检验。计数资料以率表示,组间比较采用配对资料McNemarχ2检验。采用kappa一致性检验评估核酸检测结果与抗体检测结果的一致性。以临床诊断结果为金标准,计算SARS-CoV-2抗体诊断COVID-19的敏感性、特异性、临床总符合率等指标。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估SARSCoV-2抗体诊断COVID-19的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 SARS-CoV-2 IgM抗体诊断COVID-19的准确性
SARS-CoV-2 IgM抗体诊断COVID-19的敏感性为76.9%,漏诊率(假阴性率)为23.1%;特异性为94.0%,误诊率(假阳性率)为6.0%;临床总符合率为83.2%(表1)。SARS-CoV-2 IgM抗体诊断COVID-19的结果与临床诊断(金标准)比较,差异有统计学意义(χ2= 23.67,P<0.000 1)。SARS-CoV-2 IgM抗体与临床诊断的kappa值[95%可信区间(confidence interval,CI)]为0.663(0.577~0.749)。

表1 SARS-CoV-2 IgM抗体与临床诊断的比较
2.2 SARS-CoV-2 IgG抗体诊断COVID-19的准确性
SARS-CoV-2 IgG抗体诊断COVID-19的敏感性为74.6%,漏诊率(假阴性率)为25.4%;特异性为95.1%,误诊率(假阳性率)为4.9%;临床总符合率为82.1%(表2)。SARS-CoV-2 IgG抗体诊断COVID-19的结果与临床诊断(金标准)比较,差异有统计学意义(χ2=29.47,P<0.000 1)。SARS-CoV-2 IgM抗体与临床诊断的kappa值(95%CI)为0.664(0.558~0.731)。
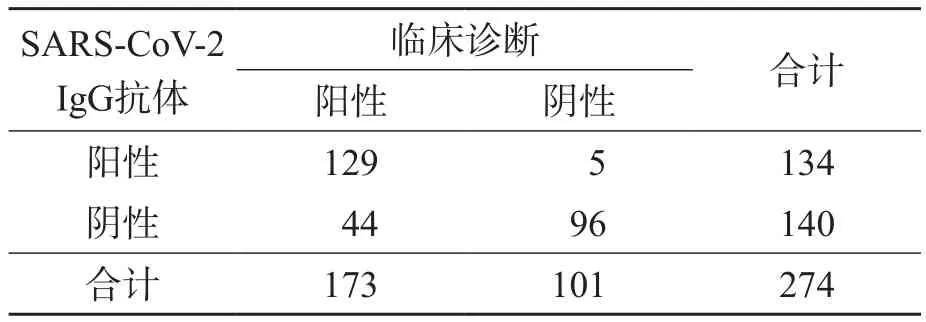
表2 SARS-CoV-2 IgG抗体与临床诊断的比较
2.3 SARS-CoV-2 IgM抗体和IgG抗体诊断COVID-19的效能
ROC曲线分析结果显示,SARS-CoV-2 IgM抗体和IgG抗体诊断COVID-19 的曲线下面积(area under curve,AUC)(95%CI)分别为0.855(0.807~0.894)、0.848(0.800~0.888),二者比较,差异无统计学意义(P>0.05)。见图1。

图1 SARS-CoV-2 IgM抗体和IgG抗体诊断COVID-19的ROC曲线
2.4 20例SARS-CoV-2核酸检测阴转阳患者的抗体检测追踪结果
对20例首次SARS-CoV-2核酸检测为阴性者,每隔1 d进行核酸、IgG抗体和IgM抗体的检测,直至所有指标均呈阳性为止。如始终为阴性,最长观察时限为25 d。首次SARS-CoV-2核酸检测结果呈阳性的时间为9.5(6.3~12.8)d,IgM抗体首次呈阳性的时间为6.0(5.0~8.0)d,IgG抗体首次呈阳性的时间为11.0(9.5~15.0)d。所有患者IgM抗体均为阳性,有3例患者IgG抗体始终为阴性。SARSCoV-2核酸、IgG抗体和IgM抗体的阳性检测时间差异均有统计学意义(P<0.05)。见图2。

图2 20例首次SARS-CoV-2核酸检测阴性患者血清SARS-CoV-2核酸、IgG抗体、IgM抗体阳性检出时间
3 讨论
SARS-CoV-2属于冠状病毒β属的单链RNA病毒,有蛋白质包膜,其颗粒呈圆形或椭圆形,直径为60~140 nm,是冠状病毒家族中第7个能够感染人类的成员,其家族成员还包括可引起严重呼吸道疾病的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome-related coronavirus,SARSr-CoV)和中东呼吸综合症冠状病毒(middle east respiratory syndrome-related coronavirus,MERSr-CoV)[8]。SARS-CoV-2具有极强的人际传播能力,致死率为3.4%[9],仅次于MERSr-CoV和SARSr-CoV。应对COVID-19最好的策略是“早发现、早隔离、早治疗”,但疫情初期,SARS-CoV-2核酸检测存在采样风险高、检测时间长、检测能力不足、检测敏感性不高等问题,以致“三早”策略较难实施。本研究使用的基于CGIA开发的SARS-CoV-2 IgM/IgG抗体检测试剂盒具有操作简便、无需设备,对人员和环境无特殊要求等优点,已成为诊断COVID-19的重要补充方法[2]。
有研究结果显示,试剂盒参次不齐的质量、不合格的采样管、有问题的取材、不同的RNA提取技术、患者用药情况等均会导致SARS-CoV-2核酸检测出现假阴性结果[3],与本研究SARS-CoV-2核酸检测情况(假阴性率为19%)相符。因此,对于高度疑似患者,应进行多次核酸检测予以确认。SARS-CoV-2抗体检测不受样本取材、采样管、临床用药等因素的干扰,在一定程度上可规避核酸检测的固有缺陷。本研究结果显示,SARS-CoV-2抗体检测的临床符合度较高。对首次核酸阴性而后转为阳性的20例患者进行追踪观察,结果显示,有8例患者SARS-CoV-2 IgM抗体在5 d内转为阳性,另12例患者IgM在25 d内全部转为阳性,阳性率达100%;SARS-CoV-2 IgM抗体的阳性中位检出时间为6.0 d,比核酸阳性时间早3.5 d(核酸阳性中位检出时间为9.5 d),提示IgM抗体作为初次体液免疫应答中最早出现的抗体,在用于COVID-19早期诊断时可较好地弥补SARS-CoV-2核酸检测的不足。20例患者中有17例(85.0%)SARS-CoV-2 IgG抗体在5 d后才出现阳性,有3例患者25 d的追踪期内IgG抗体始终呈阴性;SARS-CoV-2 IgG抗体的阳性中位检出时间为11.0 d,比核酸阳性时间晚1.5 d,这说明IgG抗体一般只在感染后期或恢复期出现,可用于SARS-CoV-2既往感染情况的调查,也可用于患者康复后再次感染风险的评估[10-11]。值得一提的是,本研究中3例IgG抗体始终为阴性的患者均出现呼吸衰竭,需要机械通气,属于危重症患者,可能其病情较重,病毒感染对机体免疫系统的损伤和抑制作用导致机体迟迟无法产生保护性IgG抗体。
本研究采用CGIA检测SARS-CoV-2抗体的敏感性低于徐万洲等[12]的化学发光免疫分析法的敏感性,原因可能为本研究采用的是入院时的单次检测数据,而血清学抗体检测存在窗口期、个体免疫应答差异等固有缺陷;也可能与检测原理及金标试剂盒本身的检测性能有关。另外,有研究结果显示,血清中较高的类风湿因子水平会对GICA和酶联免疫吸附试验检测SARS-CoV-2 IgM抗体产生干扰,导致检测结果出现假阳性[13]。因此,临床上采用SARS-CoV-2抗体检测结果进行疾病评估时,应充分考虑假阴性和假阳性的情况,并结合患者临床表现、影像学检查结果、疫区接触史、核酸检测结果等因素进行综合考虑。
综上所述,SARS-CoV-2抗体检测具有较高的敏感性、特异性和临床符合率,可弥补SARSCoV-2核酸检测的不足,为COVID-19的诊断、治疗监测和预后等方面提供更多的实验室依据。

