CD55、CD59联合嗜水气单胞菌毒素变异体检测对PNH的诊断价值
鲁家才, 黄 莹, 莫 扬, 周小芬, 姚 欣
(襄阳市中心医院 湖北文理学院附属医院,湖北 襄阳 441021)
CD55、CD59属于糖化肌醇磷脂(glycosylphatidylinositol,GPI)锚链膜蛋白,普遍存在于血细胞膜上。PIG-A基因突变可导致GPI锚链膜蛋白合成障碍,引起补体活化和细胞溶解。CD55、CD59缺陷是阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,PNH)的主要临床特征,部分干细胞疾病和淋巴增殖性疾病均可检出PNH克隆[1-2]。嗜水气单胞菌毒素变异体(fluorescent aerolysin,FLAER)能与细胞膜上的GPI锚链膜蛋白结合,聚合成多聚体,插入细胞膜脂质中,形成孔洞,使细胞渗透压改变,从而被溶解。然而,血型糖蛋白与嗜水气单胞菌毒素结合力较弱,限制了FLAER对红细胞的检测能力[3]。本研究旨在探讨CD55、CD59联合FLAER检测对PNH的诊断价值。
1 材料和方法
1.1 研究对象
选取2015年3月—2017年7月襄阳市中心医院血液科贫血住院患者157例,其中男87例、女70例,年龄(48.1±19.3)岁。根据贫血诊断标准[4],将其分为缺铁性贫血(iron deficiency a n e m i a,I D A)3 8例、巨幼细胞性贫血(megaloblastic anemia,MA)23例、骨髓增生异常综合征(myelodysplastic syndrome,MDS)27例、再生障碍性贫血(aplastic anemia,AA)25例、自身免疫溶血性贫血(autoimmune hemolytic anemia,AIHA)31例、PNH 13例。另选取襄阳市中心医院体检健康者20名,作为正常对照组,其中男10名、女10名,年龄(48.9±14.5)岁,均无贫血史。
1.2 仪器与试剂
FC500流式细胞仪购自美国Beckman Coulter公司;CD59-FITC、CD55-PE、CD45-PerCP、红细胞裂解液购自美国BD公司;CD15-PE、CD14-APC、FLAER-FITC和磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购自美国Beckman Coulter公司。
1.3 方法
采集所有研究对象2.0 mL外周血,并进行乙二胺四乙酸二钾抗凝处理。
1.3.1 红细胞标记及检测 取5 μL抗凝全血,加入含100 μL PBS的流式专用试管中,轻轻混匀,分别加入20 μL CD59和20 μL CD55,混匀,避光孵育15 min后,加入1 mL PBS,待检。在FSCSCC散点图上选定红细胞群,设门、圈出欲分析的细胞群,计算红细胞CD55和CD59表达水平。
1.3.2 粒细胞标记及检测 取100 μL抗凝全血,加入流式专用试管中,加溶血素1 mL,充分混匀,避光孵育10 min后,300×g离心5 min,弃上清液,加入1 mL PBS,300×g离心5 min,弃上清液,分别加入20 μL CD59和20 μL CD55,混匀,避光10 min后,加入0.3 mL PBS,待检。在FSCSCC散点图上选定粒细胞群,设门、圈出欲分析的细胞群,计算粒细胞CD55和CD59表达水平。
1.3.3 粒细胞、单核细胞FLAER检测 取100 μL抗凝全血,加入CD45、CD14、CD15、FLAER抗体各10 μL,避光孵育30 min后,加溶血素2 mL,室温下避光10 min,溶血完全后300 ×g离心5 min,弃上清液,用2 mL PBS洗涤2遍,重新悬于500 μL的PBS中,上机检测。分析8 000个有核细胞,以SCC/CD45设门,分别圈出粒细胞和单核细胞。以FLAER-/CD15细胞百分比为粒细胞PNH克隆数,以FLAER-/CD14细胞百分比为单核细胞PNH克隆数。
1.4 统计学方法
由于外周血CD55-、CD59-离散程度较大,故数据资料采用CD55-、CD59-百分比表示。将CD55-、CD59-百分比>10%视为对PNH有诊断价值;另将FLAER-百分比>0.5%视为存在PNH克隆,对PNH有诊断价值[5]。呈正态分布的计量资料以±s表示,组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 红细胞和粒细胞CD55、CD59检测结果
正常对照组红细胞和粒细胞CD55-、CD59-百分比均<5%,PNH组红细胞和粒细胞CD55-、CD59-百分比均>20%,PNH组与正常对照组比较,差异有统计学意义(P<0.05),见表1。PNH组CD55、CD59、FLAER阴性患者(阴性细胞过高患者)粒细胞CD55-、CD59-百分比分别高于红细胞CD55-、CD59-百分比(P<0.05),见表2。
表1 各组CD55-、CD59-、FLAER-百分比 %,±s
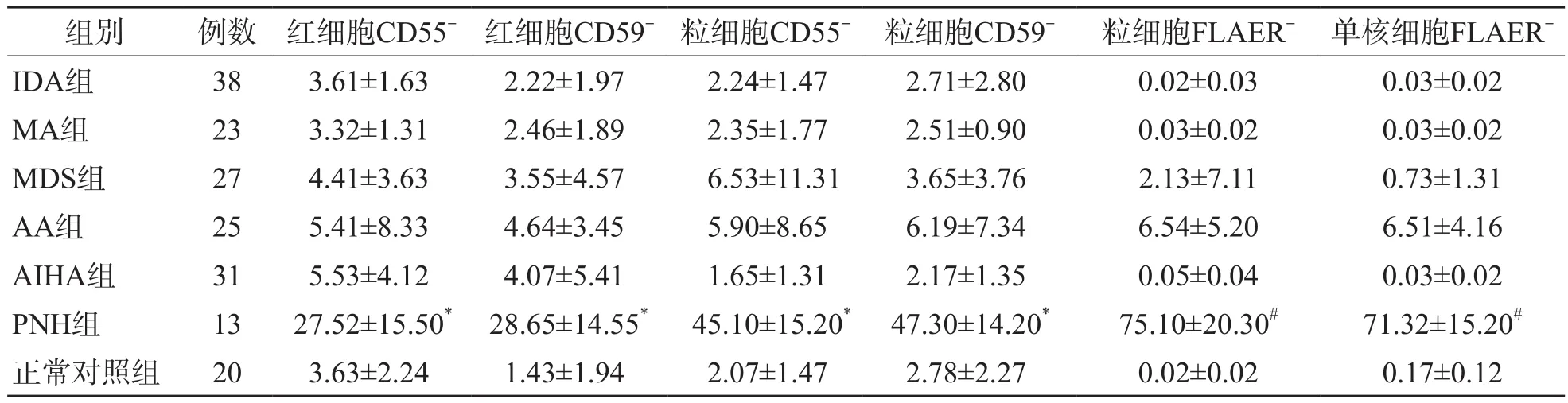
表1 各组CD55-、CD59-、FLAER-百分比 %,±s
注:与正常对照组比较,*P<0.05;与红细胞和粒细胞CD55-、CD59-比较,#P<0.05
组别 例数 红细胞CD55-红细胞CD59-粒细胞CD55- 粒细胞CD59- 粒细胞FLAER- 单核细胞FLAERIDA组 38 3.61±1.63 2.22±1.97 2.24±1.47 2.71±2.80 0.02±0.03 0.03±0.02 MA组 23 3.32±1.31 2.46±1.89 2.35±1.77 2.51±0.90 0.03±0.02 0.03±0.02 MDS组 27 4.41±3.63 3.55±4.57 6.53±11.31 3.65±3.76 2.13±7.11 0.73±1.31 AA组 25 5.41±8.33 4.64±3.45 5.90±8.65 6.19±7.34 6.54±5.20 6.51±4.16 AIHA组 31 5.53±4.12 4.07±5.41 1.65±1.31 2.17±1.35 0.05±0.04 0.03±0.02 PNH组 13 27.52±15.50* 28.65±14.55* 45.10±15.20* 47.30±14.20* 75.10±20.30# 71.32±15.20#正常对照组 20 3.63±2.24 1.43±1.94 2.07±1.47 2.78±2.27 0.02±0.02 0.17±0.12
表2 各组CD55、CD59、FLAER阴性患者CD55-、CD59-百分比 %,±s

表2 各组CD55、CD59、FLAER阴性患者CD55-、CD59-百分比 %,±s
注:与红细胞CD55-比较,*P<0.05;与红细胞CD59-比较,#P<0.05
组别 例数 红细胞CD55- 红细胞CD59- 粒细胞CD55- 粒细胞CD59-MDS组 2 6.73±4.34 2.41±4.89 6.82±7.34 4.60±4.28 AA组 4 9.77±5.57 5.75±3.44 10.86±7.65 12.73±5.57 AIHA组 2 12.36±6.72 9.12±8.15 1.67±1.28 2.16±1.57 PNH组 13 27.52±15.50 28.65±14.55 45.1±15.20* 47.30±14.20#
2例MDS患者和4例AA患者CD55-、CD59-表达为阳性,但红细胞、粒细胞表达没有一致性。2例AIHA患者红细胞CD55-、CD59-表达增多,但粒细胞表达正常。IDA和MA患者红细胞和粒细胞CD55-、CD59-表达均正常。
2.2 粒细胞和单核细胞FLAER检测结果
PNH组粒细胞和单核细胞FLAER-百分比均>50%,显著高于红细胞和粒细胞CD55-、CD59-百分比(P<0.05)。7例AA患者FLAER-百分比显著高于4例MDS患者(P<0.05),见表3。IDA和MA患者粒细胞和单核细胞FLAER-表达均正常。
表3 各组CD55、CD59、FLAER阴性患者FLAER-百分比 %,±s

表3 各组CD55、CD59、FLAER阴性患者FLAER-百分比 %,±s
注:与MDS组比较,*P<0.05
组别 例数 粒细胞FLAER-单核细胞FLAERMDS组 4 2.67±0.87 2.54±0.85 AA组 7 6.70±4.16* 6.31±4.03*PNH组 13 75.10±20.30 71.32±15.20
2.3 CD55、CD59与FLAER检测结果比较
CD55、CD59与FLAER诊断PNH的符合率为100%。有3例AA患者和2例MDS患者FLAER表达缺失,而CD55、CD59表达正常;有2例AIHA患者红细胞CD55、CD59表达部分缺失,粒细胞CD55、CD59表达正常,FLAER表达正常。
3 讨论
PNH是一种造血干细胞克隆缺陷性疾病,因X染色体上PIG-A基因发生突变,从而导致细胞膜GPI锚链膜蛋白缺陷,CD55、CD59等补体调节蛋白合成减少,细胞对补体敏感性增强,最终引起血管内溶血[6]。PIG-A基因突变在许多疾病中可见,如AA、MDS、浆细胞病、淋巴增殖性疾病[1-2]。本研究结果显示,PNH组红细胞和粒细胞CD55-、CD59-百分比均>20%,CD55、CD59、FLAER阴性患者粒细胞CD55-、CD59-百分比显著高于红细胞CD55-、CD59-百分比(P<0.05),这可能是PNH患者溶血或输血导致红细胞膜PNH克隆数减少所致。PNH组粒细胞和单核细胞FLAER-百分比均>50%,显著高于红细胞和粒细胞CD55-、CD59-百分比(P<0.05),说明FLAER检测对PNH克隆检测更敏感。锚链膜蛋白缺失程度与PNH患者病情有关[7-8]。
31例AIHA患者中有2例红细胞CD55-、CD59-表达增多,但粒细胞表达正常,这可能是AIHA患者红细胞GPI锚链膜蛋白轻度受损或被覆盖所致,其FLAER表达未见异常,提示AIHA患者GPI合成没有缺陷。本研究有3例AA患者和2例MDS患者FLAER表达缺失,而CD55、CD59表达正常,提示FLAER检测相对于CD55、CD59检测来说更敏感,更利于较小PNH克隆的检测。
本研究27例MDS患者中有4例伴PNH克隆,这可能是造血干细胞基因错义突变引起GPI合成缺陷所致,这些随机产生的小克隆干细胞并没有获得生长优势,表达不明显,多为一过性出现,故MDS伴PNH患者的总体生存情况一般不受影响[9]。本研究25例AA患者中有7例伴PNH克隆,PNH克隆的发生与AA关系密切,少数病例在某些条件下可互相转化或伴生,即先表现AA后出现PNH克隆,继而转为AA-PNH综合征,PNH克隆可增多、减少或缺失[9-10]。AA患者PNH克隆的出现可能有助于患者血液学指标的恢复,AA-PNH综合征患者无论是血液学反应率还是无病生存率均优于PNH克隆阴性者[11],故明确AA和PNH的关系可能会有助于早期识别和诊断AA,然而PAH与AA治疗反应之间可能无相关性[12]。
部分PNH患者因全血减少不易与AA、MDS伴有PNH克隆患者进行鉴别诊断,故CD55、CD59联合FLAER检测在PNH诊断及鉴别诊断中有重要价值。FLAER检测能够监测PNH患者或AA、MDS存在小克隆患者的免疫抑制治疗情况,对疾病转归和疗效观察有着重要的作用。

