COPD患者痰液中性粒细胞氧化吞噬功能及相关受体变化的临床意义
闫佩毅, 张 骥, 涂焕平, 张 立, 仇 越, 张锋英, 胡奕雯, 金 姝
(1.上海市普陀区人民医院检验科,上海 200060;2.上海市普陀区人民医院病理科,上海 200060;3.上海市普陀区人民医院呼吸内科,上海 200060;4.上海市普陀区人民医院中心实验室,上海 200060)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以不完全可逆的气流受限为特征的疾病,是一种常见、多发、高致死率的慢性呼吸系统疾病。中性粒细胞的聚集活化是COPD发生的重要环节之一,中性粒细胞及其组分均参与了COPD的发生、发展过程[1-2]。为了进一步阐明COPD可能的发病机制,本研究采用流式细胞术检测COPD患者外周血及痰液的中性粒细胞氧化吞噬功能,同时检测中性粒细胞表面的趋化因子C-C基序受体-1(chemokine C-C receptor-1,CCR1)和Toll样受体(Toll-like receptor,TLR)2 、TLR4的表达,以期了解COPD患者中性粒细胞氧化吞噬功能的改变,探讨COPD发病的可能机制。
1 材料和方法
1.1 研究对象
选取2018年1月—2019年12月上海市普陀区人民医院确诊并住院治疗的COPD急性发作期患者30例(COPD组),其中男16例、女14例,年龄35~82岁,依据慢性阻塞性肺疾病全球倡议(the Global Initiative for Chronic Obstructive Lung Disease,GOLD)指南2017版[3]的诊断标准确诊。选取同期上海市普陀区人民医院确诊并住院治疗的肺炎患者30例(肺炎组)作为疾病对照,其中男12例、女18例,年龄32~88岁。选取同期上海市普陀区人民医院体检健康者30名(正常对照组),其中男14名、女16名,年龄27~79岁。体检健康者外周血白细胞(white blood cell,WBC)计数为(5.9~9.9)×109/L,中性粒细胞百分比为55.0%~68.7%,肝功能指标、肾功能指标及心血管系统指标均无异常。COPD组、肺炎组及正常对照组之间性别、年龄等临床资料比较,差异均无统计学意义(P>0.05)。
1.2 试剂和仪器
Alexa Fluor 488 标记鼠抗人CD282(TLR2)抗体(货号558318,克隆号11G7)、Alexa Fluor 488标记小鼠IgG1同型对照(货号557702,克隆号MOPC-21)、藻红蛋白(phycoerythrin,PE)标记鼠抗人CD284(TLR4)(货号564215,克隆号TF901)、PE标记小鼠IgG1同型对照(货号554680)、Alexa Fluor 647标记鼠抗人CD191(CCR1)抗体(货号557914,克隆号53504)、Alexa Fluor 647标记小鼠IgG2b同型对照(货号557903,克隆号27-35)、多甲藻黄素-叶绿素-蛋白质复合物(peridinin-chlorophyll-protein complex,PerCP)标记鼠抗人CD45抗体(货号347464,克隆号2D1)、PerCP标记小鼠IgG1同型对照(货号550672,克隆号MOPC-31C)、Lysing Solution溶血剂和FASC Flow缓冲液均购自美国BD公司。无荧光的染料二氢若丹明123(dihydrorhodamine123,DHR123;工作溶液浓度为30 μg/mL)、佛波酯(phorbol 12-myristate 13-acetate,PMA;工作溶液浓度为10 μg/mL)均购自美国Sigma公司。二硫苏糖醇(dithiothreitol,DTT)购自生工生物工程(上海)股份有限公司。
FACS Calibur流式细胞仪(美国BD公司),80-2型台式离心机(上海和欣科教设备有限公司),LA-920-3垂直层流洁净工作台(上海上净设备有限公司),QL-901型旋涡混合器(江苏海门医疗仪器厂)。
1.3 方法
1.3.1 样本采集 采集所有对象静脉血2 mL,乙二胺四乙酸二钾抗凝,24 h内完成外周血中性粒细胞氧化吞噬功能及相关受体(TLR2、TLR4和CCR1)的检测。肺炎患者和COPD患者早晨用生理盐水漱口后,留取晨起第一口深部痰。用镊子取痰栓,在显微镜下观察鳞状上皮细胞<10个/高倍镜视野、WBC>25个/高倍镜视野为合格痰标本。取空试管,称重后,选取100~500 mg不含唾液的痰标本,放入已称重的试管中,向痰液中加入4倍体积的0.1%DTT溶液,用一次性吸管抽吸几次后置于37 ℃水浴箱内15 min,48 μm尼龙网过滤,滤液以150×g离心5 min,弃上清,沉淀用磷酸缓冲液(phosphatebuffered saline,PBS)重悬后150×g离心,弃上清,沉淀再次用PBS重悬,在显微镜下调整细胞数至 1×106/mL,作为待测样本。
1.3.2 中性粒细胞氧化吞噬功能的检测 取2支流式专用管,分别标记为对照管和刺激管,对照管中加入50 μL PBS,刺激管中加入50 μL PMA,每管分别加入全血或重悬的痰液50 μL,混匀后37 ℃温育15 min。加入DHR123 25 μL,混匀,37 ℃避光温育5 min。每管加入1 mL溶血素(痰液样本无需加入溶血素),室温避光反应10 min,150×g离心5 min,弃上清,加300 μL PBS重悬,上机检测。先用对照管进行设置,用前向散射光(forward scatter,FSC)和侧向散射光(side scatter,SS)进行调整,确保中性粒细胞可以清晰地显示出来。设中性粒细胞门为R1,以对照管为阴性管,在直方图上调整对照管的荧光强度在101之内,记为M1,收集刺激管中的细胞,在对应的直方图上100~101(M1)为阴性细胞,DHR123荧光信号101以上的区域为阳性(M2),见图1。记录M2区域的“%Gated”值,即为中性粒细胞氧化吞噬阳性率,每个样本R1门收集10 000个细胞。

图1 中性粒细胞氧化吞噬能力检测示意图
1.3.3 中性粒细胞表面受体表达的检测 取2支流式专用管,标记为对照管和测试管,测试管依次加入CD282-Alexa Fluor 抗体10 μL、CD284-PE抗体5 μL、CD191-Alexa Fluor抗体5 μL、CD45-PerCP抗体5 μL、50 μL全血或痰液样本,对照管依次加入等量相对应的同型对照抗体和50 μL全血或痰液样本,混匀后室温避光温育25 min,每管加入500 μL溶血剂(痰液样本无需加入溶血素),混匀后室温避光静置10 min,150×g离心5 min,弃上清,加入PBS 1 mL,混匀,150×g离心5 min,弃上清,再加入PBS 300 μL重悬,上机检测。利用SS和CD45-PerCP,以中性粒细胞群设门(R1),检测中性粒细胞表面表达CD282(TLR2)、CD284(TLR4)、CD191(CCR1)的平均荧光强度(mean flourscence indensity,MFI)。数据采用Cell Quest软件进行分析,每个样本每次检测10 000个细胞。2 h内完成检测,以保证结果的准确性。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析。呈正态分布的数据以±s表示,组间比较采独立样本t检验。采用Pearson相关分析评估各项目之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 中性粒细胞门R1的确立
在通过CellQuest软件获取的散点图上,根据CD45-PerCP和SS的参数设定中性粒细胞门R1。见图2。

图2 不同样本的流式散点图
2.2 COPD组、肺炎组和正常对照组外周血中性粒细胞氧化吞噬功能及相关受体的表达
与正常对照组比较,肺炎组和C O P D组中性粒细胞氧化吞噬功能均显著下降(P<0.05),肺炎组与COPD组之间差异无统计学意义(P>0.05)。COPD组、肺炎组及正常对照组之间仅CCR-1表达差异均有统计学意义(P<0.05),而TLR2、 TLR4表达3组之间差异均无统计学意义(P>0.05)。见表1、图3、图4。
2.3 COPD组和肺炎组痰液中性粒细胞氧化吞噬功能及相关受体表达阳性率
与肺炎组比较,COPD组痰液中性粒细胞氧化吞噬功能显著下降(P<0.05),CCR1表达显著升高(P<0.05),TLR2和TLR4表达2个组之间差异均无统计学意义(P>0.05)。见表2、图5、图6。
2.4 相关性分析
Pearson相关分析结果显示,COPD组痰液中性粒细胞氧化吞噬阳性率与CCR1表达呈负相关(r=-0.548,P<0.01),与TLR2、TLR4表达均无相关性(r值分别为-0.206、-0.219,P>0.05)。
表1 COPD组、肺炎组及正常对照组外周血中性粒细胞氧化吞噬百分率及相关受体阳性率比较 %,±s

表1 COPD组、肺炎组及正常对照组外周血中性粒细胞氧化吞噬百分率及相关受体阳性率比较 %,±s
注:与正常对照组比较,*P<0.05;与肺炎组比较,#P<0.05
组别 例数 氧化吞噬百分率 TLR2 TLR4 CCR1正常对照组 30 98.27± 2.58 59.62±19.32 48.70±27.57 61.77±25.89肺炎组 30 93.05±9.24* 54.33±32.86 40.62±22.93 29.04±28.16*COPD组 30 96.22± 3.28* 45.58±34.31 42.45±28.62 40.97±34.58#
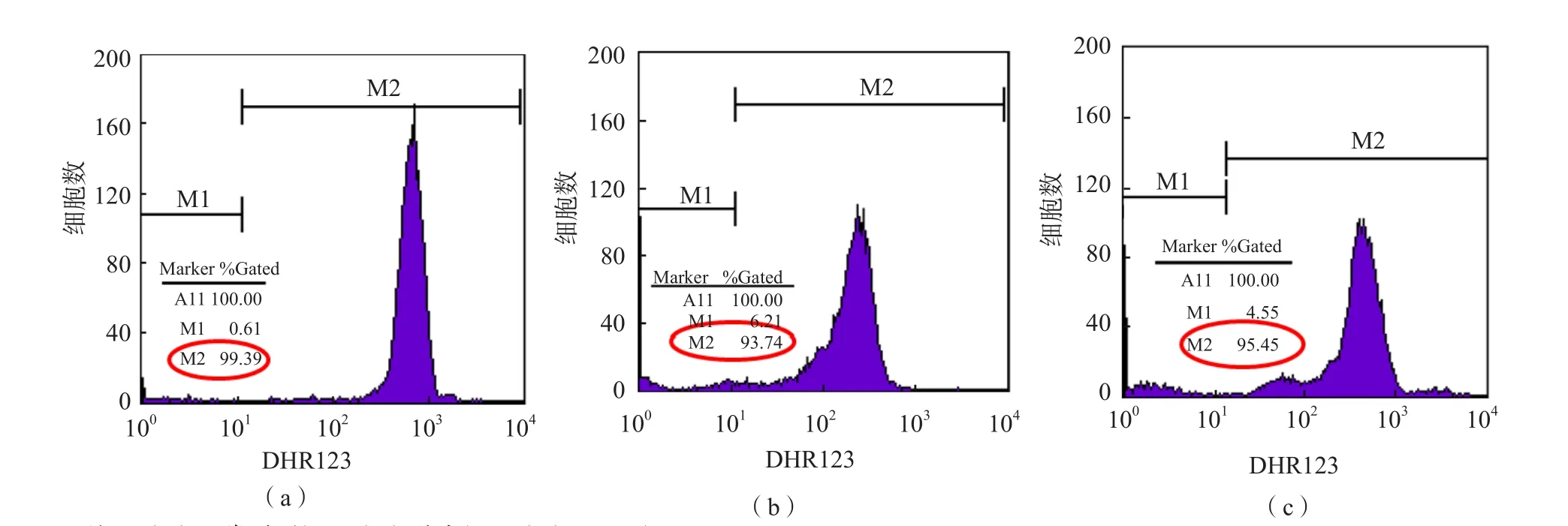
图3 COPD组、肺炎组及正常对照组外周血中性粒细胞氧化吞噬功能的流式直方图

图4 COPD组、肺炎组及正常对照组外周血中性粒细胞表面CCR1、TLR2及TLR4表达的流式直方图
表2 COPD组和肺炎组痰液中性粒细胞氧化吞噬百分率及相关受体的阳性率 %,±s

表2 COPD组和肺炎组痰液中性粒细胞氧化吞噬百分率及相关受体的阳性率 %,±s
注:与肺炎组比较,*P<0.05
组别 例数 氧化吞噬百分率 TLR2 TLR4 CCR1肺炎组 30 51.57±36.50 10.26±9.24 20.86±18.39 15.08±15.03 COPD组 30 33.60±31.73* 12.64±12.13 20.30±19.15 44.99±34.11*

图5 肺炎组和COPD组痰液中性粒细胞氧化吞噬功能的流式直方图

图6 肺炎组和COPD组痰液中性粒细胞表面受体的流式直方图
3 讨论
COPD确切的发病机制目前尚不清楚,一般认为COPD以气道、肺实质和肺血管的慢性炎症为特征,肺部的蛋白酶和抗蛋白酶失衡、氧化与抗氧化失衡也在COPD发病中起重要作用[1]。
有研究结果显示,中性粒细胞的氧化聚集是COPD发生的重要环节之一,中性粒细胞及其组分均参与了COPD的发生、发展[4-6]。趋化因子受体是以趋化因子为配体的跨膜受体家族,中性粒细胞表面的趋化因子受体,如CCR1是其向病原体感染部位迁移或向炎症部位游走的关键分子。WANG等[7]的研究结果显示,炎症细胞上CCR1的表达与COPD的严重程度有关。TLR是一类天然的免疫受体,在各种炎症反应细胞吞噬作用的调节和细胞信号传导及细胞凋亡中起重要作用。TLR作为病原识别受体对中性粒细胞的功能起着决定性的作用,在炎症的发生、发展及转归中发挥重要的调控作用[8]。
中性粒细胞在COPD的发病过程中起重要作用,但中性粒细胞胞质内的细胞毒性物质在杀伤入侵的病原微生物的同时可能也会造成自身组织细胞的损伤。目前的研究多聚焦于COPD患者中性粒细胞数量的增多是否由凋亡减少而引起细胞寿命延长导致,但还未找到中性粒细胞寿命延长的明确证据,甚至有一些研究结论相互矛盾[9-11]。近年来,学者们逐渐将研究方向转向中性粒细胞自身功能方面。PRIETO等[12]的研究结果显示,COPD患者存在多形核白细胞吞噬活性的缺陷。动物实验已证实,在假单胞菌感染的鼠模型中,香烟烟雾提取物会削弱中性粒细胞的吞噬作用[13-14]。SAPEY等[15]的研究结果显示,COPD患者中性粒细胞自身功能可能有缺陷,其趋化行为和移行结构与其他人群有着本质上的差异。为此,本研究对中性粒细胞的氧化吞噬功能进行了探讨。因COPD属于气道炎症,而肺炎为非气道炎症,以肺炎作为疾病对照可更好地证明研究结论是气道炎症所特有的。同时检测COPD患者外周血与痰液中性粒细胞的氧化吞噬功能能更好地反映整体与局部的关系。
本研究采用的流式细胞术-DHR123方法是一种临床常用的评价中性粒细胞氧化吞噬功能的方法。DHR123被激活的中性粒细胞吞噬,中性粒细胞发挥吞噬作用时产生的呼吸爆发使DHR123在氧化反应中被还原为具有绿色荧光的若丹明123(rhodamine 123,Rho123),从而成为流式细胞仪的检测信号。这种方法的检测结果可同时反映中性粒细胞的吞噬和氧化2种功能,任何一种功能缺陷都将影响检测结果[16]。
本研究结果显示,肺炎组和COPD组外周血中性粒细胞氧化吞噬功能均显著低于正常对照组(P<0.05),肺炎组与COPD组之间差异无统计学意义(P>0.05);COPD组痰液中性粒细胞氧化吞噬功能显著低于肺炎组(P<0.05),而CCR1表达显著高于肺炎组(P<0.05)。COPD患者CCR1表达升高,可能是COPD患者气道中中性粒细胞的蓄积较肺炎患者多,但因聚集的中性粒细胞的氧化吞噬功能较差,所以COPD患者相对于肺炎患者更易发生气道病理性组织损伤。因此,我们推测COPD患者呼吸道中的中性粒细胞由于自身功能缺陷,导致在感染时的趋化作用过度,精确性下降,尽管中性粒细胞数量增多,但清除病原体的能力不足,最终导致中性粒细胞在肺部的病理性蓄积,进而造成组织损伤。
LIU等[17]的研究结果显示,COPD患者的主要趋化因子受体都含有至少1个酪氨酸硫酸化位点,酪氨酸硫酸化后通过影响信号传导来影响参与COPD发病的相关细胞,如中性粒细胞。酪氨酸硫酸化位点的发现有助于特应性受体-配体拮抗剂的研发,对COPD的治疗有积极的意义。CCR1等趋化因子受体在COPD中起重要作用,深入研究有助于开发用以调节气道疾病重要事件的特异性受体-配体拮抗剂。GLADUE等[18]的研究结果显示,COPD等疾病CCR1表达上调,提示CCR1及其配体的拮抗剂或许可作为治疗这类疾病的手段。
TLR2和TLR4的主要配体分别是革兰阳性菌、革兰阴性菌和真菌,在细菌和真菌感染中起核心作用[19-20]。VON SCHEELE等[21]的研究结果显示,COPD患者支气管肺泡灌洗液中性粒细胞TLR2表达下调可能与其吞噬功能下降有关。本研究结果显示,COPD患者痰液中性粒细胞TLR2和TLR4表达与肺炎组比较,差异均无统计学意义(P>0.05)。原因可能是TLR2和TLR4的表达主要与感染的细菌种类有关,肺炎和COPD患者感染的细菌种类相似,故2种受体表达无明显差异。
综上所述,COPD患者中性粒细胞基础代谢异常活跃,是COPD病程持续进展的重要原因。COPD患者痰液中性粒细胞氧化吞噬功能与其表面CCR1表达有关,提示COPD患者气道中的中性粒细胞的氧化吞噬功能受损,这可能是COPD发病的机制之一。本研究结论为探索以提高中性粒细胞氧化吞噬功能为靶标的控制COPD炎症的治疗策略提供了实验和理论依据。

