基于3D卷积神经网络-感兴趣区域的阿尔茨海默症辅助诊断模型*
曾安, 邹超, 潘丹
(1.广东工业大学计算机学院, 广州 510006;2.广东大数据分析与处理重点实验室,广州 510006;3.广州建设职业技术学院现代教育技术中心,广州 510440)
1 引 言
阿尔茨海默症(AD)是一种常见的神经退行性疾病。轻度认知障碍(MCI)通常被认为是AD的早期阶段,是从正常对照(NC)到AD的过渡状态[1],尤其是晚期MCI很可能发展成AD[2],因此,一般将MCI分为转化AD(MCIc)和未被转化AD(MCInc)。据国际阿尔茨海默病组织(Alzheimer's Disease International)公布[3],2018年全球有5 000万AD患者,到2050年,将增至1.52亿。由于AD致病机理不明,因此,针对AD 的早期诊断对延缓病情恶化尤为重要。
磁共振影像(MRI)对脑萎缩、脑血管疾病和肿瘤等反映灵敏。事实上,在症状出现前期,结构改变所反映的神经功能障碍或损伤将变得尤为明显[4-5]。有研究表明,sMRI影像的体积、皮层厚度、皮层表面积等大脑形态学指标特征可用于诊断AD[6]。Salvatore等[7]针对509张sMRI影像,对被试全脑影像体素采用主成分分析(principal components analysis,PCA)方法进行特征提取,然后将提取到的特征用支持向量机(SVM)进行训练。该方法在分类AD vs NC、MCIc vs NC和MCIc vs MCInc等人群时,分别达到76%、72%、66%,取得了一定的效果,但伴随图像而来的是上百万的体素,而样本的数量是有限的,很可能发生过拟合[8]。一般跟该疾病有关系的是部分脑区,不是整个大脑,其他不相关脑区图像会对分类结果造成影响,因此,可根据疾病特点选择ROI脑区图像作为样本。
近年来,深度卷积神经网络(CNN),因其强大的提取有效特征的能力在医学图像分割、分类和配准任务中得到了广泛运用。曾安等[9]提出了基于MRI影像三个维度的不同二维切片的基分类器集成模型,该模型通过简单8层网络[10]训练出基于sMRI的不同轴(X,Y,Z)切片的基分类器进行集成,该方法在分类AD vs NC、MCIc vs NC和MCIc vs MCInc等人群时,分别达到81%、79%、62%。Hosseini-Asl等[11]提出的深度监督自适应3D CNN (3D-A CNN)模型,通过自编码器提取AD生物标志物,实现了病症的分类。Spasov等[12]提出了一种基于三维可分离卷积的双任务学习的深度学习体系结构,该研究以sMRI影像、人口统计学、神经心理学和APOe4基因数据作为输入,实现了MCI向AD转化的预测。
为了充分利用sMRI影像的有效信息,降低模型训练难度,提升模型泛化能力,从而提高AD预测分类的准确率,本研究提出了一种基于感兴趣区域(ROI)的3D CNN的AD诊断模型。首先,依据先验知识提取sMRI影像中ROI的3D图像,再利用3D CNN网络对ROI图像进行特征提取,以实现对AD的辅助诊断。
2 方法
2.1 ROI图像提取
海马体是AD患者大脑中最具鉴别的部分之一,AD的产生伴随着颞叶和海马体的萎缩,这些生物标识可以通过sMRI影像进行测量。有研究表明,AD影响最严重的区域主要分布在杏仁核、海马、扣带回、丘脑、颞叶、海马旁回等[13-15]。因此,先考虑这些先验知识,从sMRI影像中提取出引起大脑萎缩的ROI图像。

图1 ROI图像的切片示意图Fig.1 Slice of ROI images
受试的左海马(L.Hippocampus)、左海马旁回(L.Parahippocampus)、左杏仁核(L.Amygdala)、左内嗅皮质(L.Olfactory)等ROI图像的切片,见图1。预处理后的图像在大小和坐标空间与AAL automated anatomical labeling)模板[16]一致后,根据模板划分脑区的掩码(Mask)提取特定的ROI图像。依据文献[13-15],对AD vs NC、MCIc vs NC和MCInc vs MCIc提取对应的ROI图像作为3D CNN-ROIs方法的输入样本。
2.2 3D CNN网络模型
研究表明,CNN通过加深网络结构可提高网络的特征表示能力,使得图像特征信息可以通过多层网络传到末端,从而提高分类效果[17]。但医学图像采集困难,标注成本高,无法满足训练深度学习模型所需的大量标注样本数,因此,在监督学习中,构建基于小数据样本进行分类的网络结构非常重要[18]。
基于文献[11]模型结构以及VGG16结构在保证相同图像感受野的条件下,增加了网络深度,在一定程度上提升了网络效果的启发,本研究构建了图2所示的3D CNN结构。

图2 网络结构Fig.2 The structure of proposed network
整个模型包含三个卷积模块和三个全连接层,所有卷积核大小均相同,不同模块间通过Maxpooling沿空间维度通过下采样feature-map来连接,最后经Softmax层对分类任务进行优化,输出所属类别概率。在保证VGG16结构的同时,减少网络层数,并将滤波数固定,在一定程度上减少了计算量,网络详细参数见表1。

表1 3D CNN模型结构Table 1 The architecture of 3D CNN model
3 实验
3.1 数据集及预处理
使用的sMRI影像数据来自阿尔茨海默病神经影像学倡议(Alzheimer′s disease neuroimaging initiative,ADNI)数据库(www.loni.ucla.edu/adni)。将下载的sMRI影像数据划分为正常对照类(NC)、重度认知障碍类(转化为AD型,MCIc)、轻度认知障碍类(未转化为AD型,MCInc)、阿尔茨海默病类(AD)等四类,共下载了787张T1加权的sMRI影像,包括262张NC影像,237张AD影像,173张MCInc影像和115张MCIc影像。数据在使用时分为两部分,一部分用于本模型训练和测试,记作训练测试集(N=509);另一部分作为验证(N=278),被试的详细信息见表2和表3。

表2 509名被试的信息特征(均值±标准差)Table 2 Information on 509 subjects(mean± std)

表3 278名被试的信息特征(均值±标准差)Table 3 Information on 278 subjects(mean± std)
表2和表3中的3到6列分别代表年龄(Age),简易精神状态检查量表(mini mental state examination,MMSE),临床痴呆评定量表(clinical dementia rating,CDR),全面衰退量表(global deterioration scale,GDS),图像采集协议程序和采集后预处理程序的详细说明,参见http://www.adni-info.org。
由于从ADNI数据库下载的影像均为.nii格式,实验采用MATLAB的CAT12工具包进行图像预处理,包括去头骨,配准到蒙特利尔(Montreal Neurological Institute)标准空间中,图像平滑(平滑核为2×2×2),参数使用CAT12工具包默认参数。随后对sMRI影像进行灰度归一化,预处理总体流程见图3。

图3 横截面预处理流程Fig. 3 Processing process of axial plane
3.2 实验设置
本研究对ADNI数据库中787名被试的T1加权sMRI影像进行了分类测试。图像处理过程见2.1节,处理后的sMRI影像大小为121×145×121,分辨率为1.5 mm×1.5 mm×1.5 mm。
训练时,整个网络的权重默认Xavier[19]初始化的方法。Batch_size为4,,Epoch为50,采用Adam[20]梯度下降方法进行参数的更新,学习率为0.001,Dropout为0.25,并且对参数进行了L2正则化来降低过拟合风险。验证集部分用于调整训练过程的迭代次数,得到性能最优的模型参数权重,以提高模型泛化能力。SVM核函数为高斯核,核函数系数为20,RF的弱学习器的最大迭代次数为20。实验采用了5种分类性能指标进行评价,分别是分类准确率(accuracy,ACC)、召回率(recall,REC)、精确值(precision,PRE)、F1值(F1-score)、ROC曲线下面积(area under curve,AUC),相关的计算公式如下。
(1)
(2)
(3)
(4)
上式中的TP、TN、FP和FN见表4。

表4 二分类混淆矩阵Table 4 Two-class confusion matrix
3.3 实验方案
所有实验均在服务器上运行,服务器共有5个节点,每个节点分别配置2块显存为16 GB,最大功耗为250 W的NVIDIA Tesla P100显卡。本研究实现以下模型的对比。
(1)3D CNN对被试全脑影像用本研究的3DCNN进行训练,分类器为Softmax。
(2)3D CNN+SVM 对被试全脑影像用本研究的3DCNN训练完成后,得到网络全连接F1层的特征,再将其SVM进行训练。
(3)3D CNN+RF 与3D CNN+SVM模型一样,最后将F1层的特征用RF进行训练。
(4)3D CNN+ROIs提取ROI图像后,再用3DCNN进行训练。AD vs NC提取的ROI为海马、海马旁回、杏仁核、内嗅皮质、后扣带回等区域;MCIc vs NC提取的ROI除上述脑区外,还有丘脑、苍白球区域;MCIc vs MCInc提取的ROI为海马、海马旁回、顶下小叶、枕中回、梭状回、颞下回等区域。为显示ROI三维图像,提取出的ROI图像通过BrainNetViewer[21]进行三维可视化,见图4。

图4 脑区:ROI三维图像Fig.4 Brain regions: the 3D image of ROI
3.4 实验结果
3组实验的详细对比结果见图5、图6和表5。

图5 训练时间Fig.5 Train time

表5 实验结果对比Table 5 Comparison of experimental results
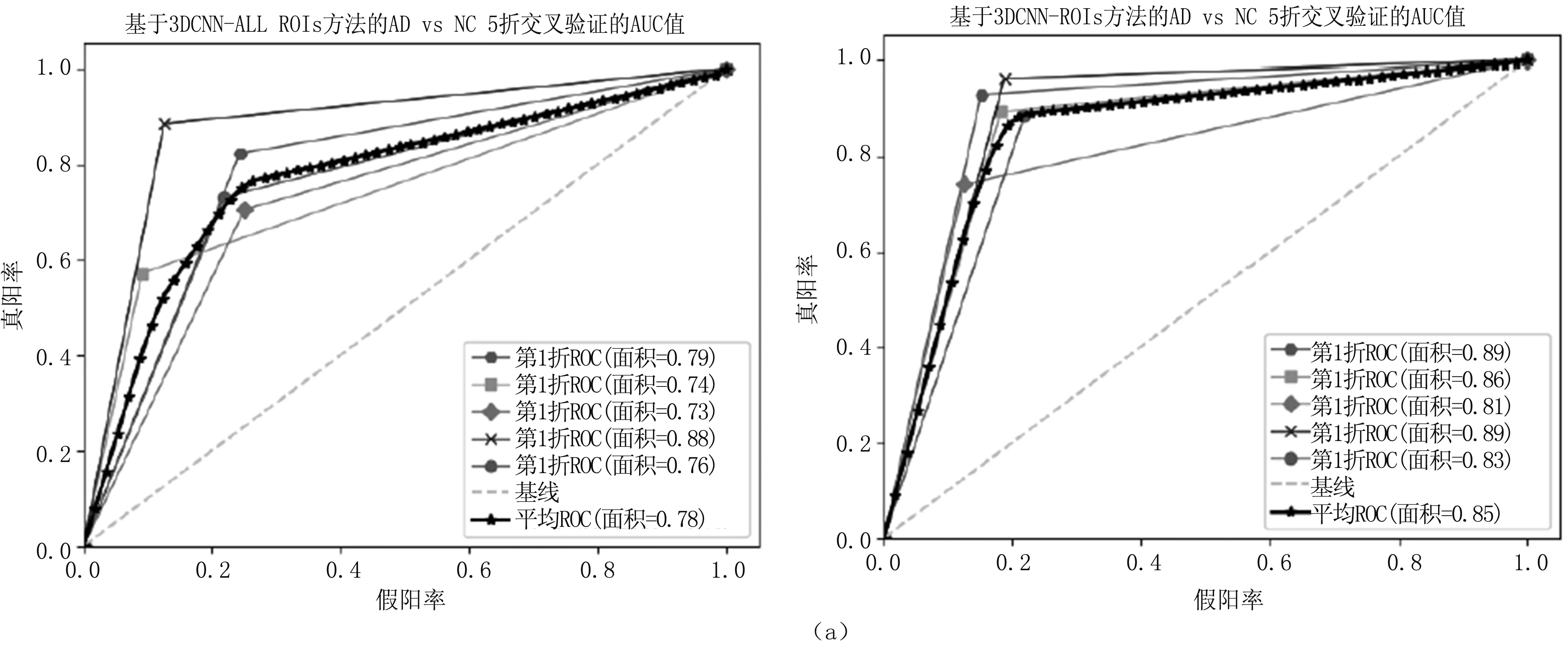

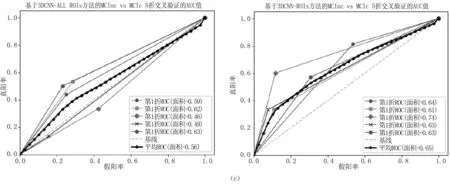
图6 5折交叉验证的AUC值(a).AD vs NC的5折交叉验证的AUC值;(b).MCIc vs NC的5折交叉验证的AUC值;(c).MCInc vs MCIc 的5折交叉验证的AUC值Fig.6 The AUC value for 5-fold cross-validation(a).AUC value for 5-fold cross-validation of AD vs NC;(b).AUC value for 5-fold cross-validation of MCIc vs NC;(c).AUC value for 5-fold cross-validation of MCInc vs MCIc
本研究使用5折分层交叉验证的方法,以减少随机因素的影响。即将训练测试集(见表2)分为5个子集,4个子集作为训练集用于3D CNN模型训练,另一个作为最终的测试集,同时验证集部分用于调整训练过程的迭代次数,将验证集(见表3)的准确率不再提高作为训练的停机条件。重复执行5次实验,每种指标可得5次结果,分别取平均值作为分类的性能指标。实验进行了3组两两分类实验(AD vs NC,MCIc vs NC,MCInc vs MCIc),充分验证了所选ROI对实验结果造成的影响。图5给出了在3D CNN和3D CNN-ROIs方法下训练花费时间,表4给出了所有方法在分类AD vs NC、MCIc vs NC和MCInc vs MCIc的5种指标结果以及对应的标准差。图6给出了这三组对比实验在3D CNN和3D CNN-ROIs方法下的5折交叉验证的AUC值。
4 讨论
本研究提出一种基于ROI的3D CNN网络AD辅助诊断模型。该模型主要基于深度卷积神经网络方法,通过提取ROI图像的有效特征为AD 的辅助诊断提供有效数据信息,从而来提高分类准确率,并通过5个对比实验,来验证选取ROI的有效性。首先,在不提取ROI图像前提下,对3D CNN模型最后输出层使用Softmax、SVM和RF等分类器进行最终分类。从表5可知,在不做ROI提取的前提下,3D CNN训练好的模型全连接层不管接何种分类器,其前2组取得的分类结果均比文献[7]的PCA+SVM方法好,但略低于文献[9]的切片集成方法。同时可以看出Softmax、SVM和RF等分类器的结果很接近,说明提高分类准确率不在于分类器的选择,而在于特征的选择。最后,本研究3D CNN-ROIs方法与文献[9]相比,AD vs NC的ACC为85.2%,F1-score为85.1%;MCIc vs NC的ACC为83.9%,F1-score为80.4%;MCInc vs MCIc的ACC为68.5%,AUC为65.1%,F1-score为64.2%。实验结果明显高于其他5种方法,证明了所选ROI的有效性,以及有时特征的选择比分类器的选择更重要。从侧面表明海马、海马旁回、顶下小叶、枕中回、梭状回、颞下回等区域可能对MCInc 和MCIc的区分有重要帮助。由图6可知,方法训练收敛时间具有优势。事实上,通过先验知识选定特定ROI图像,一方面可以排除其他无明显差异脑区的影响;另一方面减少了模型训练的计算量,并且可以验证所选的脑区对AD分类预测是否有效果,从而判断该脑区是否为与AD疾病有关的生物标志物。
5 结论
处于不同阶段的MCI患者大脑局部呈现出不同程度的萎缩,但具体萎缩区域不明确,导致很多计算机辅助诊断方法准确率偏低,尤其是MCInc vs MCIc的分类结果,这对于AD的辅助诊断非常有意义。本研究提出的基于ROI的3D CNN的AD辅助诊断模型,首先从大脑sMRI中提取出ROI图像,然后用3D CNN模型提取ROI图像特征并进行自动分类诊断。实验结果表明,在sMRI数据与文献[7,9]完全一样的情况下,在3D CNN-ROIs方法中,经ROI提取后,运算量变小,收敛时间变短,并且AD vs NC的平均ACC为85.2%;MCIc vs NC的平均ACC为83.9%;MCInc vs MCIc的平均ACC为68.5%,三组实验结果明显高于文献[7,9]。一方面说明所选取ROI的有效性,另一方面也说明有时特征的选择比分类器的选择更重要。在后续研究中,如何探索自动选取有效ROI而不依赖先验知识的方法将成为下一步的工作。

