动态高压微射流辅助提取对鱼鳞多糖抗氧化活性的影响
*3崔震昆王淼焱李红波23胡梁斌23
(1.河南科技学院食品学院,河南新乡 453003;2.新乡市水产品加工及安全风险控制重点实验室,河南新乡 453003;3.陕西科技大学食品与生物工程学院,陕西西安 710021)
鲤鱼被认为是健康的食品,每l00 g鲤鱼肉中含蛋白质17.6 g、脂肪4.1 g、磷204 mg、钙50 mg及多种维生素;而且鲤鱼中的脂肪多为不饱和脂肪酸,具有降低人体胆固醇,防治动脉硬化、冠心病等功能[1-3]。我国是最大的鲤鱼养殖国,年产量302万吨,占世界总产量的80%。鲤鱼加工过程中会产生约30%的副产物,其中鱼鳞占了约5%,鱼鳞通常被作为废弃物处理,处理不当会对环境造成污染[4-5]。鱼鳞中含有丰富的蛋白质、维生素、多糖和不饱和脂肪酸等,其中多糖的含量达到9.5%[6-8]。目前淡水鱼磷多糖提取主要是采用碱浸提法提取[8-9],而碱法提取的废液也会污染环境。
动态高压微射流是一种新兴的超微均质技术,通过高速撞击、高频振荡、瞬时高压和强力剪切等作用使物料破碎,起到较好的超细化和均质的作用,同时不会对活性组分造成破坏[10-11]。目前动态高压微射流技术已广泛应用于灭菌[12-13]、蛋白质改性[14]、多糖改性[15]及天然活性成分的提取,由于其具有降低物料粒度和增加溶剂穿透力等优点,可有效提高香菇多糖[16-17]和甘薯叶多酚[11]等的提取率。动态高压微射流技术应用于鱼鳞多糖的提取目前未见报道。将动态高压微射流辅助提取技术应用于淡水鱼鱼鳞多糖的提取有望提高多糖的提取率同时降低提取过程对环境的污染。
本研究以鲤鱼鱼鳞为原料,研究不同压力条件下动态高压微射流辅助提取对鲤鱼鱼鳞多糖的得率、抗氧化活性以及颗粒粒径等的影响,为动态高压微射流技术在天然活性多糖提取方面的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
鲜活鲤鱼(重约800 g) 新乡市某超市,鱼鳞采集后于4 ℃冰箱保存备用;硫酸亚铁、邻苯三酚 天津科密欧试剂有限公司;水杨酸、铁氰化钾、过硫酸钾 国药集团化学试剂有限公司;DPPH(1,1-diphenyl-2-picrylhydrazyl) 上海阿拉丁试剂有限公司;Tris、ABTS(2,2-azino-bis 3-ethyl-benzthiazoline-6-sulphonic acid) 北京索莱宝科技有限公司;其他试剂 均为国产分析纯。
TOMY-SX-700全自动高压灭菌锅 日本Tomy公司;Centrifuge 5804R冷冻高速离心机 德国Eppendorf公司;HH-42水浴锅 常州国华电器有限公司;Sartious AY-120电子精密天平 北京赛多利斯天平有限公司;高压纳米均质仪SPCH-10 英国Stansted Fluid Power公司;pH计Orion 3 STAR 美国Thermo公司;BT-9300H激光粒度分布仪 丹东佰特仪器有限公司;TU-1810型紫外分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 鲤鱼鱼鳞多糖的提取 参考熊双丽等[9]和张露等[11]的方法进行。取新鲜的鲤鱼鱼鳞洗净脱钙后烘干粉碎,分别取6 g鱼鳞粉末与200 mL蒸馏水混匀,应用动态高压纳米均质仪在50、70、90、110、130和150 MPa条件下处理3 次,每个样品经动态高压微射流处理后只收集中间的100 mL样品。对照为未经动态高压微射流处理的鱼鳞粉末样品。分别取30 mL处理后的样品,5000 r/min离心10 min收集沉淀用于粒径测定,剩余70 mL置于80 ℃水浴浸提3 h后离心,收集上清液用于抗氧化活性测定。
1.2.2 多糖得率测定 参考安晓萍等[18]的苯酚硫酸法进行测定。分别吸取0.1、0.2、0.4、0.8、1.2、1.6、2.0 mL的葡萄糖标准溶液于10 mL具塞试管内,加蒸馏水至2.0 mL(配成了5~100 μg/mL的标准溶液),另取1支具塞试管加入2.0 mL蒸馏水作为对照。每只试管分别加入浓度为6 mg/mL的苯酚溶液1.0 mL、浓H2SO45.0 mL,混匀后放置10 min,再次震荡均匀放置20 min,在490 nm处测定吸光度。以葡萄糖质量(X)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线并求得标准曲线方程(Y=0.4239X-0.0214,R2=0.9986)。分别取经动态高压微射流处理后提取的样品液2 mL,按照上述方法测定吸光度,通过标准曲线方程算得样品液中多糖含量。
多糖得率(%)=提取液中多糖质量/原料质量×100
1.2.3 DPPH·清除能力的测定 参考Daou等[19]的方法,并略作修改。分别取2 mL 0.16 mmol/L DPPH溶液加入到2 mL不同处理组样品溶液中,25 ℃水浴30 min,于517 nm处测定样液吸光度(Ai)。以2 mL蒸馏水代替上述体系中2 mL样品测定空白吸光度(A0)。以2 mL蒸馏水代替上述体系中2 mL DPPH测定本底吸光度(Aj)。Ai和Aj每个样品做三个平行试验,A0做三个平行。按照如下公式计算清除率并求平均值。
清除率(%)=[A0-(Ai-Aj)]/A0×100

清除率(%)=(A0-Ai)/A0×100
1.2.5 ABTS+·清除能力的测定 参考黄越等[22]的方法,略作改进。将100 mL 7 mmol/L ABTS溶液与100 mL 2.45 mmol/L过硫酸钾溶液混合后室温避光静置15 h获得ABTS+·储备液。用磷酸盐缓冲液(10 mmol/L、pH7.4)将ABTS+·储备液稀释至734 nm波长处吸光度为0.70±0.02,获得ABTS+·测定液。分别取2.0 mL ABTS+·测定液加入到不同处理组的2 mL样品溶液中,室温避光反应6 min,测定其在734 nm波长处的吸光度(Ai),然后将体系中的样品用2 mL蒸馏水替代,测定其在734 nm波长处的吸光度(A0),以2 mL磷酸盐缓冲液代替上述体系中2 mL的ABTS+·测定液测得本底吸光度(Aj)。Ai和Aj每个样品做3个平行,A0做三个平行。计算平均清除率。
清除率(%)=[A0-(Ai-Aj)]/A0×100
1.2.6 ·OH清除能力的测定 参考Sun等[21]的方法,略作改进。分别在10 mL比色管中加入6 mmol/L的FeSO4溶液2.0 mL、6 mmol/L的水杨酸溶液2.0 mL、6 mmol/L的H2O2溶液2.0 mL和不同处理的样品溶液2 mL混匀,37 ℃水浴30 min,测定其在510 nm处的吸光度(Ai),将体系中的样品用2 mL蒸馏水替代,测定其在510 nm处的吸光度(A0),同时以2 mL蒸馏水代替上述体系中2 mL的H2O2测得本底吸光度(Aj)。Ai和Aj每个样品做3个平行,A0做三个平行。计算平均清除率。
可见第二个问题,经过学生自己的观察与思考后,不难发现这些经一条线段分开得到的两个图形,形状和大小完全一样,于是水到渠成地得到了结论:完全相等的两个图形,它们的周长也相等。
清除率(%)=[A0-(Ai-Aj)]/A0×100
1.2.7 Fe3+还原力的测定 参考沈小璐等[23]的方法,略作改进。分别取2 mL 0.2 mol/L磷酸盐缓冲液(pH6.6)和2 mL 1%的铁氰化钾溶液加入到不同处理组的2 mL样品溶液中,50 ℃水浴20 min,加入2 mL 10%的三氯乙酸溶液,混合均匀,3000 r/min离心10 min,取上清液2 mL,加入2 mL蒸馏水以及0.4 mL 0.1% 三氯化铁溶液,室温反应10 min,测定其在700 nm处的吸光值。每个样品做三个平行。
1.2.8 粒度的测定 分别称取1.0 g 1.2.1中离心后得到的动态高压微射流不同压力处理的鱼鳞粉末残渣,用蒸馏水配成1.0 mg/mL的溶液后,采用激光粒度分布仪测定不同处理组鱼鳞粉末颗粒平均粒度和粒径分布。
1.3 数据处理
所有试验重复3次,试验数据处理采用SPSS 20.0软件进行分析,试验结果以平均值±标准差表示,显著性分析采用Duncan检验,P<0.05被认为具有显著性差异。
2 结果与分析
2.1 动态高压微射流辅助提取对总多糖得率的影响
动态高压微射流辅助提取对鲤鱼鱼鳞总多糖提取率的影响见图1。由图1可知,动态高压微射流辅助提取可显著(P<0.05)提高总多糖的得率。随着处理压力的升高,多糖得率逐渐升高,当处理压力为130 MPa时,多糖得率达到7.81%。当压力继续升高至150 MPa时,多糖得率与130 MPa时无显著性差异(P>0.05),本实验结果与姜颖等[16]的研究结果类似,可能是动态高压微射流处理中,物料因受到高速撞击、强烈剪切和瞬时压力释放等作用,颗粒变得更小,增加了其与溶剂接触的表面积,从而加快细胞内物质向溶剂中溶出的速度[17],进而提高多糖得率。当压力过高时,气穴和高频振荡的作用也增强,导致部分多糖类化合物氧化降解,多糖得率没有进一步提高[16]。

图1 动态超高压微射流辅助提取对鲤鱼鱼鳞多糖得率的影响Fig.1 Effect of dynamic high pressure microfluidization on extraction yield of carp scales polysaccharide注:不同小写字母代表数据差异显著(P<0.05);图2~图5同。
2.2 动态高压微射流辅助提取对DPPH·清除能力的影响
动态高压微射流辅助提取对鲤鱼鱼鳞多糖清除DPPH·能力的影响见图2。DPPH·是一种稳定的自由基,抗氧化剂可与DPPH·上的孤对电子配对,使其在517 nm附近的光吸收减弱或消失,因此可以通过光吸收减弱程度来判断抗氧化剂的抗氧化能力[27]。由图2可知,与对照组的DPPH·清除率61.77%相比,随着处理压力的升高,鲤鱼鱼鳞多糖的DPPH·清除能力也呈现递增的趋势,当处理压力为110 MPa时,清除率达到最高,为86.04%,且各处理组均显著高于空白对照组(P<0.05)。结果表明动态高压微射流辅助提取可以有效提高鲤鱼鱼鳞多糖清除DPPH·自由基的能力。这与前人报道的荷叶多糖和油莎草叶总黄酮抗氧化结果一致,动态高压微射流辅助提取可以显著提高荷叶多糖[25]和油莎草叶总黄酮[26]的DPPH·清除能力。因为动态高压微射流处理后,提高了多糖的提取率,而多糖可作为一种供氢物质与自由基形成稳定的物质,从而阻止了DPPH·的链式反应[27]。同时寇玉等研究报道荷叶多糖经动态高压微射流处理后提取的多糖分子量更小,并确定分子量较小的多糖具有更高的抗氧化活性[25]。因此,推测随着处理压力的增加,动态高压微射流提取的鱼鳞多糖分子量更小,使鲤鱼鱼鳞多糖的抗氧化性提高。

图2 动态高压微射流辅助提取对鲤鱼鱼鳞多糖DPPH·清除能力的影响Fig.2 Effect of dynamic high pressure microfluidization on DPPH· scavenging ability of carp scales polysaccharide
2.3 动态高压微射流辅助提取对清除能力的影响
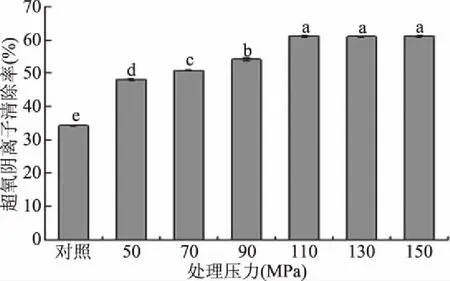
图3 动态超高压微射流辅助提取对鲤鱼鱼鳞多糖清除能力的影响Fig.3 Effect of dynamic high pressure microfluidization on scavenging ability of carp scales polysaccharide
2.4 动态高压微射流辅助提取对ABTS+·清除能力的影响
动态高压微射流辅助提取对鲤鱼鱼鳞多糖ABTS+·清除能力影响见图4。由图4可知,与对照组ABTS+·清除率45.86%相比,随着处理压力的升高,鲤鱼鱼鳞多糖的ABTS+·清除能力呈现递增的趋势,当处理压力为150 MPa时,清除率达到最高,为89.58%,且各处理组均显著高于空白对照组(P<0.05)。结果表明动态高压微射流预处理可以有效提高鲤鱼鱼鳞多糖ABTS+·清除能力。天然活性组分的抗氧化能力与活性成分的浓度呈正相关性[28],本实验的研究结果与涂宗财等[30]的研究结果相一致,随着动态高压微射流处理压力的增高,可以显著提高红薯叶黄酮的抗氧化性,由于处理压力升高导致总酚浓度提高,最终提高其抗氧化活性。

图4 动态超高压微射流辅助提取对鲤鱼鱼鳞多糖ABTS+·清除能力的影响Fig.4 Effect of dynamic high pressure microfluidization on ABTS+· scavenging activity of carp scales polysaccharide
2.5 动态高压微射流辅助提取对·OH清除能力的影响
动态高压微射流辅助提取对鲤鱼鱼鳞多糖清除·OH能力的影响见图5。·OH是一种重要的活性氧,具有较强的氧化能力,在生物体内可与细胞中的多种分子发生反应,从而损伤细胞[31]。由图5可知,与对照组的·OH清除率73.31%相比,随着处理压力的升高,鲤鱼鱼鳞多糖的·OH清除能力也逐渐升高,当处理压力为110 MPa时,清除率达到最高,为90.59%,且各处理组均显著高于空白对照组(P<0.05)。130、150 MPa处理·OH清除率反而有所下降,可能是由于压力过高,气穴和高频振荡的作用增强,导致的氧化作用引起的。结果表明动态高压微射流预处理可以有效提高鲤鱼鱼鳞多糖清除·OH的能力。本实验结果与Huang等[32]的研究一致,动态微射流辅助提取有效提高了仙草多糖清除·OH能力。王艳敏[33]也报道了动态微射流辅助提取可以完全将玉米花粉裂解成碎片,促进多糖的溶出,最终提高玉米花粉粗多糖的抗氧化性。同时由于活性多糖分子具有还原性的半缩醛基,因此鲤鱼鱼鳞多糖可以是一种良好的供氢体,提供给·OH后将其还原为OH-,从而使·OH自由基被清除[20]。

图5 动态超高压微射流辅助提取对鲤鱼鱼鳞·OH清除能力的影响Fig.5 Effect of dynamic high pressure microfluidization on ·OH scavenging activity of carp scales polysaccharide
2.6 动态高压微射流辅助提取对Fe3+还原能力的影响
动态高压微射流辅助提取对鲤鱼鱼鳞多糖还原Fe3+能力的影响见图6。若样品能将Fe3+还原成Fe2+,证明样品中含有多余电子,样品中供给电子能力越强,抗氧化性越强[34]。由图6可知,随着处理压力的升高,鲤鱼鱼鳞多糖对Fe3+的还原能力也不断提高,当压力大于110 MPa后,Fe3+的还原能力变化差异不显著,且各处理组均显著高于空白对照组(P<0.05)。空白对照组吸光度仅为0.25,而经动态高压微射流处理的样品其吸光度最高达到0.64,吸光度越高,说明有更多的Fe2+生成。鱼鳞多糖是一种良好的电子供体,所提供的电子可以使Fe3+还原为Fe2+。

图6 动态超高压微射流辅助提取对鲤鱼鱼鳞多糖Fe3+还原能力的影响Fig.6 Effect of dynamic high pressure microfluidization on Fe3+ reducing power of carp scales polysaccharide
曹东旭等[8]研究了鲤鱼鱼鳞多糖的抗氧化活性,随着浓度的增大,其吸光度达到0.5,说明浓度越高,还原能力越强。本实验中随着处理压力的升高,样品溶液中鲤鱼鱼鳞多糖的浓度也逐渐增加,所以可有效提高鲤鱼鱼鳞多糖对Fe3+还原能力。
2.7 动态高压微射流辅助提取对物料粒度和粒径分布的影响
动态高压微射流辅助提取对鲤鱼鱼鳞粉末的平均粒度和粒径分布的影响见表1。由表1可知,随着处理压力的增加,鲤鱼鱼鳞粉末的平均粒度逐渐下降,当处理压力达到150 MPa时,粒径达到最小,平均粒度由未经处理的499.80 nm降低到192.57 nm,说明动态高压微射流处理,可显著(P<0.05)降低鲤鱼鱼鳞粉末的粒径。由图7可知,经过动态高压微射流处理后,鲤鱼鱼鳞粉末分布集中在粒径较小的范围内。未经处理的鲤鱼鱼鳞粉末粒径主要集中在300~1000 nm之间,而经动态高压微射流处理后粒径主要分布在100~500 nm之间。与其他处理组相比,130和150 MPa处理组在500~1000 nm的粒径分布比例较高,可能是在静电吸附和范德华力等的作用下,鲤鱼鱼鳞粉末颗粒重新聚集,导致部分颗粒的粒径增加。这与前人报道的大豆膳食纤维[35]、鱼骨颗粒[36]的报道结果相一致。

表1 动态高压微射流辅助提取对鲤鱼鱼鳞粉末平均粒度的影响Table 1 Effect of dynamic high pressure microfluidization on average particle size of carp scales powder

图7 动态高压微射流辅助提取对鲤鱼鱼鳞粉末粒径分布的影响Fig.7 Effect of dynamic high pressure microfluidization on particle size distribution of carp scales powder
3 结论


