一株产γ-氨基丁酸屎肠球菌的筛选和发酵条件优化及其益生特性分析
,*
(1.西华大学食品与生物工程学院,四川省食品生物技术重点实验室,四川成都 610039;2.西华大学古法发酵(酿造)生物技术研究所,四川成都 610039;3.四川国检检测有限责任公司,四川泸州 646000;4.中国科学院成都生物研究所,四川成都 610041)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是广泛存在于植物、动物和微生物中的一种非蛋白质氨基酸[1]。在哺乳动物中枢神经系统中,GABA是一种重要的抑制性递质,具有精神安定、降血压、抗焦虑等功效[2]。因此,GABA被广泛应用于食品、医药及保健品等行业[3]。目前,合成GABA的方法主要有化学合成法、植物富集法和微生物发酵合成法,相比而言,微生物发酵合成法具有周期短、安全性好、耗能低等优点,所以微生物发酵合成法成为了当前研究的热点[4]。然而,优良菌株的缺乏制约了微生物发酵合成GABA的进一步发展,因此获取优良菌株成为了采用微生物发酵法合成GABA的首要任务。
传统发酵制品中功能性微生物的筛选一直是关注的重点,其中泡菜是以乳酸菌为主要发酵微生物的传统发酵蔬菜,口感清爽、味道鲜美、质地脆嫩、营养丰富,深受消费者喜爱[5],也是获得功能性微生物的重要来源。曾林等[6]对四川泡菜中产GABA乳酸菌进行筛选,得到12株乳杆菌属菌株;刘文丽等[7]从泡菜中筛选出1株产GABA短乳杆菌PD1-2。但报道乳酸菌多为短乳杆菌、鼠李糖乳杆菌和植物乳杆菌等,而对于产GABA屎肠球菌及提高其产量的研究鲜有报道[8-9]。目前,提高GABA产量的方法主要有理化诱变处理、重组基因构建、生物催化合成等[10],其中通过优化培养条件进一步提高GABA合成量一直是研究热点。Song等[11]对发酵红小豆奶中产GABA培养基进行优化,产量为1.12 g/L;Tung等[12]通过响应面优化设计对植物乳杆菌进行分析,优化培养条件后GABA产量为0.629 g/L。不同种类或不同来源的微生物对GABA的合成条件存在差异性,因此有必要对微生物合成GABA的影响因素进行分析和研究,从而寻求一种提高GABA微生物合成量的途径。
本研究以四川泡菜为分离源,筛选鉴定产GABA的屎肠球菌;利用响应面分析法对屎肠球菌生物合成GABA参数进行优化,以确定该菌株的最佳发酵合成GABA的条件。同时对其益生特性进行分析。本研究旨在为产GABA的功能性菌株开发应用以及产GABA发酵条件优化等相关研究提供科学依据。
1 材料与方法
1.1 材料与仪器
泡菜液 成都郫都区红光农贸市场,样品采集后立即进行微生物分离纯化;大肠杆菌JM109感受态细胞 美国Promega公司;丹磺酰氯(DNS-Cl,含量≥98%) 成都华夏化学试剂有限公司;γ-氨基丁酸(GABA,含量≥99%) 上海金穗生物科技有限公司;L-谷氨酸钠(L-MSG,含量≥98.5%)、茚三酮、胆固醇、猪胆盐等其他试剂为分析纯级试剂 成都市科龙化工试剂厂。
720BR电泳凝胶成像分析仪 BIO-RAD(美国);T-1 Thermoblock PCR自动扩增仪 Biometra Tgradient(美国);994超低温冰箱 Thermo Fisher Scientific(美国);DYY-8C电泳仪 北京六一生物科技有限公司(中国);Waters2695高效液相色谱仪 Waters(美国);岛津-GL INERTSIL ODS-3(4.6 mm×150 mm,5 μm)色谱柱 岛津公司(日本);WFJ-7200酶标仪 上海闪谱生物科技有限公司(中国)。
1.2 实验方法
1.2.1 培养基的配制 MRS液体培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母粉5 g,乙酸钠5 g,磷酸二氢钾2 g,柠檬酸铵2 g,吐温80 1 mL,硫酸镁0.5 g,硫酸锰0.25 g,蒸馏水1 L,pH6.2,121 ℃灭菌15 min,备用。在上述培养基中添加2%(w/V)琼脂制成MRS固体培养基。
改良MRS培养基:含有0.5% L-谷氨酸钠的MRS液体培养基。
MRS-Oxgall-CHOL 液体培养基:MRS液体培养基中加入已过滤除菌的水溶性胆固醇(100 μg/mL)。
1.2.2 微生物的分离纯化 取泡菜样液25 mL,加入225 mL无菌生理盐水(0.85%)混匀制成菌悬液。菌液10倍梯度稀释后取适宜浓度涂布于MRS固体培养基,37 ℃倒置培养12 h。挑取单菌落划线纯化3次后加入甘油于-50 ℃冰箱保种,备用。
1.2.3 菌株生化特征分析和系统发育树的构建 参考《乳酸细菌分类鉴定及实验方法》[15]、《伯杰氏细菌手册》中的实验方法进行生化测试分析乳酸菌的种属特性,鉴定到种或亚种。分别对目标菌株进行革兰氏染色、不同温度和pH条件下的生长耐受、耐盐性、糖发酵和抗生素敏感性实验等生理生化分析。同时对菌株DNA进行提取,采用16S rRNA克隆和测序鉴定,所得结果于GenBank数据库进行比对,并用MEGA5.0软件中的Neighbor-Joining法进行1000次步长计算构建发育树。
1.2.4 GABA表达能力评估 采用高效液相色谱法(HPLC)定量检测GABA含量[13]。参考Komatsuzaki等[14]方法,对发酵液进行衍生化。HPLC分析条件:柱温30 ℃;紫外检测波长为254 nm;进样量10 μL;流动相A为甲醇,流动相B为醋酸钠(pH6.2)-甲醇-四氢呋喃(84∶25∶1,V/V/V);流速1 mL/min;洗脱方式:线性梯度洗脱,流动相A比例为:0~6 min,20%~50%;6~9 min,50%~80%;9~10 min,80%~100%;10~11 min,100%;11~15 min,20%。
1.2.5 乳酸菌发酵产GABA的单因素实验 反应体系为改良MRS培养基、接种量2%的前提条件下,在发酵温度34 ℃、初始pH6.5条件下静置培养72 h,考察不同底物浓度(2、3、4、5、6 g/L)对GABA产量和生长情况(OD600)的影响。在底物浓度5 g/L、初始pH6.5条件下静置培养72 h,考察不同发酵温度(30、32、34、36、38 ℃)对GABA产量和生长情况(OD600)的影响。在底物浓度5 g/L、发酵温度34 ℃条件下静置培养72 h,考察不同初始pH(4.5、5.0、5.5、6.0、6.5、7.0)对GABA产量和生长情况(OD600)的影响。在底物浓度5 g/L、发酵温度34 ℃、初始pH6.5条件下,考察不同发酵时间(24、36、48、60、72、84 h)对GABA产量和生长情况(OD600)的影响。
1.2.6 响应面优化试验设计 根据单因素实验结果,选取相应的响应面设计中心点,以GABA产量为评价指标,利用Design-Expert 8.0软件设计4因素3水平Box-Behnken响应面试验。对实验数据进行回归分析,确定菌株产GABA的最佳条件,因素水平见表1。

表1 Box-Behnken试验因素水平表Table 1 Factors and levels of Box-Behnken experiment
1.2.7 益生特性分析
1.2.7.1 耐酸分析 将菌株37 ℃培养直至菌体浓度达到1×108CFU/mL,以2%的接种量分别接入pH2.0、2.5、3.0、3.5的MRS液体培养基中,30 ℃静止培养12 h后,按照现行有效的国家标准(GB 4789.2-2016)[16]活菌计数,计算存活率。
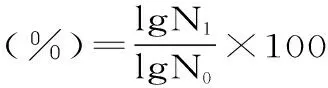
式中:N1为经过耐酸性处理后存活的活菌菌落数;N0为pH6.86空白MRS液态培养基处理的活菌菌落数。
1.2.7.2 耐胆盐分析 取菌体浓度达到1×108CFU/mL的菌株按接种量2%分别接种到含0(即空白对照)、1.0、1.5、2.0、2.5和3.0 g/L胆盐的MRS液体培养基中,30 ℃静置培养12 h后菌落计数[17]。
1.2.7.3 降胆固醇能力分析 分别配置2、5、10、12、15、20 μg/mL胆固醇酒精溶液与MRS液体培养基的混合物,参照Maryam等[18]的邻苯二甲醛法测定上清液中胆固醇含量,绘制胆固醇含量标准曲线为 Y=0.0152X+0.1063(R2为0.9977),可用于降胆固醇能力评价。按2%(V/V)接种量将菌株接种入10 mL灭菌MRS-Oxgall-CHOL培养基(液体)中,30 ℃培养12 h,同时以未接种菌株培养基的吸光值为对照,根据标准曲线换算出菌株胆固醇清除量。
1.3 数据处理
实验数据采用IBM SPSS statistics 20统计软件进行单因素方差分析(ANOVA)和多重比较(LSD:最小显著差数法),柱状图Origin 8.0进行绘制。每组实验三个平行,所有结果用平均值±标准差表示。
2 结果与分析
2.1 菌株的筛选鉴定
从四川泡菜中共筛选得到7株产GABA菌株,其产量范围在0.21~1.08 g/L,其中菌株AB157 GABA产量最高(1.08 g/L),选作后续研究菌株。将菌株AB157接种于MRS固体培养基中,菌落边缘整齐、乳白色、有光泽,革兰氏染色阳性(图1);根据生理生化特征(表2),初步认为菌株AB157属于肠球菌属。结合系统发育树结果表明(图2),该菌株基因序列与基因库中屎肠球菌(Enterococcusfaecium)的相似性为99%。根据种分类定义,该分类单位的16S rRNA序列同源性大于97%[19],并结合形态学、生理生化实验结果,确定该菌株为屎肠球菌。

表2 生理生化实验结果Table 2 Results of physiological and biochemical test
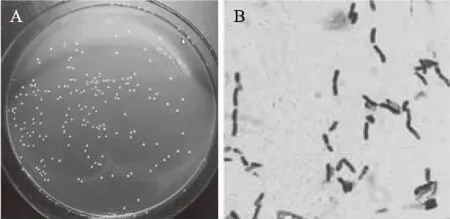
图1 菌株AB157的菌体形态Fig.1 Mycelial morphology of strain AB157A:菌落形态;B:显微形态(100×)。

图2 基于菌株AB157 16S rRNA基因序列构建的系统发育树Fig.2 Phylogenetic tree of strain AB157 based on 16S rRNA gene sequences
2.2 单因素对屎肠球菌AB157生长及GABA产量的影响
微生物发酵过程中会产生谷氨酸脱羧酶(Glutamate decarboxylase,GAD),该酶催化谷氨酸脱羧为GABA,考虑成本和稳定性,通常选用L-谷氨酸钠作为发酵底物。屎肠球菌AB157发酵体系中选取了不同质量浓度的谷氨酸钠(图3A),L-MSG添加量为5 g/L时,生成的GABA浓度达到最大,为1.24 g/L,底物浓度继续增大其GABA生成率降低。Komatsuzaki等[20]研究表明,适当的提高前体物质L-MSG,在一定程度上有利于转向产物GABA的生成,但是当底物浓度大于500 mmol/L时,继续增加谷氨酸钠的浓度GABA的生成反而降低,同时,菌体浓度也随之减小。可能由于过高的底物增加了细胞的渗透压,影响了菌体的生长,从而导致代谢减弱。
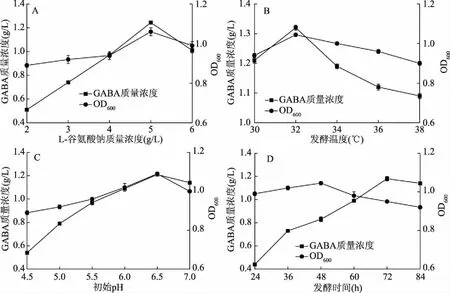
图3 L-谷氨酸钠浓度、发酵温度、初始pH和发酵时间对菌株AB157生长及GABA产量的影响Fig.3 Effects of L-glutamic acid concentration,temperature,initial pH and fermentation time on the growth of E. faecium AB157 and the yield of GABA
发酵温度对屎肠球菌AB157的生长及GABA产量的影响见图3B。结果表明,随着温度的升高,GABA浓度呈现先增加后下降的趋势,在32 ℃达到最大值为1.32 g/L,菌体浓度趋势与之一致,因此选取32 ℃为最适温度。温度主要影响微生物体内酶的催化作用,不同的酶具有不同最适温度,高温或者低温都会影响酶的活力,从而影响菌体的生长。
培养基的pH是微生物发酵过程中一个重要的参数,通过影响电荷,从而影响了酶活力,进一步影响菌体的生长以及代谢的积累。Zhao等[21]研究表明在GABA的合成阶段,需要大量的消耗H+,从而导致pH有所上升,但是当发酵过程中pH超过7.0时,GABA的合成会终止。此外,也有报道通过控制发酵过程的pH在4.0~6.0之间[22-23],提高GABA的质量浓度。不同pH对GABA合成的影响结果见图3C。结果表明当pH为6.5时更有助于GABA的生成,其含量为1.19 g/L。郑鸿雁等[22]选用假丝酵母菌初始pH为4.5合成GABA量最高;李理等[23]探索植物乳杆菌在初始pH为4.65时产GABA能力最强;而Yang等[24]筛选的鸟肠球菌起始pH为6.5时生成的GABA含量最大。因此不同菌株之间起始pH对产GABA的含量影响不同。
微生物生长过程中产生初级代谢产物和次级代谢产物,GABA的合成与菌体的生命活动无明确功能,因此GABA被认为是一种次级代谢产物[25]。发酵时间与GABA合成关系见图3D,随着时间的延长GABA呈现上升趋势,菌体浓度先增加后降低。在发酵前期菌体用于生长繁殖,在48~72 h时GABA大量积累,而72 h后产量增加缓慢,这可能是由于营养物缺乏导致细胞衰亡,从而使GABA合成减缓。因此,选取72 h作为最优发酵时间。
2.3 Box-Behnken响应面试验结果
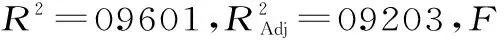
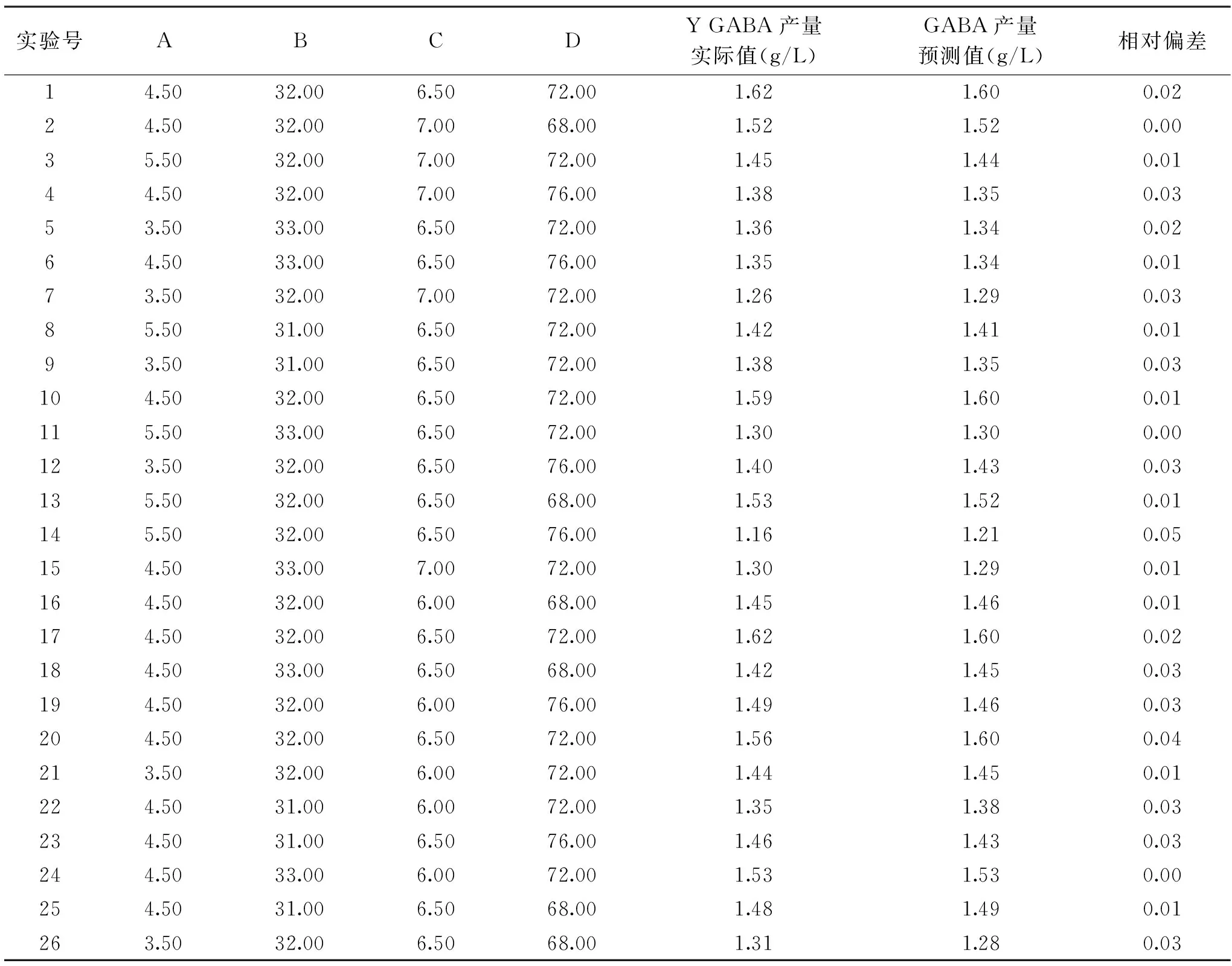
表3 响应面试验设计方案与响应值Table 3 Treatment incorporations and responses of response surface methodology
由回归方程所做的响应面立体图和相应等高线图如图4所示,其在交互项中,L-谷氨酸钠质量浓度与pH(AC)、L-谷氨酸钠质量浓度与发酵时间(AD)、发酵温度与pH(BC)对GABA产量的影响极显著(P<0.01),初始pH与发酵时间(CD)对GABA产量的影响显著,其他因素之间交互影响不显著。
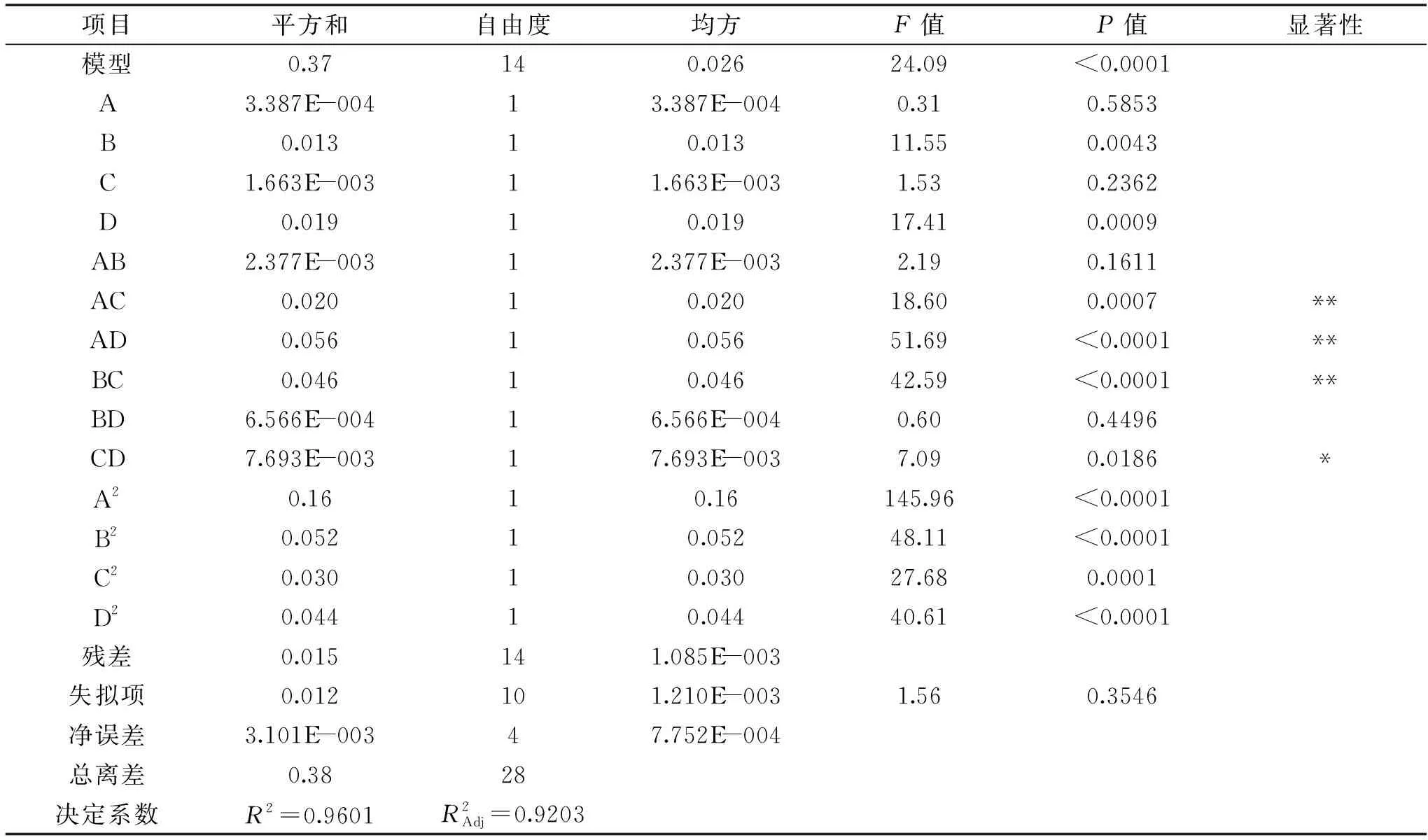
表4 响应面设计的回归方程系数显著性检验及方差分析Table 4 Analysis of statistical significance of each regression coefficient and variance for the experimental results of RSM design
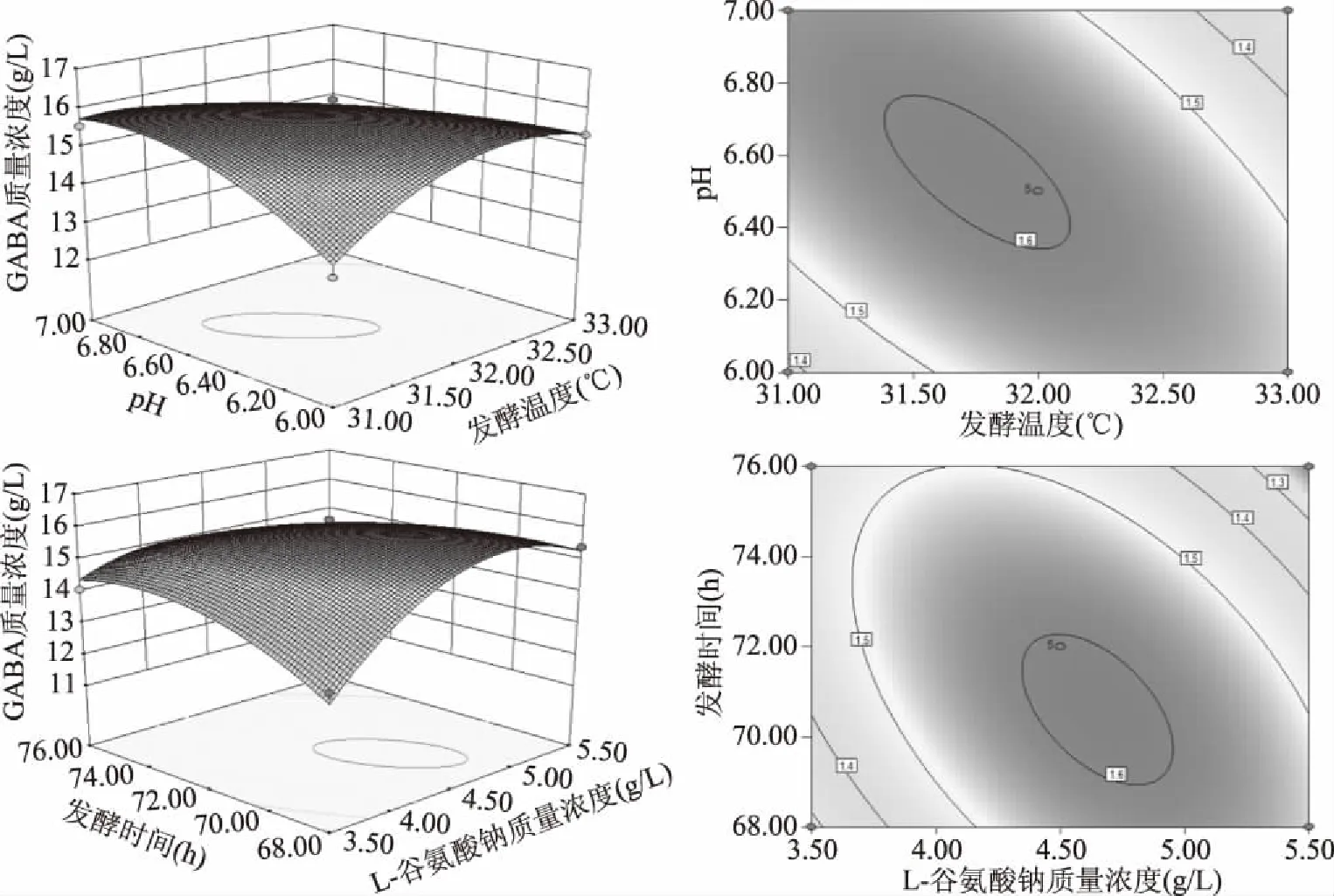
图4 各因素交互作用对GABA质量浓度的响应面及等高线Fig.4 Response surface and contour plots for the interactive effects of three factors on the concentration of GABA
2.4 响应面模型的验证和优化
根据上述优化结果,在对应变量最佳值为L-谷氨酸钠质量浓度5.15 g/L、发酵温度31.2 ℃、pH7和发酵时间68.34 h,得到最大GABA产量预测值为1.64 g/L时,进一步对模型预测值进行验证,并根据实际情况进行变量的选择,设置L-谷氨酸钠质量浓度为5.2 g/L、发酵温度31 ℃、初始pH为7、发酵时间70 h,此时GABA产量为1.60 g/L,与预测值拟合度达97.56%,表明优化模型合理可靠。此外,屎肠球菌AB157产GABA能力优于Lu等[26]报道从中国泡菜中筛选的短乳杆菌(1005.81 mmol/L)、Somkuti等[27]报道从酸奶中获得的嗜热链球菌(0.0067 g/L)和Park等[28]从韩国泡菜中获得的短乳杆菌(8 mmol/L)产GABA能力。
2.5 屎肠球菌AB157的益生特性分析
屎肠球菌AB157的耐酸实验结果见图5A,在pH2.0时存活率为39%,pH3.0为82%,pH3.5达到97%。通常人体胃部pH维持在3.0~5.0之间[29],由耐酸分析可知,该菌对酸性环境具有良好的耐受性。
屎肠球菌AB157对不同质量浓度梯度的胆盐耐受进行分析,结果见图5B。人体内胆盐的浓度一般为0.3~3 g/L[30],由图5B可知,随着胆盐浓度的升高,菌株AB157的存活率逐渐降低,在胆盐浓度3 g/L时存活率为59%。表明该菌株对高浓度胆盐具有一定的耐受性。
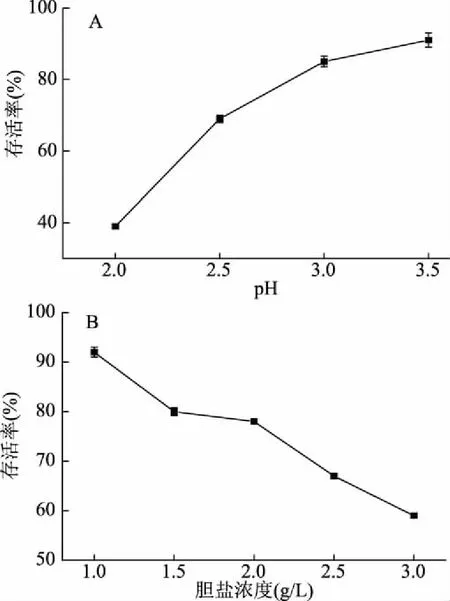
图5 屎肠球菌AB157耐酸和耐胆盐实验Fig.5 Acid and bile salt test for E. faecium AB157
为进一步考察屎肠球菌AB157的潜在益生特性,对其胆固醇降解能力进行分析。经标曲计算,屎肠球菌AB157胆固醇脱除量为18.09 μg/mL(对应吸光值的均值为0.381)。培养基中的胆固醇含量减少可能是由于菌株同化胆固醇的作用[31]。据于志会[32]报道,商业菌株LactobacillurhamnosusGG的胆固醇脱除量为14.84 μg/mL,表明屎肠球菌AB157具有较强的降解胆固醇能力。
3 结论
从四川泡菜中分离得到一株高产GABA菌株AB157,通过生理生化和分子生物学鉴定为屎肠球菌(Enterococcusfaecium)。在单因素实验基础上,采用响应面法对屎肠球菌AB157发酵合成GABA条件优化,得到最佳条件为L-谷氨酸钠质量浓度5.2 g/L、发酵温度31 ℃、初始pH7和发酵时间70 h,在此优化条件,GABA产量达到1.60 g/L。同时,屎肠球菌AB157具有良好的酸、胆盐耐受性和胆固醇降解能力等潜在益生特性,可作为潜在优质功能性微生物资源。

