降解植物甾醇产9α-羟基雄烯二酮工程菌株构建及发酵工艺优化
,*
(1.上海大学生命科学学院,上海 200444;2.中国科学院上海高等研究院,上海 201210)
甾体药物被广泛应用于维持生命、调节机体物质代谢、促进性器官发育、维持生殖等方面,已经成为仅次于抗生素的第二大类药物[1-2]。随着甾体药物市场需求的不断提高,需要对其传统合成路线进行不断研究与创新,提高其合成效率和降低生产成本。利用微生物转化降解甾醇得到重要甾体药物中间体的研究,受到越来越多的关注[3]。9α-羟基雄烯二酮(9α-OH-AD)作为一种重要的甾体药物中间体,通过对其活性部位进行结构改造,可以得到氢化可的松、β米松、地塞米松、可的松等多种重要的甾体药物,具有极高的商业价值[4-7]。
目前,制备9α-OH-AD的途径主要有两种:一种是两步发酵法,首先由分枝杆菌对甾醇切除边链生产雄甾-4-烯-3,17-二酮(AD),然后借助其他微生物(例如诺卡氏菌、红球菌属或工程大肠杆菌)在AD的C9位引入羟基,得到9α-OH-AD,如王康等[8]将来源于分枝杆菌H37Rv 和红平红球菌SQ1的KSH基因在大肠杆菌中异源表达,具有将AD转化得到9α-OH-AD的活性;另外一种方法则是通过对分枝杆菌进行筛选和改造,以甾醇为底物通过一步发酵直接得到9α-OH-AD,如杨亚力等[9]通过筛选得到一株偶发分枝杆菌,能够代谢甾醇直接得到9α-OH-AD。两步法需要先发酵纯化得到AD,再以价格昂贵的AD为底物发酵得到9α-OH-AD,这种制备9α-OH-AD的途径工艺复杂并且成本较高,而通过对分枝杆菌进行改造,以植物甾醇为底物直接得到9α-OH-AD,制备工艺简单并且成本较低,是一种极具工业化潜力的路线。
3-甾酮-9α-羟基化酶(KSH)是甾醇转化过程中的一种关键酶[10-11],可以在AD的C9位上引入一个羟基,将AD转化为9α-OH-AD[12]。KSH是一种由末端加氧酶(KshA)和铁氧还蛋白还原酶(KshB)组成的多聚双组分class IA型单加氧酶,KshA通常以三聚体形式行使功能,KshB通常以单体形式存在,这两个组分需同时存在,KSH才具有活性[13-14]。除了上述两个必需组分,KSH还需要还原态的辅基NADH作为电子供体[15]。袁家代等[16]在分枝杆菌中表达了KSH的编码基因kshA和kshB,该菌能够代谢甾醇产生9α-OH-AD,但是发酵液中9α-OH-AD的最大积累量仅为0.453 g/L。王贵娥等[17]在一株9α-OH-AD生产菌中通过强化KSH的活性,提高了9α-OH-AD的产量,但是最大产量仅为1.443 g/L。因此需要对分枝杆菌的甾醇代谢过程进行深入研究,构建更加高效的产9α-OH-AD的工程菌株。
因此,为提高9α-OH-AD生产水平,本研究通过在一株产AD的分枝杆菌Mycobacteriumsp.TFZ中表达3-甾酮-9α-羟基化酶基因kshA1和kshB1,来构建可以降解植物甾醇生产9α-OH-AD的工程菌株。进一步通过考察底物植物甾醇和不同表面活性剂吐温的浓度对9α-OH-AD产量的影响,建立高效的油水两相发酵体系,以期为实现 9α-OH-AD的进一步工业化生产奠定基础。
1 材料与方法
1.1 材料和仪器
分枝杆菌(MycobacteriumneoaurumDSM 44074,Mycobacteriumsp.TFZ)、大肠杆菌EscherichiacoliDH5α均为本实验室保藏;分枝杆菌过表达质粒pMV306 本实验室保存;Prime STAR HS高保真聚合酶、限制性内切酶EcoRⅠ和HindⅢ TaKaRa公司;ClonExpressⅡ一步克隆试剂盒 南京诺唯赞生物技术公司;基因组提取试剂盒、质粒小量制备试剂盒、琼脂糖凝胶回收试剂盒 Axygen公司;雄烯二酮(AD)、9α-OH-AD标品 云南生物制品;植物甾醇 江苏越红饲料有限公司;玉米浆 上海源肽生物技术有限公司;酵母粉、蛋白胨、葡萄糖、甘油 上海生工生物工程有限公司;卡那霉素、琼脂、吐温-20、吐温-40、吐温-60、吐温-80 上海麦克林生化科技有限公司;大豆油 中粮食品营销有限公司;NaCl、K2HPO4、NaNO3、MgSO4·7H2O、甲醇、乙酸乙酯等 均为分析纯,国药集团(上海)化学试剂有限公司。
BSA 224S-CW型电子天平、PB-10型PH计 德国Sartorius;Centrifuge5430低温离心机、Centrifuge5424型高速离心机 德国Eppendorf公司;DU730型紫外分光光度计 德国BecKman;MLS-3780型高压蒸汽灭菌锅 日本三洋;ZDP-A2160A型全自动电热培养箱、ZHWY-2102C型恒温培养振荡器 上海智城分析仪器制造有限公司;LC-2010型高效液相色谱仪 日本岛津公司;S1000TM型PCR仪 Thermal BIO-RAD;Molecular Imager® Gel DocTMXR System 生物技术公司;EPS 300电泳仪 上海天能科技有限公司。
1.2 实验方法
1.2.1 培养基配制 LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,121 ℃灭菌20 min。LB固体培养基:向LB培养基中添加琼脂15 g/L。分枝杆菌种子培养基:酵母粉15 g/L,葡萄糖6 g/L,NaNO35.4 g/L,(NH4)2HPO40.6 g/L,吐温-80 2 g/L,pH7.5,115 ℃灭菌15 min。分枝杆菌发酵培养基:玉米浆23 g/L,K2HPO42 g/L,NaNO32.8 g/L,葡萄糖9 g/L[18],植物甾醇10 g/L,大豆油100 g/L,pH7.5,115 ℃灭菌15 min。
1.2.2 过表达质粒pMV306-kshA1-kshB1的构建 新金分枝杆菌M.neoaurumDSM 44074基因组DNA的提取,按照细菌基因组DNA提取试剂盒说明书进行操作。根据基因kshA1和kshB1的碱基序列,分别设计引物P306-kshA1-F/R(atacatatgggatccgaattc GTGACTACCGA GACAGCCGG/gaagtgattcctccgaagctt TCAGCTCGGCTGAGCCGG)对kshA1基因进行扩增,设计引物P306-kshB1-F/R(gctcagccgagctgaaagctt GTGCTCGAACTGGAGATCGC/gaagtgattcctccgCTATTC GTCGTAGGTGACTTCCAC)对kshB1基因进行扩增。用限制性内切酶EcoRⅠ和HindⅢ将pMV306质粒线性化,然后利用in-fusion同源重组的方法将kshA1基因连接到质粒pMV306的EcoRⅠ和HindⅢ位点之间构建得到pMV306-kshA1质粒。用限制性内切酶HindⅢ将pMV306-kshA1质粒线性化,利用in-fusion同源重组的方法将kshB1基因连接到质粒pMV306-kshA1的HindⅢ位点之后得到3-甾酮-9α-羟基化酶基因过表达质粒pMV306-kshA1-kshB1。
1.2.3 分枝杆菌电转和阳性克隆筛选 分枝杆菌Mycobacteriumsp.TFZ电转化感受态细胞的制作方法按照文献[19]。将构建好的3-甾酮-9α-羟基化酶基因过表达质粒pMV306-kshA1-kshB1用电击方法转入Mycobacteriumsp.TFZ感受态细胞,并通过50 μg/mL的卡那霉素抗性平板进行抗性筛选,挑取单克隆。以出发菌株Mycobacteriumsp.TFZ为阴性对照,利用引物P306-kshA1-F/P306-kshB1-R进行菌落PCR,PCR产物经测序分析正确的阳性菌落即为构建的工程菌株。
1.2.4 重组菌株的生长曲线的绘制 将重组菌株划线于固体LB培养基活化,30 ℃恒温培养2~3 d后挑取单克隆接种于10 mL种子培养基中,30 ℃、200 r/min培养至对数后期(约48 h),得到液体种子,然后以10%体积的接种量接入50 mL种子培养基,30 ℃、200 r/min振荡培养,每4 h取样检测菌液吸光度值OD600,以培养时间为横坐标,OD600为纵坐标绘制生长曲线。
1.2.5 重组菌株转化产物组成分析 重组菌株液体种子培养方法同1.2.4,在30 mL发酵培养基中接入10%体积的液体种子,于30 ℃、150 r/min恒温振荡培养箱培养至7 d,取样进行HPLC检测,分析转化产物的组成。
1.2.6 重组菌株对植物甾醇的转化曲线 重组菌株液体种子培养过程详见1.2.4,在30 mL发酵培养基中接入10%体积的液体种子,放置在30 ℃、150 r/min恒温振荡培养箱中,每24 h取样进行HPLC检测AD和9α-OH-AD的浓度,以发酵时间为横坐标,分别以AD和9α-OH-AD的浓度为纵坐标,得到重组菌株转化植物甾醇过程中AD和9α-OH-AD的浓度变化曲线。
1.2.7 发酵体系的优化
1.2.7.1 不同浓度植物甾醇对产9α-OH-AD的影响 分枝杆菌发酵培养基其他组分不变,植物甾醇投料量分别为10、15、20、25、30 g/L,每个条件设置三组平行实验,发酵7 d后取样检测9α-OH-AD的浓度。
1.2.7.2 不同种类吐温对产9α-OH-AD的影响 分枝杆菌发酵培养基其他组分不变,植物甾醇投料量为20 g/L,吐温-20、吐温-40、吐温-60、吐温-80的浓度均为4 g/L[20],每个条件设置三组平行实验,发酵7 d后取样检测9α-OH-AD的浓度。
1.2.7.3 不同浓度吐温-80对产9α-OH-AD的影响 分枝杆菌发酵培养基其他组分不变,植物甾醇投料量为20 g/L,吐温-80的浓度分别为1、2、4、6、8、10 g/L,每个条件设置三组平行实验,发酵7 d后取样检测9α-OH-AD的浓度。
1.2.7.4 不同浓度植物甾醇条件下吐温-80对产9α-OH-AD的影响 分枝杆菌发酵培养基其他组分不变,植物甾醇投料量分别为10、15、20、25、30 g/L,对照组不加吐温-80,实验组添加2 g/L的吐温-80,每个条件设置三组平行实验,发酵7 d后取样检测9α-OH-AD的浓度。
1.2.8 AD和9α-OH-AD的检测分析
1.2.8.1 样品处理 在分枝杆菌进行甾醇发酵过程中取样,用等量的乙酸乙酯对样品反复萃取三次,将三次萃取液混合在一起,取50 μL萃取液蒸干,用适量的甲醇超声溶解,经0.22 μm滤膜过滤后进行液相色谱检测。
1.2.8.2 检测方法 AD和9α-OH-AD具有共轭结构,在254 nm处有吸收峰,所以采用高效液相色谱的方法在254 nm下的吸收值,通过比对标准品建立的标准曲线,可以测定产物的相对含量[21]。
AD和9α-OH-AD标准曲线的绘制方法为: 分别准确称量AD和9α-OH-AD标品各0.0500 g,用甲醇将二者溶解并定容至50 mL,配成1 g/L的标准品母液,检测时用甲醇将其准确稀释到浓度分别为0.100、0.080、0.060、0.040、0.020、0.010、0.005、0.001 g/L,HPLC测定其在254 nm下的吸收峰的峰面积,分别以AD和9α-OH-AD标品浓度为横坐标,对应的峰面积为纵坐标,可以分别得到AD和9α-OH-AD的标准曲线方程。
色谱分析条件:C18反相层析柱(Agilent Extend-C18 column,4.6×250 mm,5 μm);流动相为80%甲醇:20%水(V/V),流速为0.4 mL/min;柱温为40 ℃;进样体积为20 μL;紫外检测波长为254 nm。
1.2.8.3 转化产物组成成分测定 出发菌株Mycobacteriumsp.TFZ和重组菌株TFZ3215的转化产物经HPLC检测,产物中的AD、9α-OH-AD、22-羟基-23,24-去甲胆甾-4-烯-3-酮(4-BNA)、雄甾-1,4-二烯-3,17-二酮(ADD)、睾酮(T)和9α,22-二羟基-23,24-去甲胆甾-4-烯-3-酮(9-OH-BNA)在254 nm处均有吸收峰,通过与标准品的出峰时间相比较,由此得出各组分对应的出峰时间和峰面积[22]。根据HPLC归一化法[23-24],将所有组分的出峰面积总和看作100%,由各组分的峰面积占总峰面积的比例,得到各个组分在转化产物中的百分含量。
1.3 数据处理
实验中每个处理做三次平行,采用Origin Pro 9.1软件进行数据处理及绘图。单因素实验结果采用SPSS StatisticsV17.0进行显著性分析,标有相同小写字母表示组间差异不显著(P>0.05),标有不同小写字母表示组间差异显著(P<0.05)。
2 结果与分析
2.1 过表达质粒的构建和重组菌株的筛选
过表达质粒的构建过程如图1所示,以新金分枝杆菌M.neoaurumDSM 44074基因组DNA为模板,分别用引物P306-kshA1-F/R和P306-kshB1-F/R进行PCR扩增,得到目的片段kshA1(大小为1188 bp)和kshB1(大小为1029 bp),如图2泳道1、2所示。pMV306质粒经EcoRⅠ和HindⅢ双酶切线性化的片段(大小为4358 bp)如泳道3所示,pMV306-kshA1质粒经HindⅢ单酶切线性化的片段(大小为5546 bp)为pMV306质粒和目的片段kshA1长度之和(泳道4)。pMV306-kshA1-kshB1质粒经EcoRⅠ和HindⅢ酶切验证的结果如泳道5,短条带为目的片段kshA1,长条带为pMV306质粒和目的片段kshB1长度之和。将pMV306-kshA1-kshB1质粒送上海杰李测序公司,以P306-kshA1-F/P306-kshB1-R引物进行测序。

图1 过表达质粒pMV306-kshA1-kshB1的构建策略Fig.1 Construction schematic of over-expression plasmid pMV306-kshA1-kshB1

图2 过表达质粒的电泳图Fig.2 Electrophoretogram of over-expression plasmid注:M:DNA Marker;1:目的基因kshA1条带;2:目的基因kshB1条带;3:pMV306质粒EcoRⅠ和HindⅢ双酶切条带;4:pMV306-kshA1质粒HindⅢ单酶切条带;5:pMV306-kshA1-kshB1质粒酶切验证条带;6:出发菌株TFZ对照;7:重组菌TFZ3215菌落PCR验证。
挑取阳性单克隆,以引物P306-kshA1-F/P306-kshB1-R进行菌落PCR验证,结果如泳道7所示,该片段在2200 bp左右,为kshA1和kshB1片段长度之和,经测序该片段为基因kshA1和kshB1,并且出发菌株TFZ菌落PCR结果如泳道6所示无目的条带。由此可知,过表达质粒pMV306-kshA1-kshB1已转入Mycobacteriumsp.TFZ菌株,得到重组菌株Mycobacteriumsp.TFZ3215。
2.2 重组菌株的生长状况
出发菌株Mycobacteriumsp.TFZ和重组菌株Mycobacteriumsp.TFZ3215的生长状况如图3所示,出发菌株和重组菌株的生长状况大致相同,0~9 h为滞后期,10~25 h为对数生长期,25~35 h为平稳期,之后进入衰退期。说明过表达质粒pMV306-kshA1-kshB1的转入不会对重组菌TFZ3215的生长产生负面影响。
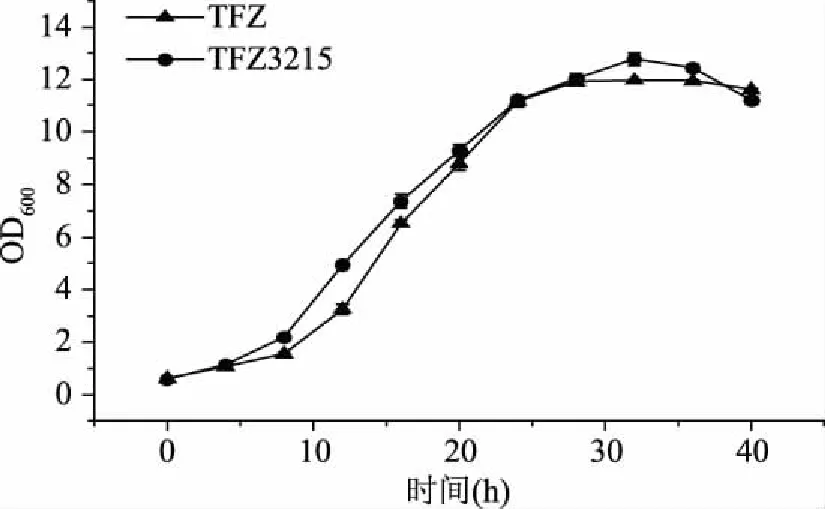
图3 Mycobacterium sp.TFZ和TFZ3215生长曲线Fig.3 Growth curve of Mycobacterium sp.TFZ and TFZ3215
2.3 AD和9α-OH-AD的标准曲线方程
将8种不同浓度的AD和9α-OH-AD标品分别经HPLC检测后,根据它们的峰面积,分别计算AD和9α-OH-AD的标准曲线方程。
9α-OH-AD标准曲线的回归方程为:
Y=112.951X-0.006
式中:X表示9α-OH-AD的浓度,g/L;Y表示相应的峰面积,106;9α-OH-AD的浓度在0.001~0.08 g/L范围内,相关系数r=0.99963,显示了极好的线性关系。
AD标准曲线的回归方程为:
Y=110.851X-0.007
式中:X表示AD的浓度,g/L;Y表示相应的峰面积,106;AD的浓度在0.001~0.08 g/L范围内,相关系数r=0.99961,显示了极好的线性关系。
2.4 出发菌株和重组菌株转化产物分析
分别利用出发菌株Mycobacteriumsp.TFZ和重组菌株Mycobacteriumsp.TFZ3215对植物甾醇进行生物转化,用高效液相色谱检测转化产物。出发菌株TFZ转化产物中的主要产物为AD,含量为80.1%,还有大量(约12%)的22-羟基-23,24-去甲胆甾-4-烯-3-酮(4-BNA)和少量的雄甾-1,4-二烯-3,17-二酮(ADD)、睾酮(T)和9α-OH-AD等副产物。重组菌株TFZ3215的转化产物中,9α-OH-AD是主要产物,含量达到了94.7%,仅有少量的AD和9α,22-二羟基-23,24-去甲胆甾-4-烯-3-酮(9-OH-BNA)杂质,而4-BNA、ADD和T等杂质已消失。重组菌株TFZ3215与出发菌株TFZ相比,主产物由AD转化为9-OH-AD,主要产物的纯度由80.1%增加至94.7%,杂质的量也明显减少,具有重要的工业化应用前景。
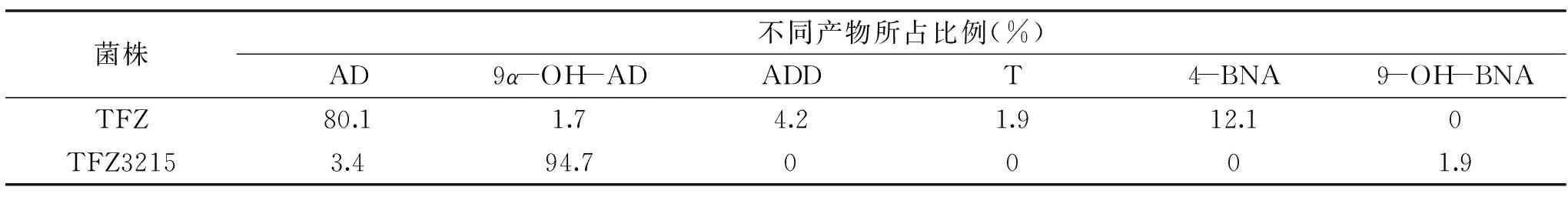
表1 Mycobacterium sp.TFZ和TFZ3215转化产物分析Table 1 Analysis of the products of the Mycobacterium sp.TFZ and TFZ3215
2.5 重组菌株对植物甾醇的转化
出发菌株Mycobacteriumsp.TFZ和重组菌株Mycobacteriumsp.TFZ3215以植物甾醇为底物进行生物转化,发酵液中AD和9α-OH-AD浓度的变化情况如图4所示。出发菌株TFZ和重组菌株TFZ3215发酵过程中AD浓度的变化情况如图4A所示,出发菌株TFZ发酵过程中AD的浓度逐渐增加,达到约3.28 g/L,而重组菌株TFZ3215发酵液中AD的积累量仅约0.12 g/L。出发菌株TFZ和重组菌株TFZ3215发酵过程中9α-OH-AD浓度的变化情况如图4B所示,出发菌株TFZ发酵过程中仅有极少量的9α-OH-AD积累,约0.07 g/L,重组菌株TFZ3215发酵液中9α-OH-AD浓度随着时间推移不断增加,最终积累量达到3.43 g/L左右,9α-OH-AD的浓度是出发菌株的49倍。上述实验结果表明:重组菌株中转入的kshA1和kshB1基因已经成功表达,且3-甾酮-9α-羟基化酶具有极好的催化活性,可以将AD高效的转化为9α-OH-AD。

图4 Mycobacterium sp.TFZ和TFZ3215对植物甾醇的生物转化Fig.4 Bioconversion of phytosterols byMycobacterium sp.TFZ and TFZ3215
2.6 重组菌株发酵体系的优化
2.6.1 植物甾醇的浓度对产9α-OH-AD的影响 为了提高重组菌TFZ3215的9α-OH-AD产量,增加发酵底物植物甾醇的投料量,测定发酵液中9α-OH-AD的积累量。如图5所示,当植物甾醇的投料量为15 g/L时,9α-OH-AD产量增加至5.22 g/L,是植物甾醇投料量为10 g/L时的1.5倍。植物甾醇增加至20 g/L及以上时,9α-OH-AD产量反而低于植物甾醇投料量为10 g/L时,这可能是由于过高浓度的植物甾醇影响了反应体系的乳化,难以形成均匀稳定的反应体系,影响了植物甾醇的转化,进而导致9α-OH-AD产量的减少。为了使油水体系均一稳定,可以通过添加分散剂的方法来达到稳定的转化状态[25]。

图5 不同浓度植物甾醇条件下9α-OH-AD产量Fig.5 Yield of 9α-OH-AD under different concentrations of phytosterols注:不同小写字母表示差异显著(P<0.05);图6~图7同。
2.6.2 不同种类吐温对产9α-OH-AD的影响 吐温作为一种非离子型表面活性剂,能促进不溶于水的植物甾醇在水相中的分散,在油水转化体系中,可以促进反应体系的乳化,从而达到均匀的状态,促进植物甾醇的转化。在植物甾醇的投料量为20 g/L的基础上,添加4 g/L不同的吐温作为表面活性剂,168 h后取样测定9α-OH-AD产量。结果表明,添加吐温-20、吐温-40、吐温-60作为表面活性剂的实验组中,9α-OH-AD产量显著低于对照组(P<0.05),而在添加吐温-80作为表面活性剂时,9α-OH-AD产量为5.24 g/L,9α-OH-AD的产量是对照组(2.18 g/L)的2.4倍(图6),显著高于对照组(P<0.05)。这说明吐温的种类及乳化能力会影响甾醇转化的效率,吐温-80乳化能力比其他3种吐温更强,主要原因可能是吐温-80可以使菌体、油脂和植物甾醇更容易形成均匀状态,从而有利于植物甾醇的转化。

图6 不同种类吐温条件下9α-OH-AD产量Fig.6 9α-OH-AD yield under different types of Tween
2.6.3 不同浓度吐温-80对产9α-OH-AD的影响 反应体系中吐温-80的浓度过低,油水体系不能很好地乳化,不利于植物甾醇的转化,而吐温-80的浓度过高,会抑制菌体的生长,同样影响植物甾醇的转化,因此需要优化体系中吐温-80的质量浓度。在植物甾醇的投料量为20 g/L的基础上,通过在发酵液中添加不同质量浓度的吐温-80来分析不同吐温-80含量对9α-OH-AD产量的影响。结果表明:吐温-80的质量浓度对9α-OH-AD产量有着显著影响(P<0.05),当吐温-80的质量浓度增加至2 g/L时,9α-OH-AD的产量逐渐增加至7.12 g/L,是对照组的3.3倍,当吐温-80的质量浓度超过2 g/L后,9α-OH-AD的产量逐渐减少(图7)。上述研究结果表明:当发酵液中吐温-80的质量浓度为2 g/L时,能够有效地促进反应体系的乳化,促进分枝杆菌对底物植物甾醇的转化,提高了产物9α-OH-AD的产量。

图7 不同浓度吐温-80条件下9α-OH-AD产量Fig.7 Production of 9α-OH-AD at different concentrations of Tween-80
2.6.4 不同浓度植物甾醇条件下吐温-80对9α-OH-AD产量的影响 在植物甾醇投料量为20 g/L时,2 g/L的吐温-80可以显著提高9α-OH-AD的产量。为了验证在不同投料量的条件下,优化的转化体系仍然有效,在添加2 g/L的吐温-80的条件下,考察了植物甾醇投料量分别为10、15、20、25、30 g/L时,发酵液中9α-OH-AD的产量。研究结果表明:当植物甾醇的投料量为10、15 g/L时,与对照(无吐温-80)相比,9α-OH-AD的产量增加较少,可能是因为植物甾醇的投料量较低,油水体系能够达到均匀稳定的状态,吐温-80不是影响甾醇转化的关键因素。当植物甾醇为25 g/L时,9α-OH-AD的产量为7.53 g/L,为优化前的4.4倍;而当植物甾醇的投料量为30 g/L时,9α-OH-AD的产量为5.6 g/L,是优化前的3.3倍,但是低于植物甾醇为25 g/L时的产量,这可能是由于植物甾醇的投料量过高,难以形成均一稳定的乳化体系,导致底物植物甾醇转化率过低,从而减少了产物9α-OH-AD的产量。

图8 2 g/L吐温-80和不同浓度植物甾醇条件下9α-OH-AD产量Fig.8 Yield of 9α-OH-AD under 2 g/L of Tween-80 and different concentrations of phytosterols
3 结论与讨论
本实验在一株主产AD的Mycobacteriumsp.TFZ中成功表达了KSH酶,得到一株可直接转化植物甾醇产9α-OH-AD的工程菌Mycobacteriumsp.TFZ3215,与出发菌株相比,9α-OH-AD的含量由1.7%提高到94.7%,AD的含量由80.1%减少到3.4%。在油-水双相的发酵体系中,底物植物甾醇浓度为10 g/L时,重组菌Mycobacteriumsp.TFZ3215的9α-OH-AD产量为3.43 g/L。进一步对乳化体系进行优化,结果表明:在发酵液中添加2 g/L的吐温-80,9α-OH-AD产量可提高到7.53 g/L,为优化前的4.4倍,显著高于国内报道的水平[26-28]。但是构建的工程菌株Mycobacteriumsp.TFZ3215在转化植物甾醇的过程中,出现了副产物9-OH-BNA,推测该副产物来自于侧链的不完全降解[22],因此,后续需要对工程菌株Mycobacteriumsp.TFZ3215进一步改造,从而减少副产物9-OH-BNA的生成。另外,在发酵过程中发现当植物甾醇的投料量增加至30 g/L时,9α-OH-AD产量却低于25 g/L的植物甾醇投料量,这可能是由于植物甾醇的投料量的增加重新破坏了发酵液中的乳化体系,影响了植物甾醇的转化。因此,应进一步优化发酵体系中植物油和植物甾醇的比例关系或筛选更加高效的乳化剂,使油水转化体系达到更加稳定均一的状态,提高植物甾醇的转化率,从而进一步提高9α-OH-AD产量。

