SCFAs对奶牛瘤胃上皮细胞Ca2+信号通路相关基因表达的影响
宁丽丽 成 健 詹 康 杨天宇 姜茂成 赵国琦,2,3*
(1.扬州大学 动物科学与技术学院,江苏 扬州 225009;2.扬州大学 农业科技发展研究院,江苏 扬州 225009;3.扬州大学 教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;4.常熟市海虞动物防疫站,江苏 常熟 215500)
短链脂肪酸(Short chain fatty acid, SCFAs)是瘤胃内通过厌氧细菌发酵日粮产生的碳原子数为1~6的有机脂肪酸,主要包括乙酸、丙酸和丁酸,约占总挥发性脂肪酸95%[1]。SCFAs可部分代谢为酮体和乳酸,也可作为瘤胃上皮细胞的能量来源,反刍动物对SCFAs的依赖可以达到能量需求的70%[2]。G-蛋白偶联受体41(G-protein-coupled receptor 41, GPR41)和GPR43已经被证明是SCFAs的受体[3]。GPR41和GPR43在各个组织中均有表达, GPR41在脂肪细胞中表达最高,GPR43在免疫细胞中表达最高[4]。并且GPR41和GPR43已经在奶牛不同的组织中被鉴定,在奶牛瘤胃上皮细胞(BRECs)中GPR41的表达量高于GPR43[5]。GPR41和GPR43都可以与G蛋白家族的Gi/o蛋白和Gq蛋白偶联,从而增加细胞内钙离子浓度和降低cAMP浓度[7]。GPR41主要与Gi/o蛋白偶联激活信号传导系统,而GPR43主要与Gq蛋白偶联激活信号传导系统[8-9]。
钙离子参与机体的各项生理活动,不仅可以维持细胞膜两侧的生物电位,正常的神经传导功能,正常的肌肉伸缩与舒张功能以及神经-肌肉传导功能等,还可以发挥某些激素的作用机制。细胞内的Ca2+浓度可以通过“G蛋白偶联-PIP2-1,4,5-三磷酸肌醇(IP3)”信号途径来调节[10]。磷脂酶C(PLC)和蛋白激酶C(PKC)是Ca2+信号通路中引起级联反应的关键分子[11]。PLCL1、PLCE1和PLCB2是PLC的3个家族,PKCB和PKCG是PKC的2种亚类。
在重组表达的GPR41或GPR43 CHO细胞中,SCFAs可以促进IP3水平的上升以及cAMP含量的下降,并且还会导致MAPK的活化和Ca2+的释放[4]。SCFAs刺激奶牛乳腺上皮细胞(BMECs)后,在2~4 s内诱导细胞内Ca2+浓度增加,60 s内可以达到最大值。研究表明SCFAs是通过与GPR41、GPR43结合和活化而参与BMECs中的信号传导[12]。此外,SCFAs可能通过GPR41和GPR43调节动物的神经系统。如丙酸可通过GPR41加强交感神经外流,但是在抑制GPR41的情况下丙酸并没有加强交感神经的活性。经过siRNA试验证明,交感神经的激活是通过GPR41介导的[13]。有研究表明,奶牛瘤胃上皮细胞(BRECs)在缺乏SCFAs的条件下,GPR41不能被表达[14],SCFAs对BRECs 的Ca2+信号通路调控研究尚未有相关报道。因此,本研究旨在探讨SCFAs对瘤胃上皮细胞的Ca2+信号通路相关分子的表达以及细胞内Ca2+浓度的影响,为进一步探究SCFAs对各种细胞Ca2+信号通路的影响提供依据。
1 材料与方法
1.1 试验材料
DMEM高糖培养基、澳洲胎牛血清、非必需氨基酸(NEAA)、磷酸盐缓冲液(PBS)和胰蛋白酶(Gibco,美国);乙酸、丙酸、丁酸、青霉素、链霉素、L-谷氨酰胺溶液和乙二胺四乙酸(EDTA)(Sigma,美国);PrimeScriptTMRT Master Mix和SYBR®Premix Ex TaqTM Ⅱ(TaKaRa,中国);荧光定量96孔板和8连管(Bio-rad,美国);总RNA提取试剂盒(Tiangen,中国);Fluo-4/AM(Beyotime,中国);FACS LSRFortessa流式细胞分析仪(BD,美国);试验所用野生型BRECs和通过CRISPR/Cas 9系统敲除GPR41的BRECs均由扬州大学动物培养物保藏与应用研究所(IACCA)提供[15]。
1.2 试验方法
1.2.1试验设计
试验分为3个处理组,每个处理有3个重复,第1组为正常野生型瘤胃上皮细胞;第2组为培养基中含20 mmol/L SCFAs野生型瘤胃上皮细胞;第3组为培养基中含20 mmol/L SCFAs且通过CRISPR/Cas 9系统敲除GPR41基因的瘤胃上皮细胞。放置37 ℃、5% CO2的培养箱中。24 h之后,消化并收集细胞进行RNA提取。20 mmol/L SCFAs组成:12 mmol/L 乙酸、5 mmol/L丙酸和3 mmol/L丁酸。
1.2.2总RNA提取
按照总RNA提取试剂盒(Tiangen,中国)提取总RNA。最后,取1 μL提取的样品进行总RNA浓度和纯度的测定。
1.2.3反转录成cDNA
按照Takara反转录试剂盒进行,整个过程在冰上操作。反转录体系为10 μL,反应条件:37 ℃ 15 min 和85 ℃ 5 s;PCR反应体系为20 μL,反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,每个样品都有3个重复。
1.2.4Real-time PCR
荧光定量PCR反应配置总体系为20.0 μL,其中SYBR®Premix Ex TaqTMⅡKit 10.0 μL;10 μmol/L 的PCR Forward primer和PCR Reverse Primer各0.8 μL;Water PCR grade 6.4 μL;cDNA 2.0 μL。引物详情见表1。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,每个样品都有3个重复。计算方法按照2-ΔΔCT。
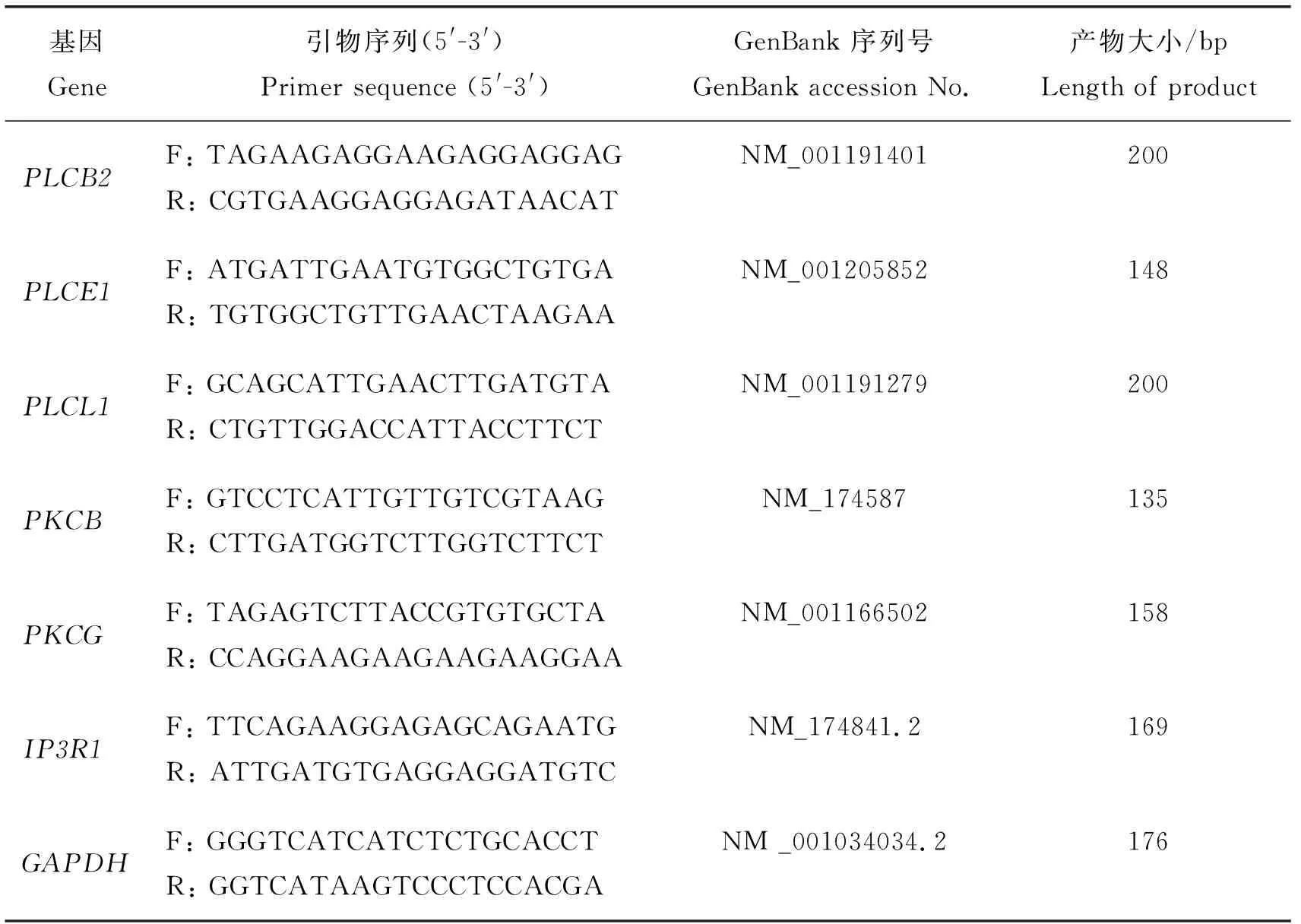
表1 荧光定量PCR引物Table 1 Reverse-transcription PCR primers
1.2.5细胞内游离钙离子浓度的测定
待接种细胞培养24 h后,第2和第3处理组分别加20 mmol/L SCFAs作用2 min。收集3组细胞,加Fluo-4/AM(终浓度2.5 μmol/L)37℃避光孵育30 min进行荧光探针装载,随后PBS漂洗2次,流式细胞仪检测。激发波长为494 nm,发射波长为516 nm,检测的平均荧光强度来表示细胞内Ca2+浓度。
1.3 数据统计分析
结果采用“平均数±标准差”表示。运用SPSS 16. 0统计软件中的One-Way ANOVA模块进行单因素方差分析,显著性检验应用LSD法。P<0.05表示差异显著,P<0.01表示极显著差异。
2 结果与分析
2.1 SCFAs对BRECs中PLC表达的影响
采用qRT-PCR分别检测PLCL1、PLCE1和PLCB2在不同处理的BRECs中的表达变化,结果见图1。在缺乏SCFAs的条件下,PLCB2几乎不被表达;添加20 mmol/L SCFAs之后,PLCB2被极显著激活(P<0.01),PLCL1和PLCE1表达量上调,差异不显著(P>0.05)。与添加SCFAs的野生型BRECs相比,敲除GPR41基因之后,PLCL1的表达量有下调的趋势(P>0.05),而PLCE1和PLCB2的表达量极显著增加(P<0.01)。

WT代表野生型BRECs;GPR41KO代表通过CRISPR/Cas 9系统敲除GPR41;数据标注不同小写字母表示差异显著(P<0.05)。下同。WT stands for wild-type BRECs. GPR41KO stands for knocking out GPR41 through the CRISPR/Cas 9 system. Data annotations with different lowercase letters mean significant difference (P<0.05). The same below.图1 SCFAs对BRECs中PLC的mRNA表达影响Fig.1 Effects of SCFAs on the abundance of PLC mRNA in the BRECs
2.2 SCFAs对BRECs中PKC表达的影响
PKCB和PKCG在不同处理的BRECs中的表达见图2。与野生型相比,敲除GPR41之后,添加SCFAs可以上调PKCB和PKCG的表达量,但是差异不显著(P>0.05)。
2.3 SCFAs对BRECs中IP3R1表达的影响
由图3可知,促进内质网钙库释放的分子IP3R1在SCFAs诱导下,其mRNA表达量被显著上调(P<0.05);与野生型BRECs比,敲除GPR41之后,添加SCFAs,IP3R1的mRNA表达量显著下调(P<0.05)。
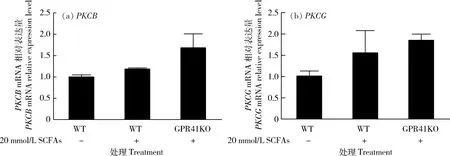
(a) SCFAs对PKCB的mRNA表达影响;(b) SCFAs对PKCG的mRNA表达影响。(a) Effects of SCFAs on the abundance of PKCB mRNA; (b) Effects of SCFAs on the abundance of PKCG mRNA.图2 SCFAs对BRECs中PKC的mRNA表达影响Fig.2 Effects of SCFAs on the abundance of PKC mRNA in the BRECs

图3 SCFAs对IP3R1的mRNA表达影响Fig.3 Effects of SCFAs on the abundance of IP3R1 mRNA
2.4 SCFAs对BRECs中Ca2+浓度的影响
从图4可知,在野生型BRECs内Ca2+浓度在SCFAs刺激后提高了21%,但差异不显著(P>0.05);与野生型BRECs比,敲除GPR41之后,添加20 mM SCFAs细胞内Ca2+浓度降低了15%,但差异不显著(P>0.05)。
3 讨 论
细胞内钙离子浓度的变化对细胞代谢和细胞增殖中的信息传递有非常重要的意义。细胞内钙信号是免疫细胞激活的关键因素,当抗原受体被触发时,钙从细胞外流入细胞内[16]。Kimura等[17]研究发现,围产期奶牛单核细胞内钙储量较低,导致免疫细胞激活信号下钙离子的释放变弱。SCFAs是反刍动物体内主要的能量来源,并且可以调节瘤胃上皮细胞生长、瘦素水平、胰岛素分泌和免疫应答过程[18-19]。SCFAs还可以刺激交感神经系统的激活,促进机体能量消耗[13]。GPR41和GPR43已经被证明是SCFAs的受体,奶牛瘤胃上皮细胞中GPR41的表达量高于GPR43[5]。有研究表明,添加20 mmol/L SCFAs和40 mmol/L SCFAs可以显著增加BRECs中GPR41的表达量[6],而缺乏SCFAs的条件下,GPR41并不能够被表达[14]。因此,本试验通过在野生型瘤胃上皮细胞和敲除GPR41之后的瘤胃上皮细胞中添加SCFAs来检测Ca2+信号通路中关键分子的表达量以及细胞内Ca2+浓度的变化。
PLC和PKC是Ca2+信号通路中引起级联反应的关键分子。IP3R是促进内质网钙库释放的受体[11]。qRT-PCR结果表明,在缺乏SCFAs时,PLCB2几乎不表达,但是添加20 mmol/L SCFAs后显著被激活,并且PLCE1和PLCL1表达量也有所提高,暗示PLC进一步将IPI2分解为二酰甘油(DAG)和三磷酸肌醇(IP3)。IP3R是IP3受体,与IP3结合之后诱导其表达。因此,添加20 mmol/L SCFAs之后,IP3R1能极显著激活。IP3R的表达介导内质网释放Ca2+,添加SCFAs之后,细胞内Ca2+浓度提高了21%。SCFAs刺激BMECs之后诱导细胞内Ca2+浓度增加[12]。Yonezawa等[20]研究表明,GPR41和GPR43被SCFAs激活后,诱导细胞内钙离子浓度上升并且不受百日咳毒素的阻断作用。丁酸与大鼠的脑垂体细胞在一起孵育后可以增加细胞内Ca2+的浓度,这主要是通过GPR41和GPR43信号通路实现的[21]。SCFAs促进Ca2+浓度的升高与本研究结果一致。细胞内游离的Ca2+进一步增加了PKC活化,添加SCFAs之后,PKCB和PKCG的表达量有所提高,和Ca2+浓度的变化趋势相同。PKC进一步激活MAPK信号通路,引起级联反应,进行细胞信号转导。由此可以看出SCFAs激活细胞内Ca2+信号通路与细胞内MAPK信号通路是相辅相成的。丁酸不仅诱导细胞内Ca2+浓度增加,而且也诱导GPR41和GPR43增加。在生长释放素激素的作用下,GPR43基因沉默后,细胞内的Ca2+浓度并没有改变[12]。
为探究SCFAs对BRECs中Ca2+信号通路的调控机制,本文通过由扬州大学动物培养物保藏与应用研究所提供的CRISPR/Cas 9系统敲除GPR41基因的BRECs来进行深入研究。敲除BRECs中的GPR41基因,添加SCFAs之后,GPR41的表达量显著下降,表明GPR41的一个等位基因被成功地敲除[11]。本试验结果显示,添加20 mmol/L SCFAs之后,与野生型BRECs比,敲除GPR41显著上调了PLCB2和PLCE1的表达量;PLCL1的表达量降低,PKCB和PKCG的表达量升高,但是均无显著差异。由此可以看出SCFAs不是通过GPR41加强PLCB2、PLCE1、PLCL1、PKCB和PKCG的表达。相反,IP3R1的表达量被显著下调,该结果表明SCFAs对IP3R1的调控是通过GPR41实现的。而且本试验细胞内Ca2+浓度降低了15%,是由于内质网上IP3R1的低表达抑制了内质网上钙库中Ca2+的释放。
4 结 论
SCFAs可以通过激活其受体GPR41来调控BRECs上皮细胞IP3R1、PLCE1和PLCB2的表达,及细胞内Ca2+释放,以进一步激活Ca2+信号通路。

