低温胁迫下不同浓度ABA对4个油棕新品种幼苗生理特性的影响
刘艳菊 周丽霞 曹红星
摘 要:探讨低温胁迫下不同品种油棕幼苗ABA合成酶基因NCED3表达特性及不同浓度ABA对其幼苗生长和生理的影响,为提高不同品种油棕幼苗抗寒能力提供理论依据。以油棕新品种Ni、C×N、B×E、D×N为材料,对其进行低温胁迫处理(15、10、5 ℃,5 d),利用实时荧光定量PCR(qPCR)检测4种油棕幼苗的NCED3基因表达特性;然后,10 ℃低温胁迫下对4种油棕幼苗外施不同浓度ABA(50~300 μmol/L ABA),测定其可溶性蛋白、可溶性糖、脯氨酸含量和超氧化物歧化酶(SOD)及过氧化物酶(POD)活性等生理指标。结果表明,低温胁迫可触发4种油棕幼苗ABA合成酶基因NCED3的過量表达,外施50~300 μmol/L ABA均降低幼苗质膜透性和SOD酶活性,抑制MDA和H2O2含量上升,缓解低温胁迫引起的膜脂过氧化,提高可溶性蛋白、可溶性糖含量和POD活性,进而提高油棕幼苗抗寒性。4个品种中,B×E材料的耐寒能力较强。
关键词:油棕;ABA;低温胁迫中图分类号:S31 文献标识码:A
Effects of Exogenous ABA on Physiology of Four New Oil PalmVarieties under Cold Stress
LIU Yanju1,2, ZHOU Lixia1,2, CAO Hongxing1,2*
1. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wenchang, Hainan 571339, China; 2. Hainan Key Biological Laboratory of Tropical Oil Crops, Wenchang, Hainan 571339, China
Abstract: In order to provide theoretical basis for improving cold resistance of different oil palm varieties, the present experiment was conducted to investigate the expression characteristics of ABA synthase geneNCED3of different oil palm varieties under cold stress and the growth and physiology effects of different ABA concentrations on cold resistance of different oil palm varieties. The new oil palm varieties Ni, C×N, B×E and D×N were used as the materials, treated with low temperature stress (15 ℃, 10 ℃, 5 ℃, 5 d). The expression characteristics ofNCED3in the seedlings were detected by real-time quantitative PCR (qPCR). Then, different concentrations of ABA (50-300 μmol/L ABA) were applied to the seedlings under 10 ℃, and the physiological indexes were determined, including soluble protein content, soluble sugar content, proline content, H2O2content, MDA content, SOD and POD activity. Cold stress could trigger the overexpression of ABA synthase geneNCED3 in the seedlings. The application of 50-300 μmol/L ABA decreased the plasma membrane permeability and SOD activity of the seedlings, inhibited the increase of MDA and H2O2levels, so the membrance lipid peroxidation caused by cold stress was relieved, soluble protein, soluble sugar content and POD activity were increased, and thus improved cold resistance of the seedlings. B×E had strong cold tolerance.
Keywords: oil palm; ABA; cold stress
DOI: 10.3969/j.issn.1000-2561.2020.06.008
油棕(Elaeis guineensisJacq.)属棕榈科(Palmae)多年生热带木本油料作物,被誉为“世界油王”[1],在我国主要分布于海南、云南、广东、广西等地。油棕喜高温,在热量不足的环境下生长缓慢,因此,低温成为限制其产量提高和种植面积进一步扩大的主要因子之一。目前,国内关于油棕抗寒的研究多集中在描述油棕生理生化反应方面[2-4],而关于提高油棕抗寒能力的研究较少。
ABA作为植物生产中广泛应用的一种植物激素和信号分子,能促进器官衰老和脱落、调节基因表达等作用。低温胁迫下,ABA与植物受体蛋白的结合能力增强,感知和传递低温胁迫信号,从而调控植物体内各物质的平衡和诱导植物的胁迫抗性[5]。研究表明,ABA在干旱、高盐、低温和病虫害等逆境胁迫反应中起到重要作用[6]。在逆境条件下,植物合成大量ABA,抑制气孔开放,促进水分吸收,降低叶片伸展率,诱导特异性蛋白质合成,从而增强植株抵抗逆境能力[7-8],而9-顺-环氧类胡萝卜素双加氧酶(NCED)是植物ABA生物合成途径中的关键酶,其催化裂解反应直接生成ABA的前体物质。干旱胁迫可诱导烟草NCED3基因表达以及内源ABA的积累[9],NCED3在水稻中的过量表达能提高水稻中内源ABA的水平,从而提高植物的耐旱性[10]。
笔者前期研究发现,低温胁迫下喷施ABA可提高油棕本地种幼苗抗寒能力[11]。但低温胁迫下,油棕幼苗叶片ABA合成酶基因NCED3变化情况及ABA对不同品种油棕幼苗抗寒生长和生理影响的研究尚未见报道,因此,测定低温胁迫下不同品种油棕幼苗ABA合成酶基因NCED3及不同浓度ABA对不同品种油棕幼苗抗寒生长和生理相关指标能够为提高油棕种苗抗寒能力提供理论依据。
1 材料与方法
1.1 材料
中国热带农业科学院椰子研究所从尼日利亚引进的资源Ni,哥斯达黎加引进的资源C×N、B×E、D×N,共4个油棕新品种,选取幼苗苗高30~35 cm,5叶1心,生长健壮,无病虫害为试验材料。
1.2 方法
1.2.1 试验设置 (1)低温胁迫对不同品种油棕叶片ABA合成酶基因NCED3的影响。人工气候箱设4个温度处理,分别为28 (CK)、15、10、5 ℃,光照約为4000 lx,光周期为12 h,湿度70%,进行低温胁迫。处理5 d后取心叶外围第2片叶进行各指标测定。每次处理5株苗,3次重复。
(2)低温胁迫外施ABA对不同品种油棕生理指标的影响。试验设5个处理,为0、50、100、200、300 μmol/L ABA,以常温管理和不喷施ABA的油棕幼苗为对照(CK)。分别置于10 ℃人工气候箱中(光照约为4000 lx,光周期为12 h,湿度70%)进行低温胁迫。低温胁迫期间每天分别喷施固定量的0、50、100、200、300 μmol/L ABA,均匀喷洒于叶面上。处理5 d后取心叶外围第2片叶进行各指标测定。每次处理5株苗,3次重复。
1.2.2 总RNA提取及cDNA第一链合成 采用植物RNA提取试剂盒提取低温处理后的4种油棕心叶的总RNA,参照Prime Script RT试剂盒说明反转录合成cDNA第一链。
1.2.3 引物设计及合成 从NCBI搜索获得油棕基因组序列,从The Arabidopsis Information Resource(TAIR)数据库搜索获得NCED3基因,并与油棕基因组序列进行比对,找出同源基因。通过蛋白氨基酸序列比对,将存在NCED3保守结构域的蛋白编码基因判定为油棕NCED3基因。利用Primer 5.0设计油棕NCED3基因的qPCR引物,以Actin为内参基因,引物序列为NCED3-f (5?-TCCAGCGAGGAACTGAACG-3?),NCED3-r(5?-CCACCAATGCCTCATCCTG-3?)。由北京六合华大基因科技股份有限公司合成。
1.2.4NCED3基因qPCR检测 qPCR反应体系25 μL:2×SYBR Green Master Mix 12.5 μL,10 μmol/L的正、反向引物各1.0 μL,40 μmol/L cDNA模板2.0 μL,ddH2O补足至25.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 10 s,58 ℃ 25 s,72 ℃ 30 s(延伸阶段采集信号),进行30个循环后作溶解曲线(65~95 ℃,0.1 ℃/s)。每个样品重复3次,结果采用2?DDCT法计算基因的相对表达量。当基因表达量上调或下调大于2倍时判定为存在表达差异。
1.2.5 生长指标的测定 幼苗土面到顶端新芽芽尖的距离为株高,外施ABA处理前后分别测量单株幼苗的株高,其差值即为株高生长量;全株收获洗净后将茎叶的地上部分和根的地下部分分开,烘箱110 ℃杀青15 min,80 ℃烘干至恒质量,每一单株茎叶的干质量和根干质量的总和即为全株干质量,每一单株根干质量与茎叶干质量的比值即为根冠比。
1.2.6 生理指标的测定 可溶性蛋白质含量采用考马斯亮蓝G-250法、可溶性糖含量采用蒽酮比色法[12]测定,过氧化氢(H2O2)含量采用硫酸钛法[13],丙二醛(MDA)含量采用硫代巴比妥酸法[14],脯氨酸含量测定采用磺基水杨酸法[15],质膜透性测定采用电导法[16],超氧化物歧化酶(SOD)和过氧化物酶(POD)活性测定应用南京建成试剂盒进行测定。
1.3数据处理
采用Excel 2010进行试验数据的统计和制图,采用DPS 7.05软件进行方差分析。
2 结果与分析
2.1低温胁迫下不同品种油棕幼苗ABA合成酶基因NCED3相对表达量
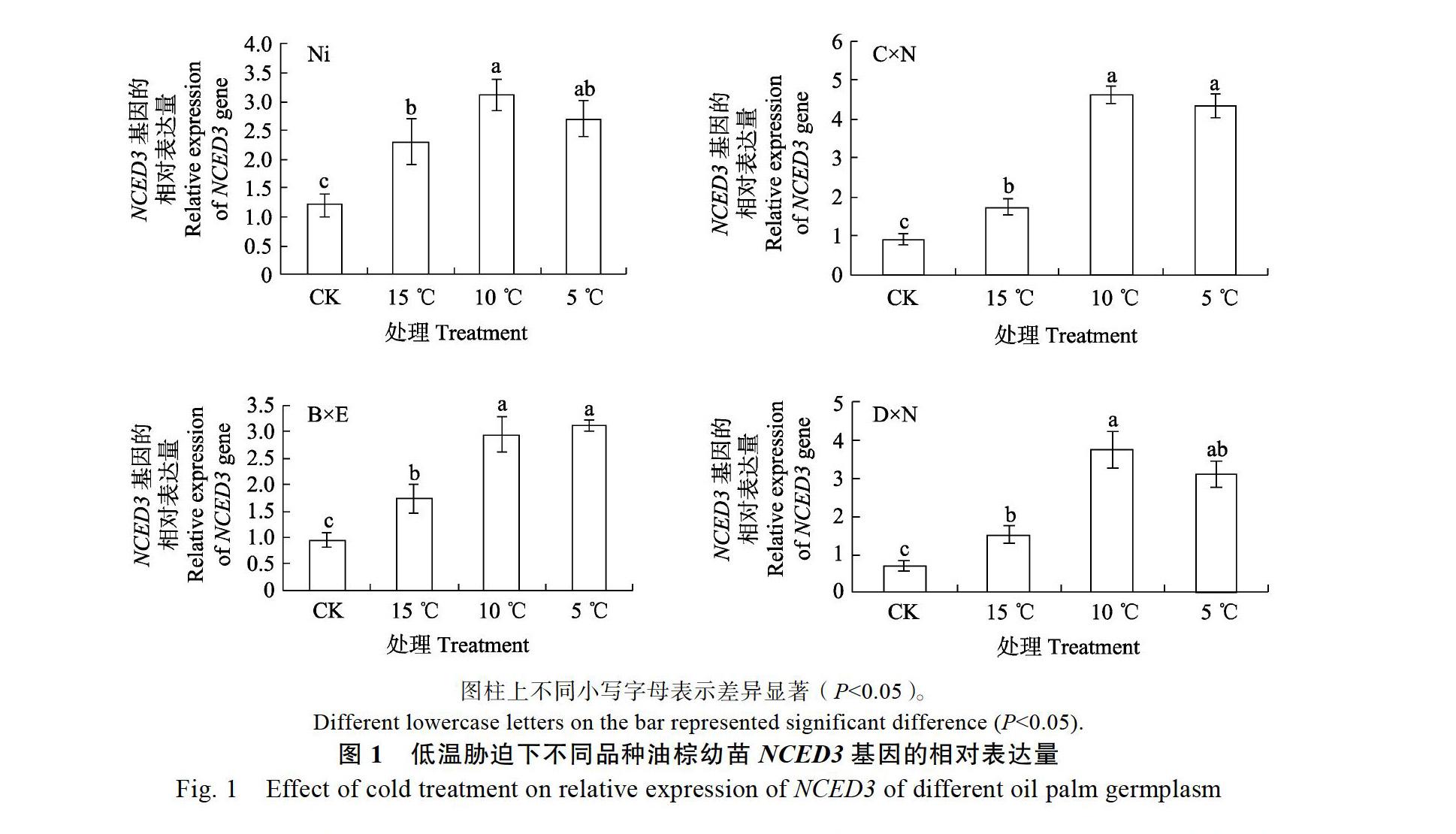
由图1可知,10 ℃以上低温胁迫下,4种油棕幼苗ABA合成酶基因NCED3相对表达量的变化趋势基本一致,即随着温度的降低其相对表达量逐渐上升。Ni、C×N和D×N都在10 ℃处理达到最大值,仅B×E在5 ℃处理相对表达量上升至最大值,其他品种均在5 ℃处理相对表达量略下降。在10 ℃处理下,Ni、C×N、B×E、D×N材料的NCED3相對表达量与CK相比分别显著地增长了158.33%、406.59%、207.29%、438.57%,10 ℃胁迫处理4种油棕幼苗体内ABA合成酶基因表达较为强烈。所以下一步不同浓度ABA处理的低温胁迫温度设定为10 ℃。
2.2 ABA对低温胁迫4个油棕品种生长指标的影响
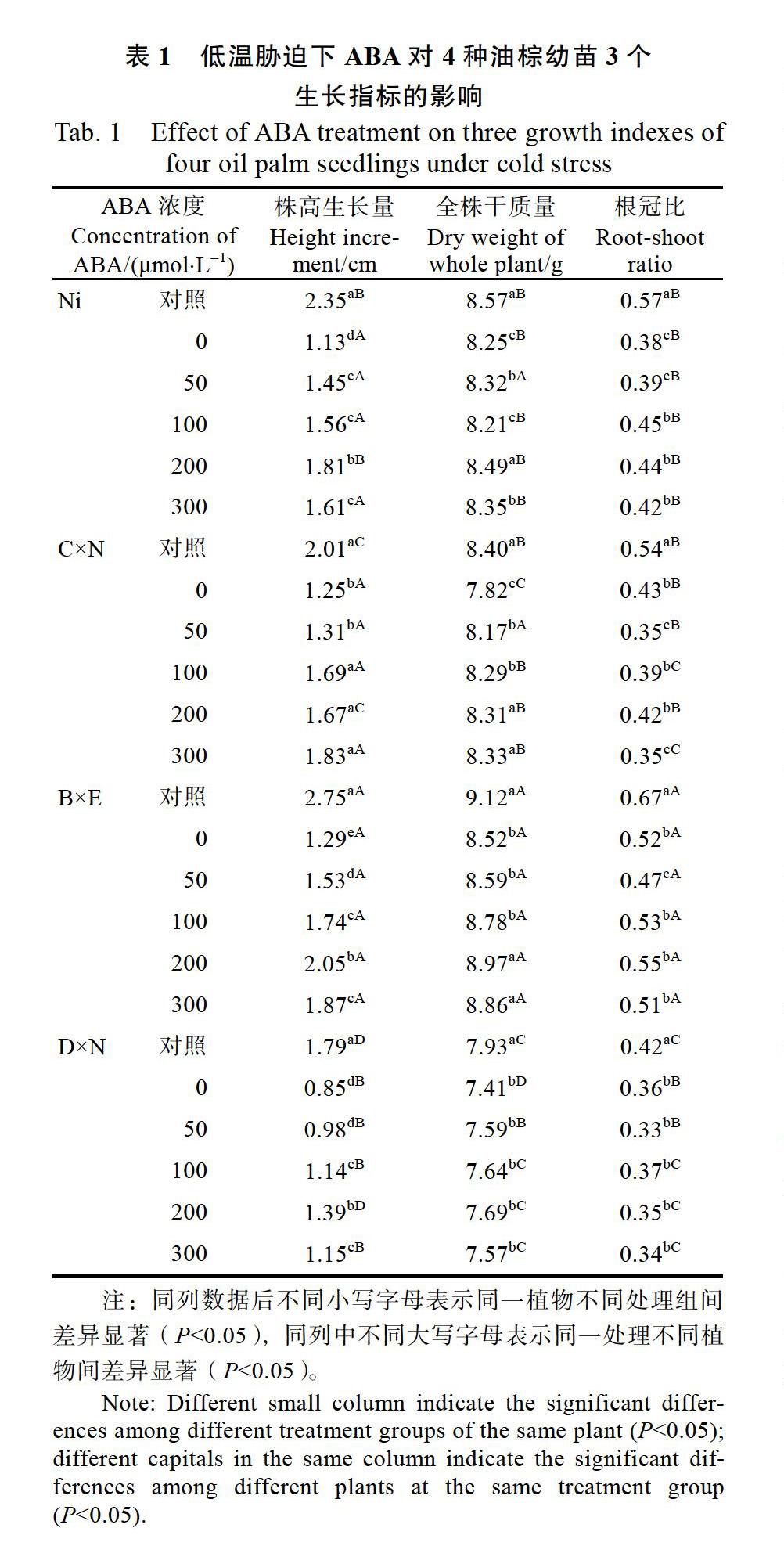
由表1可知,在10 ℃低温胁迫下,4种油棕幼苗的株高生长量和全株干质量总体上小于对照,喷施不同浓度ABA后4种油棕幼苗的株高生长量均随着ABA浓度的提高而增长,其中Ni、B×E和D×N的株高生长量显著高于0 μmol/L ABA处理的,C×N的株高生长量仅在100~300 μmol/L ABA处理下显著高于0 μmol/L ABA处理的;不同浓度ABA处理对4种油棕幼苗全株干质量的影响不同,其中C×N的全株干质量显著高于0 μmol/L ABA处理的,300 μmol/L ABA处理的最大,上升了6.52%,Ni、B×E和D×N的全株干质量均在200 μmol/L ABA最大;10 ℃低温胁迫下,4种油棕幼苗的根冠比总体上显著小于对照。Ni在100~300 μmol/L ABA处理的根冠比显著高于0 μmol/L ABA处理。
由表1还可以看出,同一浓度ABA处理下,B×E的株高生长量、全株干质量和根冠比总体上显著高于其他3个品种。
2.3 ABA对低温胁迫4个品种油棕幼苗生理指标的影响
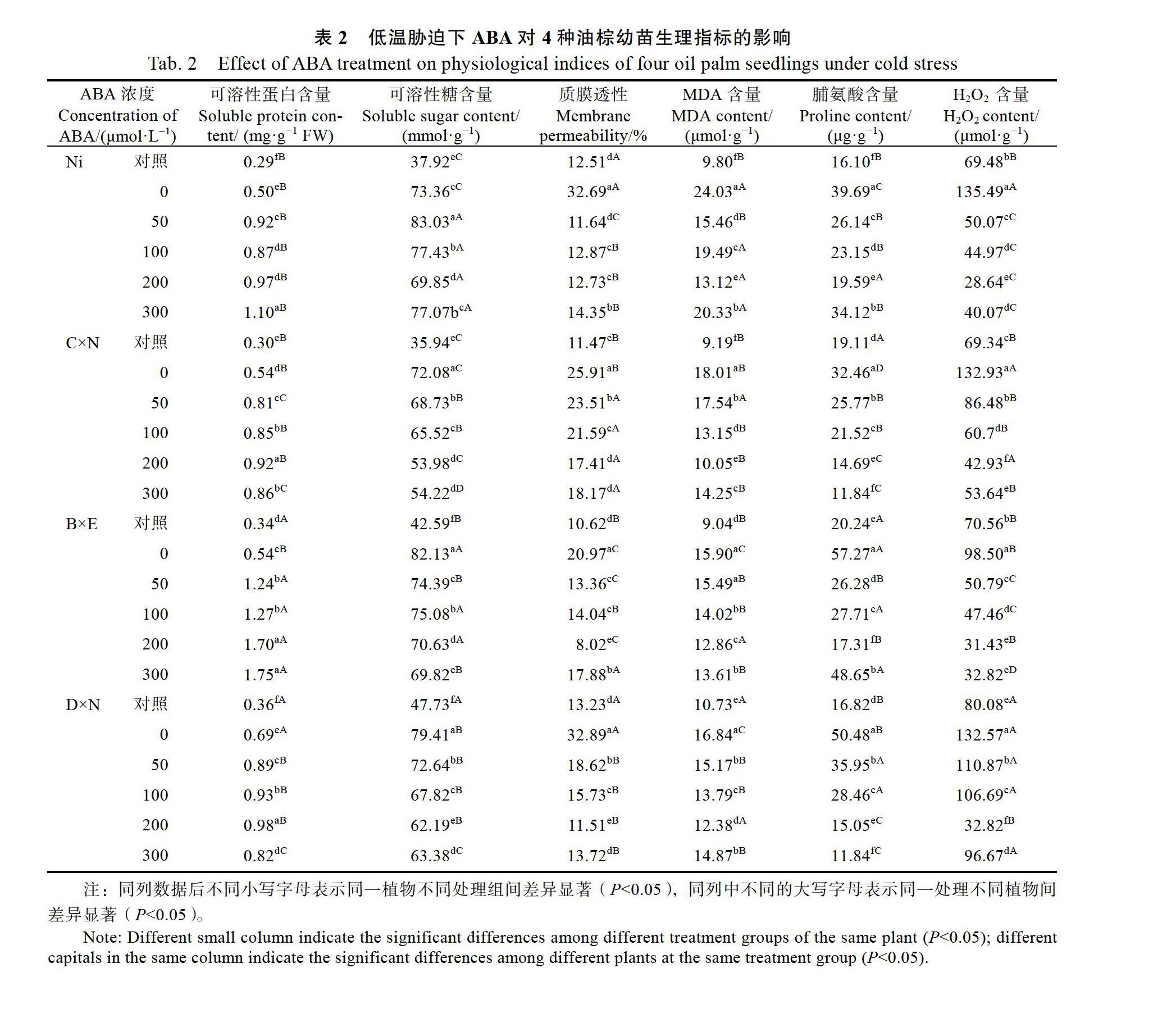
由表2可知,与对照相比,低温胁迫处理4种油棕的各生理指标均受到不同程度的影响。其中,10 ℃低温胁迫,0 μmol/L ABA处理下Ni叶片的生理指标均高于对照,叶片中的可溶性蛋白、可溶性糖及脯氨酸含量升高,进而提高其抗寒能力;不同浓度ABA处理的Ni叶片可溶性蛋白含量显著高于0 μmol/L ABA处理(P<0.05),其中300 μmol/L ABA处理的最大,提高了120%。与喷施0 μmol/L ABA处理相比,50 μmol/L ABA处理的Ni叶片可溶性糖含量最高,而100、200、300 μmol/L ABA处理的可溶性糖含量显著降低,200 μmol/L ABA处理的含量最低,降低了4.78%;与喷施0 μmol/L ABA处理相比,200 μmol/L ABA处理的脯氨酸含量显著降低,减少了50.64%;不同浓度的ABA处理的Ni质膜透性及H2O2含量均低于0 μmol/L ABA处理,其中200 μmol/L ABA处理的最低,说明200 μmol/L ABA处理的Ni较耐寒;50、100、200、300 μmol/L ABA处理的Ni MDA含量比0 μmol/L ABA处理分别下降了35.66%、18.89%、45.4%、15.39%。
10 ℃低温胁迫,0 μmol/L ABA处理下C×N叶片的生理指标均高于对照;不同浓度ABA处理的C×N叶片可溶性蛋白含量显著高于0 μmol/L ABA处理,其中200 μmol/L ABA处理的最大,提高了70.37%;不同浓度ABA处理的C×N叶片可溶性糖含量与0 μmol/L ABA处理相比降低,与对照处理相比含量升高;与喷施0 μmol/L ABA处理相比,300 μmol/L ABA处理的C×N脯氨酸含量显著最低,减少了63.52%;不同浓度的ABA处理的C×N质膜透性及H2O2含量均低于0 μmol/L ABA处理,其中200 μmol/L ABA处理的最低;50、100、200、300 μmol/L ABA处理的C×N MDA含量比0 μmol/L ABA处理分别下降了2.61%、26.98%、44.2%、20.88%。
不同浓度ABA处理的B×E叶片可溶性蛋白含量显著高于0 μmol/L ABA处理的,其中200、300 μmol/L ABA处理的明显升高,分别提高了214.81%、224.07%;不同浓度ABA处理的B×E可溶性糖含量明显降低,与0 μmol/L ABA处理相比,其中300 μmol/L ABA降低程度最大,降低了14.98%;与喷施0 μmol/L ABA处理相比,不同浓度ABA处理的B×E脯氨酸含量呈先降低再升高的趋势;不同浓度的ABA处理的质膜透性及H2O2含量均低于0 μmol/L ABA处理,其中200 μmol/L ABA处理的质膜透性及H2O2含量最低,说明200 μmol/L ABA处理的B×E较耐寒;50、100、200、300 μmol/L ABA处理的MDA含量比0 μmol/L ABA处理分别下降了2.57%、11.82%、19.12%、14.4%。
不同浓度ABA处理的D×N叶片可溶性蛋白含量显著高于0 μmol/L ABA处理,其中200 μmol/L ABA处理的最大,提高了42.02%;与喷施0 μmol/L ABA处理相比,100、200、300 μmol/L ABA处理的D×N可溶性糖含量显著降低,200 μmol/L ABA处理的含量最低,降低了21.68%;与喷施0 μmol/L ABA处理相比,300 μmol/L ABA处理的脯氨酸含量显著降低,减少了76.54%;不同浓度的ABA处理的质膜透性及H2O2含量均低于0 μmol/L ABA处理,其中200 μmol/L ABA处理的质膜透性及H2O2含量最低;50、100、200、300 μmol/L ABA处理D×N的MDA含量比0 μmol/L ABA处理分别下降了9.92%、18.11%、26.48%、11.69%。
由表2还可以看出,在4个品种中,0 μmol/L ABA处理的B×E在可溶性蛋白含量、可溶性糖、脯氨酸含量高于或者显著高于其他3个品种,而质膜透性、MDA含量和H2O2含量显著低于其他3个品种;50~300 μmol/L ABA处理的B×E可溶性蛋白含量显著高于其他3个品种,50~300 μmol/L ABA处理的Ni可溶性糖含量显著高于其他3个品种;50~200 μmol/L ABA处理的B×N质膜透性显著低于其他3个品种的;100~300 μmol/L ABA处理的Ni MDA均高于其他3个品种;50~ 300 μmol/L ABA处理C×N脯氨酸含量明显低于其他3个品种,而在300 μmol/LABA处理B×E的脯氨酸含量最高,与其他3个品种相比较;50~ 200 μmol/L ABA处理Ni的H2O2含量显著低于其他3个品种,300 μmol/L ABA处理B×E的H2O2含量最低。
2.4 ABA对低温胁迫4个品种油棕幼苗SOD和POD活性的影响
从表3可以看出,4种油棕单独低温处理的SOD活性最大,低温胁迫后各浓度ABA处理的SOD活性均呈下降趋势。50、100、200、300 μmol/L ABA处理下SOD差异不大说明ABA对不同品种油棕叶片SOD活性变化不明显。从表3可以看出,0 μmol/L ABA处理的4种油棕叶片POD活性显著低于对照,Ni、C×N、B×E和D×N与对照相比分别降低了43.32%、32.25%、36.21%和43.93%。而50 μmol/L ABA处理的POD活性与0 μmol/L ABA處理相比明显上升,分别升高了44.17%、5.69%、31.64%和43.53%。100 μmol/L ABA处理的除了B×E外其他的POD活性与0 μmol/L ABA处理的相比变化不明显,而B×E的POD活性与0 μmol/L ABA处理相比显著上升,提高了51.88%。200 μmol/L ABA处理的各品种POD活性与50 μmol/L ABA处理的相比变化不明显。300 μmol/L ABA处理的4种油棕幼苗POD活性与0 μmol/L ABA处理相比,除C×N外其他明显上升,其中Ni提高了61.11%。说明喷施一定浓度ABA可提高4种油棕叶片的POD活性,进而减少低温胁迫产生H2O2,降低氧化伤害。
由表3还可以看出,在50~300 μmol/L ABA处理下,C×N和D×N的SOD活性均显著高于Ni和B×E;在50~300 μmol/L ABA处理下,B×E的POD活性高于或者显著高于其他3品种(300 μmol/L ABA处理下的Ni除外)。
3 讨论
ABA是植物低温逆境下的重要信号因子,低温胁迫下,ABA与其受体蛋白的结合能力增强,进而感知和传递低温胁迫信号,对植物体内各物质的平衡调控和对胁迫抗性的诱导等方面起到关键作用[5]。低温胁迫下,4种油棕幼苗ABA合成酶基因NCED3相对表达量均随着温度的降低其相对表达量逐渐上升,在10 ℃胁迫处理4种油棕幼苗体内ABA合成酶基因均强烈表达,说明低温胁迫可触发4种油棕幼苗ABA合成酶基因NCED3的过量表达,也说明ABA参与油棕幼苗响应低温胁迫以此来维持正常的生长发育。
10 ℃低温胁迫,4种油棕幼苗的株高生长量、全株干质量和根冠比均下降,说明低温限制了不同品种油棕幼苗的生长。而外施不同浓度ABA后3个生长指标均随着ABA浓度的提高而升高,说明低温胁迫下,ABA对油棕幼苗生长有一定的促进作用。
可溶性蛋白和可溶性糖是细胞内渗透调节物质,能够增加细胞渗透性,提高植物的耐寒能力。本研究结果表明,不同浓度ABA处理能明显提高4种油棕体内可溶性蛋白含量;与低温对照相比,可溶性糖含量呈下降趋势,但均比对照处理高,这与苗永美等[17]对甜瓜的研究结果不一致。低温胁迫通过氧化伤害进而破坏细胞膜,导致质膜透性增大。本研究结果表明,与低温对照相比,不同浓度ABA处理的4种油棕的质膜透性显著降低,说明外施ABA可缓解4种油棕由低温引起的叶片质膜透性增加;H2O2作为植物细胞代谢的氧化产物,可导致细胞膜发生膜脂过氧化,影响植物的正常生长[18]。本研究发现,外施不同浓度ABA可显著降低4种油棕幼苗的H2O2含量,其中200 μmol/L ABA处理幼苗的H2O2含量最低,说明外源ABA能缓解低温胁迫对4种油棕幼苗诱发的氧化伤害。
MDA作为膜脂过氧化的终产物之一,它通过膜脂过氧化,损害细胞膜原有结构和功能,从而改变其生理功能和活性,进一步影响其他生理代谢的进行[19],植物在胁迫条件下,MDA含量有升高趋势,但是随着胁迫时间的延长和胁迫程度的加深,其含量有下降趋势[20]。有研究表明,ABA是通过保护膜结构,维持膜功能和诱导抗寒基因表达而增强植物抗冷性[21]。本研究中低温胁迫后4种油棕幼苗叶片MDA含量明显升高,外施不同浓度ABA均可降低幼苗叶片MDA含量,其中200 μmol/L ABA处理的MDA含量均最低。
脯氨酸广泛存在于植物体内,主要是作为渗透调节物质、蛋白质分子的保护物质以及活性氧的清除剂等发挥作用,从而起到抗寒作用。研究认为,低温胁迫下脯氨酸的累积能力与品种的抗寒能力呈正相关[22-23]。也有研究认为,抗寒性弱的品种在低温条件下,为保护体内组织免受冷害,积累了大量的游离脯氨酸,而游离脯氨酸累积高峰出现晚的品种,表明其适应性较强。本研究发现,低温胁迫下,C×N和D×N随外源ABA浓度增大,脯氨酸的含量明显减少;Ni和B×E的脯氨酸含量在ABA浓度较低时也明显减少,但在300 μmol/L ABA处理的脯氨酸含量明显增加,分别与低温对照相比仅降低14.03%和15.05%,说明低温胁迫下,外施ABA能减少4种油棕脯氨酸含量的累积。这与罗立津等[24]对甜椒、黄宇等[25]对雷公藤的研究结果不一致,也与刘艳菊等[11]对油棕本地种的研究结果不一致。因此油棕在低溫下的脯氨酸累积能力与抗寒性的关系还有待进一步试验验证。
SOD、POD在植物体内活性氧清除过程中起重要作用[26]。本研究发现,单独低温处理的4种油棕幼苗叶片SOD活性上升,而外施不同浓度ABA后降低了SOD活性,减少了超氧阴离子自由基向H2O2的转化,这与方仁等[27]对香蕉幼苗、刘艳菊等[11]对油棕本地种的研究结果一致。单独低温胁迫的4种油棕幼苗叶片POD与CK相比明显下降,而外施一定浓度ABA能提高4种油棕幼苗叶片POD活性,其中B×E的POD活性随ABA浓度增加呈先增加后下降的趋势。
同时,在4个品种中,0 μmol/L ABA处理的B×E在可溶性蛋白含量、可溶性糖、脯氨酸含量高于或者显著高于其他3个品种,而质膜透性、MDA含量和H2O2含量显著低于其他3个品种;50~300 μmol/L ABA处理的B×E可溶性蛋白含量和POD活性显著高于其他3个品种;说明在4个品种中,B×E耐寒性较强。不同浓度ABA处理的油棕幼苗内源ABA如何变化及ABA合成酶基因NCED3表达情况还需进一步试验研究。
综上所述,低温胁迫可触发4种油棕幼苗ABA合成酶基因NCED3的过量表达,并通过10 ℃低温胁迫下对其外施ABA(50~300 μmol/L ABA)发现,ABA通过降低幼苗质膜透性和SOD酶活性,抑制MDA和H2O2含量上升,缓解低温胁迫引起的膜脂过氧化,提高可溶性蛋白、可溶性糖含量和POD活性,进而提高油棕幼苗抗寒性。在4个品种中,B×E耐寒性较强。
参考文献
[1] Sue T T, Pantzaris T P. Pocketbook of palm oil uses[M]. 6th Edition, Malaysia Palm Oil Board (MPOB), 2010: 3-7.
[2] 曹建华, 李 静, 陶忠良, 等. 油棕幼苗对低温胁迫的生理响应及其抗寒力评价[J]. 热带农业科学, 2014, 34(8): 8-12.
[3] 刘艳菊, 曹红星, 张如莲. 不同时间下低温胁迫对油棕幼苗生理生化变化的影响[J]. 植物研究, 2015, 35(6): 860-865.
[4] 曹红星, 张骥昌, 雷新涛, 等. 不同油棕资源对低温胁迫的生理生化响应[J]. 云南农业大学学报(自然科学版), 2017, 32(2): 316-321.
[5] 李冬梅, 韩小强, 于俊华, 等. 外源脱落酸缓解低温胁迫研究进展[J]. 现代农药, 2016, 15(4): 1-5.
[6] Jiang M Y, Zhang J H. Involvement of plasma-membrane NADPH oxidase in abscisic acid and water stress-induced antioxidant defense in leaves of maize seedlings[J]. Planta, 2002, 215(6): 1022-1030.
[7] Guy C L. Cold Acclimation and freezing stress tolerance: role of protein metabolism[J]. Annual Review of Plant Physiology, 1990, 41: 187-223.
[8] Lee H G, Seo P J. The MYB96-HHP module integrates cold and abscisic acid signaling to activate the CBF-COR pathway inArabidopsis[J]. The Plant Journal, 2015, 82(6): 962-977.
[9] 牛志强, 刘国顺, 师婷婷, 等. 烟草NCED3基因的克隆及其干旱胁迫表达分析[J]. 中国烟草学报, 2015, 21(3): 100-106.
[10] 贾娟娟, 孟秀萍, 刘 蕊, 等. 拟南芥NCED3基因在水稻中的过量表达可以提高水稻的干旱胁迫耐受性[J]. 复旦学报(自然科学版), 2008(3): 288-294.
[11] 刘艳菊, 林以运, 曹红星, 等. 外源ABA对低温胁迫油棕幼苗生理的影响[J]. 南方农业学报, 2016, 47(7): 1171- 1175.
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[13] Patterson B D, Macrae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J]. Analytical Biochemistry, 1984, 139(2): 487-492.
[14] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003.
[15] 白寶璋. 植物生理学测试技术[M]. 北京: 中国科学技术出版社, 1993.
[16] 郭海林, 刘建秀, 朱雪花, 等. 结缕草属杂交后代抗寒性评价[J]. 草地学报, 2006(1): 24-28.
[17] 苗永美, 王万洋, 杨海林, 等. 外源Ca2+、SA和ABA缓解甜瓜低温胁迫伤害的生理作用[J]. 南京农业大学学报, 2013, 36(4): 25-29.
[18] Low P S, Merida J R. The oxidative burst in plant defense: function and signal transduction[J]. Physiologia Plantarum, 1996, 96(3): 533-542.
[19] 宋广树, 孙忠富, 孙 蕾, 等. 东北中部地区水稻不同生育时期低温处理下生理变化及耐冷性比较[J]. 生态学报, 2011, 31(13): 3788-3795.
[20] 孔广红, 岳 海, 陈丽兰, 等. 低温胁迫下澳洲坚果幼苗的某些生理生化特征[J]. 西南农业学报, 2010, 23(2): 375-378.
[21] 郭凤领, 卢育华, 李宝光. 外源ABA对番茄苗期和开花期抗冷特性的影响[J]. 山东农业大学学报(自然科学版), 2000(4): 357-362.
[22] 陈 璇, 李金耀, 马 纪, 等. 低温胁迫对春小麦和冬小麦叶片游离脯氨酸含量变化的影响[J]. 新疆农业科学, 2007(5): 553-556, 544.
[23] 张成军, 李 捷, 范惠萍, 等. 不同杏品种幼果抗寒性研究[J]. 西北林学院学报, 2008(3): 29-32.
[24] 罗立津, 徐福乐, 翁华钦, 等. 脱落酸对甜椒幼苗抗寒性的诱导效应及其机理研究[J]. 西北植物学报, 2011, 31(1): 94-100.
[25] 黄 宇, 王 倩, 毕 旸, 等. 外源ABA对低温下雷公藤幼苗的生理响应[J]. 福建林学院学报, 2011, 31(3): 198- 202.
[26] 杨舒贻, 陈晓阳, 惠文凯, 等. 逆境胁迫下植物抗氧化酶系统响应研究进展[J]. 福建农林大学学报(自然科学版), 2016, 45(5): 481-489.
[27] 方 仁, 龙 兴, 邓 彪, 等. 脱落酸对低温胁迫后香蕉幼苗恢复生长的影响[J]. 湖北农业科学, 2014, 53(20): 4878-4881.

