短期生物炭刺激对红壤和潮土微生物群落的影响
方明 李洁 赖欣


摘要:通过施用不同质量比的生物炭(0.5%、1.0%、2.0%、4.0%),研究生物炭施用对红壤和潮土微生物群落结构的影响。通过土柱培养试验,采用磷脂脂肪酸法测定不同处理土壤微生物的群落结构。添加1.0%、2.0%、4.0%生物炭处理与添加05%生物炭处理相比,潮土细菌PLFAs含量增加了9.5%~56.7%;添加0.5%和1.0%生物炭细菌的磷脂脂肪酸(PLFAs)含量分别显著降低了33.7%、27.3%;添加0.5%、2.0%、4.0%生物炭处理的革兰氏阴性细菌PLFAs的含量与单施氮肥处理相比显著下降了276%~48.8%,生物炭施用对真菌、放线菌、革兰氏阳性细菌、真菌PLFAs含量和细菌PLFAs含量的比值(真/细)和总PLFAs含量总体没有显著影响。生物炭施用对红壤的微生物PLFAs含量没有显著影响。在添加生物炭的处理中,生物炭施用量的增加使饱和脂肪酸含量/不饱和脂肪酸含量有降低的趋势。通过比值分析、多样性分析和主成分分析可知,短期生物炭刺激对红壤和潮土的微生物群落结构没有显著影響,2种土壤微生物生态位未产生分化。
关键词:生物炭;红壤;潮土;土壤微生物;PLFAs;群落结构;主成分分析
中图分类号: S154.1 文献标志码: A 文章编号:1002-1302(2020)11-0250-09
收稿日期:2019-07-08
基金项目:中国农业科学院科技创新工程。
作者简介:方 明(1992—),男,黑龙江佳木斯人,硕士,主要从事生物炭对土壤碳氮养分循环影响的研究。E-mail:fangmingzhxy@163.com。
通信作者:张贵龙,博士,副研究员,主要从事土壤碳氮循环研究,E-mail:zhangguilong@caas.cn;姜淑苓,硕士,研究员,主要从事果树学研究,E-mail:jshuling@163.com。 菜地土壤的氮肥施用量大,大量的氮素盈余造成了地下水污染、土壤酸化、温室气体大量排放等严重的环境问题[1]。生物炭作为一种性质稳定的生物质材料,其比表面积和孔隙度较大,含碳量较高,这些性质决定了生物炭具有较高的吸附性、稳定性和养分含量[2]。生物炭能够提高土壤pH值、土壤的透气透水性以及固持土壤中的养分等,减少氮素流失,提高作物的氮素利用效率。土壤微生物作为土壤生态系统中的重要组成部分,是土壤氮素循环和转化的重要驱动力,通过分析土壤微生物的变化情况来探讨生物炭对土壤生态系统的作用,是研究生物炭施用益处和风险的途径之一。
有研究表明,向土壤中添加生物炭后,能够改变土壤细菌、真菌和古菌的群落组成[3-4],向黑土中添加生物炭后,土壤细菌阿尔法多样性(alpha diversity)增加[5]。姚钦利用变性梯度凝胶电泳(DGGE)法分析了亚马逊黑土和未改造土壤的细菌和古菌的群落结构,结果表明,富含生物炭的亚马逊黑土土壤细菌和古菌的群落结构与相邻未改造土存在显著差异[6]。PLFAs是细胞膜上的磷脂脂肪酸,其种类的不同可以标记出不同的微生物类群,被广泛应用在土壤微生物学研究中。Bamminger等通过37 d的培养试验发现,添加生物炭能显著提高微生物PLFAs总含量以及细菌类和真菌类PLFAs含量[7]。Steinbeiss等利用磷脂脂肪酸(PLFA)法分析了生物炭施用对土壤4类主要微生物的影响,发现源自酵母的生物炭会促进真菌的生长,而源于葡萄糖的生物炭主要促进革兰氏阴性细菌的生长[8]。土壤类型影响着生物炭的作用效果[9]。Abujabhah等发现,桉树生物炭对土壤微生物群落和氮循环细菌的影响主要取决于土壤类型,其中对红壤和黑土的作用明显高于棕壤[10]。Liu等施用了0~40 t/hm2 的稻壳生物炭(400 ℃)于红壤、棕壤和盐渍土中,结果发现,生物炭对红壤细菌群落的改变最为显著[11]。武爱莲等发现,随着生物炭施用量的增加,土壤细菌的操作分类单元(OTU)数目及丰富度指数(Chao1)呈增加趋势[12]。顾美英等发现,不同的生物炭用量对不同土壤微生物的影响不同[13]。生物炭对土壤微生物量、微生物群落结构的影响差异较大,这种差异可能与生物炭用量、类型以及土壤类型等有关。
多数研究结果表明,生物炭对红壤有改良效果[14-15],但缺少关于生物炭对红壤和潮土作用的对比研究。红壤和潮土为我国2类分布广泛、性质相反的土壤,对比分析生物炭对2类土壤微生物群落的作用,对于阐明生物炭对土壤微生物群落结构的影响,指导生物炭在农田中的应用具有重要的意义。因此,本试验采用在500 ℃厌氧条件下制备的花生壳生物炭,设置生物炭和菜地土壤质量比分别为0.5%、1%、2%、4%,通过培养试验和PLFA法,以2种土壤的PLFAs含量表征土壤微生物群落结构,分析不同施炭量对红壤和潮土微生物群落结构特征的影响。
1 材料与方法
1.1 供试材料
潮土采集地点为天津市武清区梅厂镇周庄村(39°36′N,117°13′E),红壤采集地点为湖南省长沙市长沙县金井镇脱甲村(28°25′N,113°21′E)。供试花生壳生物炭由河南三利新能源有限公司提供,为在500 ℃厌氧条件下热解制备的生物炭。供试土壤的基本理化性质如表1所示。供试生物炭基本理化性质如下:pH值为9.71,比表面积为5.38 m2/g,孔容为0.01 cm3/g,孔径为5.81 mm,灰分含量为333%,碳、氢、氮、氧含量分别为719.26、20.51、17.63、90.22 g/kg。施用生物炭对土壤理化性质的影响见参考文献[16]。
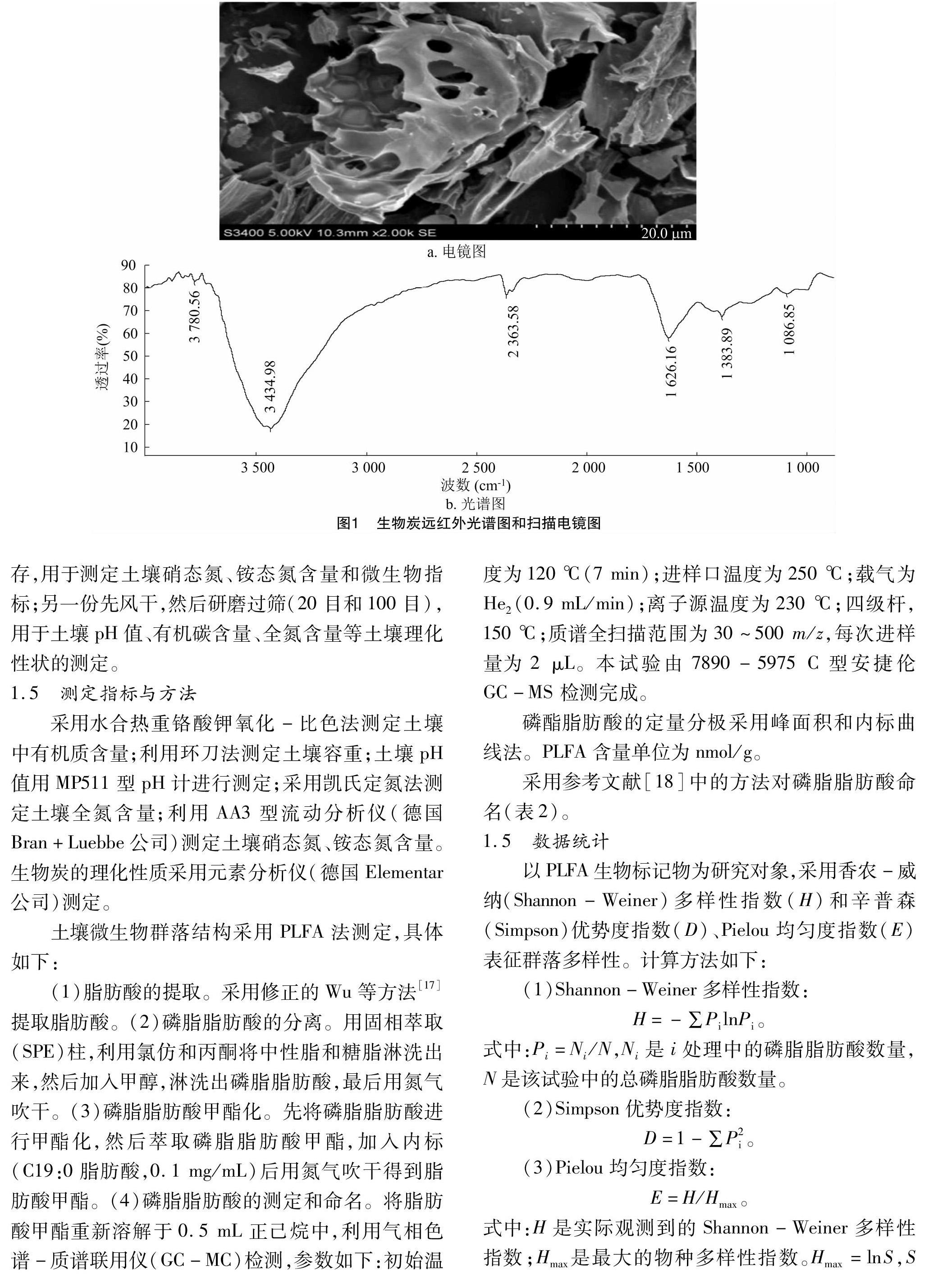
1.2 生物炭表面特征
通过对生物炭进行电镜扫描和能谱分析可以看出,生物炭中含有大量的孔隙结构(图1),这是生物炭表现出各种功能的重要结构原因。由傅里叶变换红外光谱仪(FTIR)图谱可以得出,波数为 3 700 cm-1 左右的吸收峰由羟基(—OH)引起, 3 400 cm-1 左右的吸收峰由—CH2和—CH3的伸缩振动引起,2 300 cm-1、1 600 cm-1和 1 000 cm-1 左右的吸收峰分别是由烯烃(炔烃)、芳香环和醇类基团引起的,说明生物炭中含有该类功能基团。
1.3 试验设计
采用土柱培養试验,每种土壤各设计6个处理,其中包括空白对照处理(CK),单独添加氮肥处理(N),生物炭与土壤的质量比为0.5%(B1)、1%(B2)、2%(B3)、4%(B4)处理,则红壤(R)各处理依次表示为RCK、RN、RB1N、RB2N,RB3N、RB4N;潮土(M)各处理依次表示为MCK、MN、MB1N、MB2N、MB3N、MB4N,每个处理设3次重复。土柱装置为直径 21 cm,高度45 cm的不锈钢圆柱管。试验于2017年3月开始进行,将不同比例生物炭均匀施入到过5 mm筛的土壤中,将土壤与生物炭按质量比充分混匀后慢慢压实装入土柱装置中[14]。每个土柱内装填的生物炭和土壤总质量均为12 kg,不添加生物炭与添加4%生物炭处理高度相差不超过2 cm。培养期间种植小白菜,每个处理种植5颗小白菜,同年6月底收获。土壤培养和小白菜种植方法参考文献[16]。
1.4 样品采集
试验结束后,采集土柱中0~20 cm耕层土壤,土样采集后分成 2 份,一份于-20 ℃ 冰箱鲜样保
存,用于测定土壤硝态氮、铵态氮含量和微生物指标;另一份先风干,然后研磨过筛(20目和100目),用于土壤pH值、有机碳含量、全氮含量等土壤理化性状的测定。
1.5 测定指标与方法
采用水合热重铬酸钾氧化-比色法测定土壤中有机质含量;利用环刀法测定土壤容重;土壤pH值用MP511型pH计进行测定;采用凯氏定氮法测定土壤全氮含量;利用AA3型流动分析仪(德国Bran+Luebbe公司)测定土壤硝态氮、铵态氮含量。生物炭的理化性质采用元素分析仪(德国Elementar公司)测定。
土壤微生物群落结构采用PLFA法测定,具体如下:
(1)脂肪酸的提取。采用修正的Wu等方法[17]提取脂肪酸。(2)磷脂脂肪酸的分离。用固相萃取(SPE)柱,利用氯仿和丙酮将中性脂和糖脂淋洗出来,然后加入甲醇,淋洗出磷脂脂肪酸,最后用氮气吹干。(3)磷脂脂肪酸甲酯化。先将磷脂脂肪酸进行甲酯化,然后萃取磷脂脂肪酸甲酯,加入内标(C19:0脂肪酸,0.1 mg/mL)后用氮气吹干得到脂肪酸甲酯。(4)磷脂脂肪酸的测定和命名。将脂肪酸甲酯重新溶解于0.5 mL正己烷中,利用气相色谱-质谱联用仪(GC-MC)检测,参数如下:初始温度为120 ℃(7 min);进样口温度为250 ℃;载气为He2(0.9 mL/min);离子源温度为230 ℃;四级杆,150 ℃;质谱全扫描范围为30~500 m/z,每次进样量为2 μL。本试验由7890-5975 C型安捷伦 GC-MS 检测完成。
磷酯脂肪酸的定量分极采用峰面积和内标曲线法。PLFA含量单位为nmol/g。
采用参考文献[18]中的方法对磷脂脂肪酸命名(表2)。
1.5 数据统计
以PLFA生物标记物为研究对象,采用香农-威纳(Shannon-Weiner)多样性指数(H)和辛普森(Simpson)优势度指数(D)、Pielou均匀度指数(E)表征群落多样性。计算方法如下:
式中:Pi=Ni/N,Ni是i处理中的磷脂脂肪酸数量,N是该试验中的总磷脂脂肪酸数量。
(3)Pielou均匀度指数:
式中:H是实际观测到的Shannon-Weiner多样性指数;Hmax是最大的物种多样性指数。Hmax=lnS,S
冗余分析采用Canoco for Windows 4.5软件;利用Excel 2007对数据进行处理以及图表的绘制,SPSS 17.0软件对试验数据进行单因子方差分析,Duncans多重比较对处理进行相关性分析。
2 结果与分析
2.1 生物炭对土壤微生物群落结构的影响
由图2可知,在添加生物炭的处理中,潮土中的细菌PLFAs含量随着生物炭添加量的增加明显升高,其他添加生物炭处理与B1N相比升高了9.5%~567%;与单施氮肥相比,添加0.5%和1.0%生物炭处理的细菌PLFAs含量分别显著降低了33.7%、273%。添加0.5%、2.0%、4.0%生物炭处理的潮土中革兰氏阴性细菌PLFAs含量与单施氮肥处理相比显著下降了276%~48.8%。总体来看,生物炭施用对潮土真菌、放线菌、革兰氏阳性细菌和总PLFAs含量的影响总体不显著。生物炭施用没有对红壤的微生物PLFAs含量产生显著的影响。
2.2 生物炭施用对2种土壤微生物PLFAs比值的影响
如图3-a所示,与单施氮肥相比,添加0.5%、10%、2.0%生物炭处理的潮土中环丙烷脂肪酸含量/前体脂肪酸含量分别显著降低了52.8%、382%、50.7%,添加1.0%生物炭处理的红壤中环丙烷脂肪酸含量/前体脂肪酸含量显著增加412%。与未添加生物炭相比,生物炭添加总体上未对红壤和潮土中饱和脂肪酸含量/不饱和脂肪酸含量产生明显影响。但由图3-b可以看出,在添加生物炭的处理中,随着生物炭添加量的增加,饱和脂肪酸含量/不饱和脂肪酸含量有下降趋势。
真菌PLFAs和细菌PLFAs含量的比值(真/细)可以反映土壤微生物生态系统的相对稳定性,而革兰氏阳性细菌和阴性细菌的比例可以反映土壤的贫瘠程度,更高比例的革兰氏阴性细菌意味着土壤趋向于富养型土壤转变。图3-c、3-d反映了生物炭添加对真/细和革兰氏阳性细菌PLFAs含量/革兰氏阴性细菌PLFAs含量的影响,与对照相比,添加生物炭对真/细没有明显影响,但与单施氮肥相比,潮土和红壤中G+/G-发生了明显变化,潮土G+/G-明显增加了13.7%~109.8%,其中添加05%生物炭处理(MB1N)的G+/G-最高。对于红壤中G+/G-,与单施氮肥处理相比,添加2.0%(RB3N)和4.0%生物炭处理(RB4N)分别明显降低了48.2%和34.8%。
通过分析微生物群落多样性的3個指数(香农-威纳多样性指数、辛普森优势度指数、Pielou均匀度指数)可知,大体上看,与未添加生物炭相比,生物炭施用对2种土壤微生物群落结构的多样性无明显影响(表4)。
2.3 2种土壤PLFAs主成分分析
图4表明,成分1和成分2分别解释了880%和5.8%的变异,生物炭施入没有使2类土壤PLFAs的组成产生明显的区别。
对土壤理化性质和土壤PLFAs含量进行冗余分析可知,成分1和成分2分别解释了 38.6%和22%的变异;其中,pH值对土壤微生物群落的影响较大,这与偏相关分析得出的结论一致,并且成分1
明显区分了潮土和红壤的微生物PLFAs含量,说明生物炭施用明显影响了潮土和红壤的微生物群落结构(图5)。
3 讨论
已有研究表明,施用生物炭能够引起土壤微生物群落结构变化,增加微生物量,促进微生物生长及活动[19]。在亚马逊黑色土壤及生物炭改良的土壤中,发现了土壤真菌、细菌和古菌群落组成和多样性发生了显著变化[20-21]。袁晶晶等研究表明,施用生物炭后,土壤细菌、真菌放线菌含量分别提高10.9%、6.6%、50.6%[22]。Jones等的研究也有类似的结果[3,23]。Anderson等通过短期和长期试验发现,生物炭对土壤的细菌群落结构无显著影响[24-25]。He等发现,在热解温度为500 ℃的条件下制德的稻壳生物炭不会对碱性土壤产生显著影响[26]。盖霞普等研究表明,生物炭未对中性水稻土的微生物群落结构产生影响[27]。这也表明了生物炭的施用效果会随土壤类型的不同而产生差异。本试验中发现,在添加生物炭的处理中,随生物炭施用量的增加,潮土中细菌的含量略有升高,但红壤未表现出明显的差异。生物炭本身携带养分并具有较大的孔隙度,这是影响土壤微生物群落结构的重要原因。生物炭施入土壤中能够改变土壤的养分含量、提高土壤pH值、吸附土壤中的有毒物质、为微生物提供了良好的栖息场所等[28-30]。Anderson等认为,作物对土壤系统的扰动比生物炭的影响更大,根系-土壤系统间的相互作用是短期生物炭刺激要考虑的重要因素[31],这也可能是本试验与前述研究结果不一致的原因。本试验的生物
炭施用时间较短,有研究者认为,长期添加生物炭和短期施用生物炭的土壤中微生物群落存在明显差异[9]。
生物炭改善土壤肥力和土壤生态环境机制多被解释为通过提高土壤pH值和吸附作用,改善土壤养分利用情况,同时改变土壤微生物群落组成及丰度[32],进而对土壤养分循环或理化性质产生作用,最终影响作物生长[33]。同时,程扬等通过高通量测序技术的研究结果表明,生物炭施加对土壤微生物群落代谢、遗传、信息传递等过程产生影响,从而改变微生物的群落结构及生态功能[34]。Wang等研究表明,潮土中添加生物炭后,土壤微生物群落的改变与土壤有机碳(SOC)、全氮(TN)含量的变化密切相关[35]。李明等的典范对应分析结果表明,水稻和玉米秸秆生物炭添加可以通过改变红壤水稻土壤性质,间接影响微生物群落结构,其中,土壤速效磷、有机碳、速效钾含量与土壤微生物群落分布显著相关[36]。Muhammad等对红壤的研究结果则表明,猪粪炭和果皮炭等主要通过增加土壤pH值、可溶性有机碳(DOC)含量和碳氮养分元素含量,改变微生物群落结构[37]。Yao等研究表明,向黑土添加生物炭后,土壤真菌和细菌群落的变化均与土壤pH值以及全碳、全氮、全钾含量紧密相关[38]。土壤容重的变化与土壤透气性、持水力和营养盐迁移等密切相关,绝大部分的土壤微生物属于好氧型,多属于腐生性微生物,疏松土壤环境为微生物提供了充足的氧气,生物炭的多孔性和表面特性为土壤微
生物生长与繁殖提供了良好的栖息环境[39],共同影响着土壤微生物群落的分布。
本试验通过3个方面来研究生物炭对土壤微生物群落结构的影响,一是土壤不同微生物的PLFAs比例,二是土壤微生物群落的多样性,三是土壤微生物的群落组成与主成分分析。
革兰氏阳性细菌可利用生物炭中的芳香族化合物,革兰氏阴性菌在生物炭中缺少容易利用的底物[40],但添加生物炭均能增加二者的丰度,如添加生物炭到温带农田土壤中可使革兰氏阳性细菌比例升高[41],在风积土、潮土和栗钙土中施用生物炭革兰氏阴性细菌比例均增加。细/真对土壤理化性质的改变极为敏感,通常用来表征在有环境胁迫的条件下,微生物群落结构的变化。一般认为,以真菌为主的微生物类群,能够增加土壤碳的稳定性。土壤真菌和细菌对生物炭输入的响应不同,Khadema等研究表明,在钙质沙土和黏土中施用生物炭能够降低真/细[42]。本试验发现,施用生物炭后,土壤真/细未发生明显变化。有研究认为,真菌对土壤pH值的适应范围比细菌宽,真菌数与土壤pH值相关性较小,主要受土壤有机碳含量的影响[43]。陈坤等研究表明,生物炭添加引起土壤pH值升高,细菌丰度增加,而真菌丰度变化并不明显[44],本试验的结论与之一致。饱和脂肪酸含量/不饱和脂肪酸含量常被用来指示土壤的透气性,饱和脂肪酸含量越高,代表着透气性越差,本试验中,在添加生物炭的处理中,随着生物炭施用量的增加,土壤的饱和脂肪酸/不饱和脂肪酸含量有下降的趋势,这也说明生物炭施用对于土壤透气性有改善的作用。
生物炭被认为是能够有效减少农田废弃物、改良土壤性质的材料,其在土壤生态、土壤修复、炭基肥料等中的应用得到了越来越多的重视[45-46]。目前关于生物炭对土壤微生物的研究多集中于微生物性质、微生物群落的分化上,为未来研究微生物群落的功能性奠定了基础,关于土壤酶与功能微生物的互作效应、土壤动物和生物炭材料等方面[47],有待进一步探讨。
4 结论
潮土中细菌PLFAs含量在添加生物炭的处理中随着生物炭添加量的增加而明显升高,其中B2N、B3N、B4N处理的PLFAs含量与B1N相比升高了95%~56.7%,与单施氮肥相比,添加0.5%和10%的生物炭处理的细菌的含量分别显著降低33.7%、27.3%;B1N、B3N、B4N处理的革兰氏阴性细菌含量与单施氮肥处理相比显著下降27.6%~48.8%,生物炭施用对真菌、放线菌、革兰氏阳性细菌、真/细和总PLFAs含量总体无显著影响。生物炭施用对红壤中微生物PLFAs含量无显著影响。
通过分析土壤不同微生物的PLFAs比例、土壤总PLFAs含量,研究土壤微生物群落多样性和土壤微生物的群落组成,采用主成分分析来研究2种土壤微生物群落结构的差异。结果表明,短期生物炭刺激土壤微生物的群落结构的改变不显著,生态位未发生明显分离。
参考文献:
[1]闵 炬,施卫明. 不同施氮量对太湖地区大棚蔬菜产量、氮肥利用率及品质的影响[J]. 植物营养与肥料学报,2009,15(1):151-157.
[2]陈温福,张伟明,孟 军. 农用生物炭研究进展与前景[J]. 中国农业科学,2013,46(16):3324-3333.
[3]Jones D L,Rousk J,Edwards-Jones G,et al. Biochar-mediated changes in soil quality and plant growth in a three year field trial[J]. Soil Biology and Biochemistry,2012,45:113-124.
[4]Lin Y X,Ding W X,Liu D Y,et al. Wheat straw-derived biochar amendment stimulated N2O emissions from rice paddy soils by regulating the amoA genes of ammonia-oxidizing bacteria[J]. Soil Biology and Biochemistry,2017,113:89-98.
[5]Qin X B,Li Y E,Wang H,et al. Long-term effect of biochar application on yield-scaled greenhouse gas emissions in a rice paddy cropping system:a four-year case study in south China[J]. Science of the Total Environment,2016,569/570:1390-1401.
[6]姚 欽. 生物炭施用对东北黑土土壤理化性质和微生物多样性的影响[D]. 北京:中国科学院大学(中国科学院东北地理与农业生态研究所),2017.
[7]Bamminger C,Zaiser N,Zinsser P,et al. Effects of biochar,earthworms,and litter addition on soil microbial activity and abundance in a tem-perate agricultural soil[J]. Biology and Fertility of Soils,2014,50:1189-1200.
[8]Steinbeiss S,Gleixner G,Antonietti M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry,2009,41(6):1301-1310.
[9]张梦阳,夏 浩,吕 波,等. 短期生物炭添加对不同类型土壤细菌和氨氧化微生物的影响[J]. 中国农业科学,2019,52(7):1260-1271.
[10]Abujabhah I S,,Richard B D,Sally A B,et al. Assessment of bacterial community composition,methanotrophic and nitrogen-cycling bacteria in three soils with different biochar application rates[J]. Journal of Soils and Sediments,2017,18(1):148-158.
[11]Liu S N,Meng J,Jiang L L,et al. Rice husk biochar impacts soil phosphorous availability,phosphatase activities and bacterial community characteristics in three different soil types[J]. Applied Soil Ecology,2017,116:12-22.
[12]武爱莲,丁玉川,焦晓燕,等. 玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报,2016,24(6):736-743.
[13]顾美英,葛春辉,马海刚,等. 生物炭对新疆沙土微生物区系及土壤酶活性的影响[J]. 干旱地区农业研究,2016,34(4):225-230,273.
[14]郑慧芬,吴红慧,翁伯琦,等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性[J]. 中国土壤与肥料,2019(2):68-74.
[15]赵兰凤,张新明,程 根,等. 生物炭对菜园土壤微生物功能多样性的影响[J]. 生态学报,2017,37(14):4754-4762.
[16]方 明,任天志,赖 欣,等. 花生壳生物炭对潮土和红壤理化性质和温室气体排放的影响[J]. 农业环境科学学报,2018,37(6):1300-1310.
[17]Wu Y P,Na D,Wang W,et al. Effects of different soil weights,storage times and extraction methods on soil phospholipid fatty acid analyses[J]. Geoderma,2009,150(1/2):171-178.
[18]Frostegrd ,Bth E,Tunlid A. Shift in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry,1993,25(6):723-730.
[19]Prayogo C,Jones J E,Baeyens J,et al. Impact of biochar on mineralisation of C and N from soil and willow litter and its relationship with microbial community biomass and structure[J]. Biology and Fertility of Soils,2014,50(4):695-702.
[20]Taketani R G,Tsai S M. The Influence of different land uses on the structure of archaeal communities in amazonian anthrosols based on 16S rRNA and amoA Genes[J]. Microbial Ecology,2010,59(4):734-743.
[21]Harter J,Weigold,P,El-Hadidi M,et al. Soil biochar amendment shapes the composition of N2O-reducing microbial communities[J]. Science of the Total Environment,2016,562:379-390.
[22]袁晶晶,同延安,卢绍辉,等. 生物炭与氮肥配施改善枣区土壤微生物学特性[J]. 植物营养与肥料学报,2018,24(4):1039-1046.
[23]Luo S S,Wang S J,Tian L,et al. Long-term biochar application influences soil microbial community and its potential roles in semiarid farmland[J]. Applied Soil Ecology,2017,117/118:10-15.
[24]Anderson C R,Condron L M,Clough T J,et al. Biochar induced soil microbial community change:Implications for biogeochemical cycling of carbon,nitrogen and phosphorus[J]. Pedobiologia,2011,54(5/6):309-320.
[25]Watzinger A,Feichtmair S,Kitzler B,et al. Soil microbial communities responded to biochar application in temperate soils and slowly metabolized 13C-labelled biochar as revealed by 13C PLFA analyses:results from a short-term incubation and pot experiment[J]. European Journal of Soil Science,2014,65(1):40-51.
[26]He L L,Bi Y C,Zhao J,et al. Population and community structure shifts of ammonia oxidizers after four-year successive biochar application to agricultural acidic and alkaline soils[J]. Science of the Total Environment,2018,619/620:1105-1115.
[27]蓋霞普,刘宏斌,翟丽梅,等. 生物炭对中性水稻土养分和微生物群落结构影响的时间尺度变化研究[J]. 农业环境科学学报,2016,35(4):719-728.
[28]Spokas K A,Baker J M,Reicosky D C. Ethylene:potential key for biochar amendment impacts[J]. Plant and Soil,2010,333(1/2):443-452.
[29]Thiessen S,Gleixner G,Wutzler T,et al. Both priming and temperature sensitivity of soil organic matter decomposition depend on microbial biomass-An incubation study[J]. Soil Biology and Biochemistry,2013,57:739-748.
[30]Anyika C,Majid Z A,Rashid M,et al. Toxic and nontoxic elemental enrichment in biochar at different production temperatures[J]. Journal of Cleaner Production,2016,131:810-821.
[31]Anderson C R,Hamonts K,Clough T J,et al. Biochar does not affect soil N-transformations or microbial community structure under ruminant urine patches but does alter relative proportions of nitrogen cycling bacteria[J]. Agriculture,Ecosystems & Environment,2014,191:63-72.
[32]Lehmann J,Rill M C,Thies J,et al. Biochar effects on soil biota-a review[J]. Soil Biology and Biochemistry,2011,43(9):1812-1836.
[33]Steinbeiss S,Gleixner G,Antoniett M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry,2009,41(6):1301-1310.
[34]程 扬,刘子丹,沈启斌,等. 秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响[J]. 生态环境学报,2018,27(10):1870-1877.
[35]Wang X B,Song D L,Liang G Q,et al. Maize biochar addition rate influences soil enzyme activity and microbial community composition in a fluvo-aquic soil[J]. Applied Soil Ecology,2015,96:265-272.
[36]李 明,胡 云,黄修梅,等. 生物炭对设施黄瓜根际土壤养分和菌群的影响[J]. 农业机械学报,2016,47(11):172-178.
[37]Muhammad N,Dai Z M,Xiao K C,et al. Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J]. Geoderma,2014,226(1):270-278.
[38]Yao M J,Rui J P,Niu H S,et al. The differentiation of soil bacterial communities along a precipitation and temperature gradient in the eastern Inner Mongolia steppe[J]. Catena,2017,152:47-56.
[39]Warnock D D,Lehmann J,Kuyper T W,et al. Mycorrhizal responses to biochar in soil-concepts and mechanisms[J]. Plant Soil,2007,300:9-20.
[40]Farrell M,Kuhn T K,Macdonald L M,et al. Microbial utilisation of biochar-derived carbon[J]. The Science of the Total Environment,2013,465(6):288-297.
[41]Bamminger C,Zaiser N,Zinsser P,et al. Effects of biochar,earthworms,and litter addition on soil microbial activity and abundance in a tem-perate agricultural soil[J]. Biology and Fertility of Soils,2014,50:1189-1200.
[42]Khadema A,Raiesib F. Responses of microbial performance and community to corn biochar in calcareous sandy and clayey soils[J]. Applied Soil Ecology,2017,114:16-27.
[43]Liu Y J,Mao L,Li J Y,et al. Resource availability differentially drives community assemblages of plants and their root-associated arbuscular mycorrhizal fungi[J]. Plant and Soil,2015,386(1/2):341-355.
[44]陳 坤,徐晓楠,彭 靖,等. 生物炭及炭基肥对土壤微生物群落结构的影响[J]. 中国农业科学,2018,51(10):1920-1930.
[45]朱永琪,董天宇,宋江辉,等. 生物炭影响土壤重金属生物有效性的研究进展[J]. 江苏农业科学,2018,46(16):9-14.
[46]李 兴,勾芒芒,屈忠义,等. 生物炭对沙壤土水分特征的影响[J]. 江苏农业科学,2018,46(12):280-283.
[47]Rousk J,Bth E,Brookes P C,et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. ISME J,2010,4(10):1340-1351.彭 亮,董 斌,方 磊,等. 基于均方差-TOPSIS模型的土地资源综合承载力评价——以安徽省六安市为例[J]. 江苏农业科学,2020,48(11):259-265.

